|
| 図 1. 四分法 |
一般に、分析する対象の量は分析に要する分量よりはるかに多く、 まず適切に分析試料を抽出(サンプリング)する必要があります。 特に大気や環境水のモニタリング、食品の分析や鉱石の品位の決定など、 安全や商取引に関わる問題に関わっては、さまざまな利害も関わって、 試料をいかに適切に用意するかが大きな問題となります (たとえばコンクリートに使われる砂利などに関わって、 サンプリングについての JIS 規格さえあります(JIS A1158「試験に用いる骨材の縮分方法」))。 またそうして得た試料を、溶解したり不要物を除いたりして分析しやすい形にする、 前処理と呼ばれる操作が必要なこともしばしばです。 ここでは学生実験でよく出会うサンプリングと試料の溶解法について簡単に触れておきます。

|
| 図 1. 四分法 |
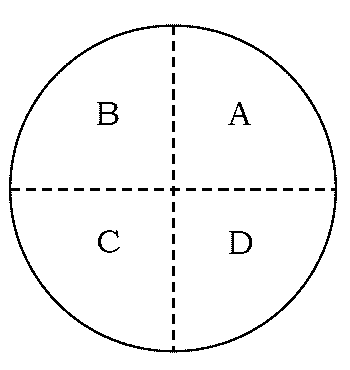
サンプリングに当たって特に注意すべきは、いかに恣意を交えずに、 分析対象から目的にかなった分析試料を得るかです。 学生実験では、再結晶等で得られた数g~数十g の粒状の生成物から 1 g以下程度(IRの測定では数十 μg)の分析試料を得るという操作にしばしば出会います。 得られた生成物が1 g 程度なら、ガラス棒やスパチュラを用いてすり潰し、 均一な試料としてそこから分析試料を取ればよいのですが、生成物が 10 g 近くなると難しくなります。 このような場合、四分法 quartation と呼ばれる手法がよく用いられます。 典型的な四分法では、一端、粉末試料を山状に盛って円盤状に均し、図 1 のようにそれを大まかに四等分します。 次いで対角線方向の2つの分画 A と C(あるいは B と D)を取り出して分析試料とします。 これで対象は半量に減るわけですが、まだ量が多いなら、同様の操作を適切な量になるまで繰り返します。 比較的試料が均質であれば、図の A と C の扇形の分画の中心角を適宜調整してもよいでしょう。
液体試料のように比較的均一なサンプルを得やすいものでもあっても、 混合が不十分であると偏った結果を与えることになるので、 あらかじめよく攪拌・混合しておくのが肝要です。 また河川や湖沼の水質分析等にあたっては、 採水地点や採水の時期等を事前によく検討しておく必要があります。
固体の試料を分析する場合、 しばしば溶液状態にして分析することになります。
無機化合物はたいていの場合水溶液にします。 そのままでは水に溶けない場合には、物質に応じた種々の方法が用いられます。 たとえば炭酸カルシウムや酸化銅等の塩基性塩については、塩酸で溶解させることができ、 銅やニッケルなどの金属の場合には硝酸を用いて酸化的に溶解させます。 塩酸や硝酸単独で困難な場合には、種々の錯体の形で溶解させることも行われ、 金や白金などについて王水(塩酸と硝酸の混合物。金や白金はクロロ錯体が安定)を用いるのはよく知られているでしょう。 鉱物などでケイ酸塩などの形で安定に存在しているものについては、 一端、種々の融剤(フラックス flux)と強熱してから抽出するという手法もとられます。 融剤としては炭酸ナトリウムや硫酸水素カリウム KHSO4、フッ化水素カリウム KHF2 などがよく知られています。
有機化合物については、通常無極性物質はトルエンなど極性の低い溶媒に、 極性の物質はアセトンやアルコールなど極性の溶媒によく溶けます。 複雑なケースについては疎水性パラメーター log P などが判断材料として使えます。