|
|
| 図 1a. メニスカス | 図 1b. シェルバッハの青線 |
定量的にかつ迅速に進行する化学反応の当量関係を利用して、 濃度既知の溶液(標準溶液)と当量的に反応する溶液の体積の関係から、 未知の溶液の目的成分の濃度を決定する方法を一般に容量分析と呼びます。 利用する反応によって、容量分析は大きく、(1) 中和(酸塩基)滴定、(2) 酸化還元滴定、(3) キレート(錯)滴定、(4) 沈殿滴定に大別されます。 測容器の精度はおおむね1/1000程度なので、 容量分析では通常 1/1000の精度が期待されます。 この精度を実現する上で、体積の測定精度、標準溶液の濃度の精度、当量関係の精度(反応の鋭敏さ)がともに重要になってきます。 ここではそうした実験操作にかかわって、 実際上の問題について紹介しておきます。 なお生体試料など、そもそも試料自体のばらつきが大きく、 せいぜい 1/100 程度の精度しか求めない分野も多いのですが、 そうした分野では、またちがったアプローチ・手法が登場することになりますが、ここでは触れません。
滴定の分解能を決めているのはビュレットから溶液を滴下する際の1滴の体積といってよいでしょう。 通常のビュレットから滴下される 1 滴の体積はおよそ 0.05 mL程度です。 これを半滴程度ずつ滴下することで、分解能を0.02 mL(半滴程度)程度にすることが通常行われます。 したがって 1/1000 の精度を実現する上では、滴定量が 20 mL程度の実験スケールが望ましいことになります。 実際 JIS などで分析法としてマニュアル化されているものでは、実験スケールとしておおむね 20 mLが採用されています。 学生実験の場合には、よい精度での分析実験を体験する意義と大量の廃液の発生のコストとの兼ね合いから、 実験スケールとしてはおおむね 10 mL を採用しています。
容量分析では、試料の間の互いの当量関係、濃度の相対値を求めることになります。 したがって標準とする溶液の調製が重要な問題となります。 標準物質に何を用いるかには、さまざまな流儀がありますが、 日本産業規格(JIS K8005「容量分析用標準物質」)では高い精度の分析に使用される1次標準試薬として、次の試薬が指定されています。
いずれも室温で安定な固体で、JIS の基準に合致した市販品が(少し高価ですが)容易に入手できます。 こうした標準物質を用いて、調製した溶液の濃度を定める操作を標定 standardization といいます。 ただし通常の実験に用いる分には、このような高純度・高安定のものは必ずしも必要とはされず、 例えば学生実験の中和滴定ではシュウ酸二水和物で十分です。
容量分析に使われる器具は長年にわたり、多くの人々の工夫を経てほとんど完成の域に達しているといってよいでしょう。 容器のクチバシの向き、ピペットの管の太さ、ロートの足の長さ・太さ・形状など、 ごく何でもないような部分にも多くの先人の苦心があります。

|

|
| 図 1a. メニスカス | 図 1b. シェルバッハの青線 |
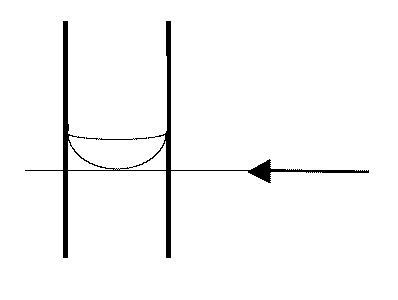
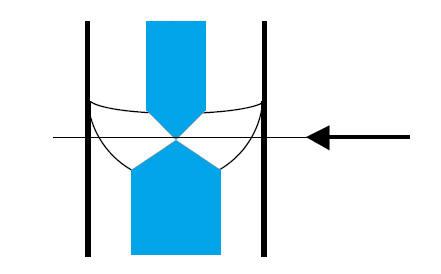
通常、ガラス管の中の液面は横から見ると三日月形(メニスカス meniscus。ギリシャ語で新月の意)に見えます。 この一番くぼんだ部分の高さを液面の高さとします。 少し高価ですが青線(シェルバッハ Schellbach の青線)の入ったビュレットでは、 メニスカスの部分で青線が一番くびれて見える部分を液面の高さとします。 なお過マンガン酸カリウム溶液のように、強く着色している溶液の場合には、 くぼんだ部分ではなく、液面の上端を読むようにします。
読み取りを容易にするために、ビュレットに鉢巻のように紙片を巻く、 さらにその紙片に青線を引いておく、 ルーペを用いたり老眼鏡をかけたりして拡大する、 などさまざまな工夫が行われてきました。 自分の好みの手法に従ってよいでしょう。
なおこのメニスカスが再現性よく実現されるためには、ガラス管がきれいに塗れていることが重要で、 器具は前もって石鹸液に浸けるなどしてよく洗浄しておきます。
測容器には、「受け用」のものと、「出し用」のものがあります。 測容器にはこのことを示すため、次のような刻印がしてあります(E、Aは使わない方向):
これは液体を出し入れする時、容器に付着した分だけの差が出るためで、 10 mLのホールピペットでは 0.2 mL 程度になります。 残着量は用いる液体の粘度によっても変化しますが、 水を使う前提で市販の測容器の目盛付は行われています。 水以外の溶媒を用いる場合には考慮が必要になります。
残着量を一定に保つには、ピペット等の内部が均一に塗れてくれることがもっとも重要です。 通常の実験条件では、表面が油などで汚染されることによって、実験を続けているとガラスの表面が水をはじくようになります(特に髪の毛の油)。 したがって、ピペット等は使用に先立って、洗剤に付けるなどして、よく水に塗れる状態にしておきます。 磨き砂(クレンザー)での洗浄は、ガラス器具のよごれを落とす上で大変有効ですが、 測容器の内部の洗浄には用いない方がよいのです。 磨き砂を使うとガラス表面が削れ、容量が変化することにつながります。 洗剤につける以外に、発煙硫酸などより強力な薬品で清浄にすることもありますが、 初心者には危険なので、学生には使用させないことにしています。 なおピペット等の洗浄に用いる洗剤は強力なものなので、みだりに手に付けたりしないようにしてください。
ピペット・ビュレットから液を出す時、残着量が減って一定になるまで、いくらでも時間をかければよいようなものですが、 それでは日が暮れてしまいます。 市販のピペットは、適正な流出速度になるように先端の穴の大きさを調節してあり、 流出が止まったら残滴の処理をして操作を切り上げればよいでしょう(残着量はおおむね時間の平方根に逆比例して減っていきます)。 ピペットから液を出す時、上から息を吹き込んで速く出したりしてはいけません。 また先の欠けたピペットを使用する際には、流出速度が速すぎないかチェックします。 同様に滴定の際、ビュレットからあまり速く液を滴下すると、見かけ上、当量点より入れ過ぎた結果となります。
ホールピペットから液を出した後、先端に残った液をどうするかは厄介な問題です。 日本の市販のピペットをそのまま使う分には、 ピペットの先端を容器の器壁に軽く当てがい、吸い口を指で閉じ、手で暖めるなどして、 最後の一滴まで出して使用します(そうした前提で日本では目盛りが付けられています)。 この際あまり時間をかけすぎると、所定の量より多めの溶液を取る結果になります (10 mLのホールピペットで0.03 mL程度)から操作は手早く行います。 またピペットの洗浄に当たっては、ピペットの外部を磨き砂など用いて洗い、先端部がよく水に塗れるようにしておきます。
濡れたままのビュレットやピペットで溶液を測り取るとき、 溶液が貴重なものでない場合には、測り取る溶液を少量とって、 ビュレットやピペットの内面をゆすいでから使用します。 これを共洗いといいます。 濡れた試薬ビンに、溶液を入れたりする場合も同様です。
溶液の量が少なかったり、貴重なサンプルである場合には、 器具を乾燥させてから使用することになりますが、 測容器の場合には高温で乾燥させるのは避けた方がよいでしょう。 ガラスの表面が親水性を失って、水をはじくようになったり、 また温度を変化させたとき、 ガラス容器の内容積が完全には元に戻らず微妙に変化する可能性があるからです。
溶液の調製にあたっては、どの程度の精度が要求されているかをよく考えて、天秤・測容器の選定を行います。 また固形物を溶解して精確な濃度の試料溶液を作成する際、 秤量に用いる容器、容器に移す操作法についてはさまざまな流儀・流派がありますが、 それぞれの流儀の目指すところをよく弁(わきま)えておくことが大切です。 たとえば秤量に時計皿を用いるのは、溶液を作る際に洗ビンで試料固体を容器に洗い落とすのに都合がよいからです。 秤量瓶を用いるのは、蒸発、飛散や潮解を防ぐためです。 あるいは秤量した固形物を一端ビーカーなどで溶解した上でメスフラスコに入れ、溶液を調製するのを推奨する流儀もありますが、 これは溶解速度が遅い場合を想定してのことです。 通常の試薬の場合には、ロートを用いてメスフラスコの中に秤量した固形物を注ぎ込み、 適量の溶媒を入れて振り混ぜて溶液を調製する方が、試料の汚染の起きる可能性が少なく優れています。 昔のメスフラスコには、手で持って振り混ぜると破損するようなものもあったそうですが、 最近のメスフラスコではそうしたことはまず起きません。 またメスフラスコに溶液を流し込む際、ロートを使わない流派もありますが、 これは中間に多くの器具を用いて、試料の汚染が起きるのを防ぐためです。 けれども初心の内は、溶液を零す可能性が高く、 お薦めしません。
ただ単にある溶液を水に注ぎ込むだけでは、均一な溶液はえられません。 初心のうちは、調製した溶液が均一になるよう特に留意します。 たとえばメスフラスコに取った溶液の混合が十分でないと、 ピペットでフラスコの底の濃度の高い部分を吸い取って滴定を始め、滴定を繰り返すと滴定値が小さくなっていくようなことが起きます。 あるいは放置しておいて固形物が溶解したからといって、必ずしも均一な溶液になっているわけではありません。 ビーカーで溶液を調製する時は、ガラス棒などでよく攪拌します。 メスフラスコで溶液を調製する時は、標線まで液を満たした後、 栓をして数回逆さにしたり元に戻したりして混ぜるようにします (指で塞いで振り混ぜるのを好む人もいるようです)。
滴定に当たっては、滴定する溶液をコニカル(円錐)ビーカー(あるいはビーカー、三角フラスコ)にとり、 ビュレットから溶液を滴下して当量に達したところを求めます。 滴下する溶液の混合の方法によって用いる容器は異なってきます。 容器自体を振り混ぜることで混合を行う時には、 振り混ぜる際に内容物がこぼれ出ないよう、コニカルビーカーや三角フラスコが用いられます。 ガラス棒あるいはマグネチック・スターラーなど用いて撹拌する場合には、 普通のビーカーで構いません。 なお普通のビーカーでは、ガラス棒などで攪拌するため試料の汚染が起きる可能性が高まり、 専門的にやる向きにはコニカルビーカーが主に用いられます。
なおガラス棒で撹拌する場合に、あまり激しく撹拌すると、ビーカーのガラスの壁面に傷が付くので、 撹拌する時に大きな音をたてるのはよくありません。
滴定する時、反応させる2つの溶液の内、どちらをビュレットから滴下する方に選ぶかは、その時々の状況によります。 1 回の滴定をするだけなら原理的にはどちらをビュレットから滴下する方に選んでもよく、 調製が容易で安価なものを滴下する方に選ぶのが普通です。 ただし1次標準溶液を用いた滴定で、標定操作を経て2つの溶液の濃度比を決定するような場合には、 測容器の誤差を小さくする意味で、同じ溶液を同じビュレットから滴下するようにすべきです。
なお滴下される側の溶液は、通常、イオン交換水などを用いて数倍に希釈します。 これはコニカルビーカーなどの容器の器壁に付着した溶液による、 滴定値の負の誤差をできるだけ小さくするためです。
最初ビュレットに溶液を 5-10 ml入れて内壁を良く濡らした後、液を排出して洗浄します。 この共洗い操作を2回程度繰り返し、内壁が清浄になったことを確認後、 ロートなどを利用して上端の目盛線より上まで溶液を満たします。 素早くコックを開閉してコックや先端部分の気泡を追い出し、液面が目盛 0 より下に来るようにします。 コックのすぐ下には気泡が残りやすいので特に注意します。 気泡が残っていると、滴定中に気泡が出てきたりして誤差の原因となります。
注液操作が終わったら、メニスカスより上方の器壁に残着した溶液が落ちてくるのに若干の時間を要するので1分程度待ち、 メニスカスが落ち着いてから目盛りを読み取り、溶液の滴下を開始します。 ビュレットの上にロートを載せたままにしていると、 滴定中にロートとビュレットの内壁の間に溜まった溶液が落ちて誤差の原因となります。 なお読み取りの誤差を小さくするためと称して、 最初に 0.00 や 1.00 など切りの良い目盛りにメニスカスを合わせて滴定を行うことを推奨する向きもありますが、 それは滴定値のばらつきを小さくすることには貢献しても、滴定値にかたよりをもたらすので推奨はできません。
溶液の滴下に当たって、終点付近までは滴下速度をいくらでも大きくしてよいようなものですが、 あまり早すぎるとビュレットの内壁の残着量が不安定になります。 終点付近まではせいぜい 1 秒 1~2 滴程度のペースにするのがいいでしょう。
1 滴の体積はおよそ 0.05 mL程度です。 当量点での変色が明瞭で、他の操作が十分な精度で行われておれば、 最初にも触れましたが、これが滴定の精度を決める要因になります。 したがって、終点近くではビュレットの先端にたまった液滴を、 ビーカーの器壁にこすりつけたりガラス棒で取ったりして半滴ぐらいずつ落とすようにします。 コニカルビーカーの形状は、こうした操作がスムーズにできるように設定してあります。
ビュレットから溶液を滴下する時、活栓の操作にはいろいろ流儀があり、 片手で操作するのをよしとする派と、両手で操作するのをよしとする派があります。 片手で操作する流儀が今日では多数派のようです(以下、右利きの場合。ちなみに現在市販されているビュレットは、ぼくの知る限りすべて右利き用です)。 この流儀では左手で活栓を包み込むように持って操作し、 同時に右手で溶液の撹拌を行います。 この派の“売り”は、滴下と撹拌を同時に行うことで、慣れれば滴定操作が迅速に進むことです。 両手で操作する派では、左手でビュレットの根元を押さえ、右手で活栓を操作します。 そして滴下しては、活栓から手をはずして撹拌して終点かどうかを確認します。 この方法は、活栓が固かったりした場合に、片手の操作では微妙な調整が難しいときに有利です。 ぼくは ”片手派” ですが、このあたりは人の好みというところでしょうか。
学生実験では、滴定の終点は、ほとんど指示薬の色の変化で見分けます。 色の変化を見やすくするように、コニカルビーカーの下に白い紙なりを敷いておくのがよいでしょう (変色に応じて色紙を使う人もいるようです)。 また終点の判定は利用する反応によって異なります。 ここでは特に指示薬の働きに注目する形で、滴定に当たっての留意点を挙げておきます。
中和滴定に用いられる指示薬は、それ自身が酸あるいは塩基として振る舞い、 溶液が酸性になれば酸型が、塩基性になれば塩基型が優勢になって変色が起きます。 したがって酸型と塩基型の中間色になった所を終点にとるのが普通です。 たとえば BTB の場合であれば、黄色と青の中間、緑になったところが終点ということになります。
なお強酸を強塩基で滴定する時は pH が 7 付近で、弱酸を強塩基で滴定する場合は pH が 7 より高いところで、 弱塩基を強酸で滴定する場合は pH が 7 より低いところで中和にともなう pH の大きな変化が起きます。 それぞれの場合に即した適切な指示薬を選定する必要があります。 また pH の変化をより明敏に検出するためにいくつかの指示薬を混合して使用する(混合指示薬)ことも行われます。 混合指示薬は光分解しやすいようで(光増感反応が起きるようです)、 保存には遮光が重要です。
酸化還元滴定では、pHの変動をモニターする酸塩基滴定と違い、酸化剤・還元剤の量の変化を直接観察します。 したがって、酸塩基滴定のように中間色になった所ではなく、 完全に変色したところが終点となります。 たとえば過マンガン酸滴定では、わずかでもピンク色になったところが終点です。
なお先にも触れましたが、過マンガン酸の色は濃いので、メニスカスの底ではなく上端を読むのが普通です。 またヨウ素-デンプン反応による発色は、ヨウ素とデンプンの間の錯体形成によるものですが、 温度が高くなる、あるいは有機物などが共存すると見づらくなるので注意が必要です。
キレート滴定では、金属イオンとキレート試薬(もっぱらEDTAが使われる)が安定な錯体を作ることを利用します。 無論、金属指示薬も安定な錯体を作って変色するわけですが、 キレート試薬はそれよりケタ違いに安定な錯体を作るように設定されているので、 たとえば EBT の場合は滴定の終点として、完全に赤みの消えたところを取ります。
キレート滴定では、pH の設定に注意を払う必要があります。 まずEDTAが直接的にキレート生成にかかわるのは負イオンとしてですが、 pH が低くなると負イオンとして溶存する量が減少し、キレート生成が押さえられるようになります。 したがって安定なキレートを作らない系では、pH を高めに設定する必要があります。 さらに、一般に金属指示薬は酸(塩基)としても振る舞い、pH の変化によっても、錯イオンを形成する場合と同様の色の変化を示します。 このため緩衝溶液を用いて、溶液の pH を所定の値にしておく必要があります。
試料に余裕があるなら、実験精度をチェックする上で滴定を繰り返すのがよいでしょう。 滴定を繰り返すに当たっては、試料溶液採取から滴定までの一連の操作を繰り返すのが、 実験結果の独立性を保証する上で好ましいでしょう。 はじめに3個なりの試料溶液を準備し、滴下操作を連続して行う流儀もあります。 この流儀は所要時間が短くてすみますが、個々の操作の独立性が低く薦められません。 特に初心者の場合、滴定値のばらつきは、終点の判定の不確かさより、器具の洗浄や試料溶液を正しく採取したかどうかに依存する場合が多く、 一つ一つの基本操作を確実に行うことを心がけるべきです。