2020.5
吉村洋介
化学実験法II 問題集 最小2乗法 解説
問 7
7.【2011試験問題】以下の文章を読み、問に答えよ。
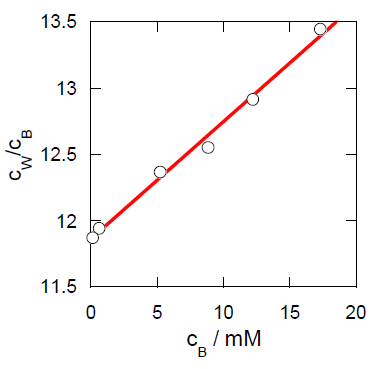
25 °C で濃度を変化させて、水相とベンゼン相に分配される塩化水銀(II)の平衡濃度 cW、cB を測定して次の結果を得た(1 mM = 0.001 mol/L):
| cW/mM | 233 | 158 | 111.2 | 64.8 | 7.38 | 1.84 |
| cB/mM | 17.3 | 12.22 | 8.86 | 5.24 | 0.618 | 0.155 |
水中で塩化水銀はほとんど解離せず HgCl2 として溶存し、
一部会合してHg2Cl4となっており、
ベンゼン中では HgCl2 として溶けていると考えよう。
すると水中の塩化水銀濃度 cW は単量体濃度 cW(M) と二量体濃度 cW(D) の和
cW(M) + 2cW(D) で表され、
ベンゼン中濃度 cB は単量体濃度 cB(M)に等しい。
ここで(1)水とベンゼンの間の単量体の分配定数 Kp、
(2) 水中の 2HgCl2 ⇔ Hg2Cl4の平衡定数 Kd を考えると、
それぞれ次の関係が成り立つ:
Kp = cW(M) / cB、Kd = cW(D) / cW(M)2
したがって次式が成り立つ:
cW/cB = イ + ロ cB
つまりcW/cB を cB に対してプロットすれば直線関係が得られ、
切片と勾配からKp、Kdが定まる。
実際にプロットすると図のような直線関係が得られた。
7-1.文中 イ、 ロ にあてはまる係数を Kp、Kd を用いて表わせ。
7-2.図のプロットに対し最小2乗法を用いて イ、ロ を求めたところ、イ =11.86、ロ = 0.089 / mM であった。
2量化平衡定数 Kd を求めよ。
7-3.最小2乗法で推定された イ、ロ の標準偏差は イ が0.04、ロ は 0.004 /mMであった。
上で得られた2量化平衡定数 Kd の標準偏差を評価せよ。(イ と ロ が統計的に独立でないことに注意)
解答例
7-1
水層中の塩化水銀の全濃度 cW の式について、与えられた平衡関係を整理すると
cW = cW(M) + 2cW(D)
= cW(M) + 2 Kd cW(M)2
= Kp cB + 2Kd [Kp cB]2
より 【イ】【ロ】
cW/cB = Kp + 2Kd Kp2 cB
7-2
先に得た関係式から、値を代入すれば
Kd = ロ/2 Kp2 =ロ/ 2イ2
= 3.16 × 10-4 mM-1
7-3
y = ax + b という式に最小2乗法で当てはめて推定されるパラメータ a、b について、
a の分散 ⟨⟨ a2 ⟩⟩ と共分散 ⟨⟨ ab ⟩⟩ の間には、
次の関係が成立する( \(\bar{x}\) はxの標本平均)。
\[
\langle \langle ab \rangle \rangle = -\bar{x} \langle \langle a^2 \rangle \rangle
\]
表の cBの平均は 7.4 mM なので、
⟨⟨ ab ⟩⟩ = -7.4 mM × (0.004 mM-1)2
= -1.2 × 10-4 mM-1
2量化平衡定数は a/2b2 で評価されている。
a° + δa、a° + δa という不確かさを含む量として a/2b2 を書くと
Kd = a/2b2 ≈ (a°/2b°2)(1 + (δa/a°) - 2(δb/b°))
したがって得られる二量化の平衡定数の分散 ⟨⟨ Kd2 ⟩⟩ は
⟨⟨ Kd2 ⟩⟩/K°d2
= ⟨⟨ a2 ⟩⟩/a°2 - 4 ⟨⟨ ab ⟩⟩/(a° b°) + 4⟨⟨ b2 ⟩⟩/b°2
= (0.004/0.089)2 + 4 × 1.2 × 10-4/(0.089 × 11.86) + 4 × (0.04/11.86)2
= 2.0 × 10-3 + 4.5 × 10-4 + 4.5 × 10-5 = 2.5 × 10-3
Kd の標準偏差はその 5 %、1.6 × 10-5 mM-1 ということになる。
最小2乗法のページへ