2020.4
吉村洋介
化学実験法II 問題集 輸送現象 解説
問 11
11.【16年度試験問題から】Y がエバポレーターでは減圧する代わりに新鮮な窒素ガスを吹き込むことで十分だという説を唱えている。
この説が学生に無視されているのを哀れに思った U 君は大先輩の Q 先生に尋ねてみた。以下の U 君と Q 先生の会話を読み問いに答えよ。
Q: エバポレーターは沸騰させない条件下で、溶媒を揮発させ濃縮する装置だということをまず確認しておこう。
沸騰、特に突沸など起こすと溶液が飛散して、せっかく濃縮しても回収するのが大変だ。
だからヘキサンで考えると、減圧するといってもせいぜい室温での蒸気圧 20 kPaぐらいまでだ。
U: 化学実験では減圧蒸留で使うダイアフラムポンプを使っていたので、
2 kPaぐらいにはなってると思ってたんですが圧力は高めですね。
ということはY説はそんなに間違ってるわけではないんですか?
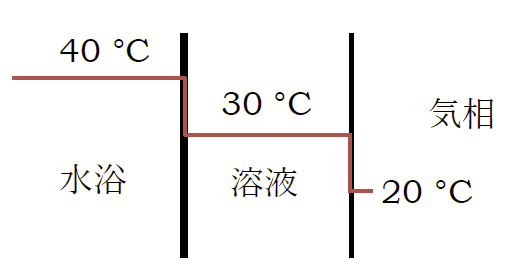
Q: まず熱伝導の立場から事態を見てみよう。
化学実験で使っているエバポレーターで、減圧しながら順調にフラスコ中のヘキサンを蒸発させている時の温度分布と熱の流れは、
定常状態では図のように整理できるだろう。
水浴の温度が40 °Cぐらいで、溶液の内部の温度はざっと30 °Cで溶液表面の温度は20 °C。
この表面から生じる蒸気を氷冷した冷却器で凝縮させるというかたちだ。
液体界面での熱伝達率はいろいろ変化するが、ここでは水浴-溶液、溶液-溶液表面の熱伝達率は同じで1000 W m-2 K-1 としよう。
フラスコと水浴の接触面積を 50 cm2 程度とすると、ヘキサンの蒸発熱はおよそ 300 J/g 程度だから イ 蒸発速度は0.2 g/s程度。
100 g 蒸発させるのに10分ぐらいというわけだ。
攪拌を激しくしたりしたら5分ぐらいにはなるだろう。
U: ちょっと乱暴な設定かと思いましたが、実際にやった体感と一致しますね。
この温度分布を実現するには、表面からかなりな速度でヘキサンが蒸発しないといけようですが、
Y説のように窒素を吹き込むのが有力に見えてきます。
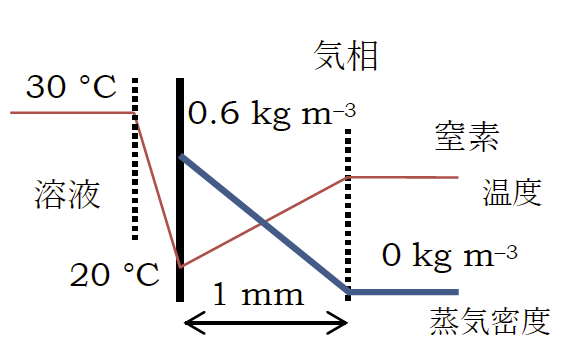
Q: 蒸発速度は溶液表面近傍のヘキサン蒸気の拡散速度に相当する。
ざっくり液面から 1 mm ぐらいの気相は(境界層で)動かず、その外は窒素という設定で考えることにしよう。
ヘキサンの 20 °Cの飽和密度は約 0.6 kg m-3 程度。
これが 1 mm ぐらいの層を通して窒素の中に拡散していく。
常圧で考えると、ヘキサン蒸気の拡散係数は 10 mm2 s-1 程度なので ロ 蒸発速度は 0.03 g/sでいささか足りない勘定になる。
水浴の温度を40 °C のまま、窒素吹込み法で濃縮するなら、ハ 溶液表面の温度は35 °C(ヘキサン蒸気の飽和密度1.0 kg m-3)くらいになり、
100 g 蒸発させるのに 30分ぐらいはかかるだろうね。
11-1.下線部イ、ロ、ハのようにQ先生が評価した根拠を、それぞれYにも分かる程度に説明せよ。
11-2.Q先生の議論を参考に、粘性の高い溶液をエバポレーターで濃縮するのに時間がかかる理由を述べよ。
11-1.
【イ】
熱の供給量は
h ΔT S = 1000 W m-2 K-1 × 10 K × 50 cm2 = 50 W
単位時間当たりの蒸発量は
50 W/(300 J/g) = 0.166 g/s ~ 0.2 g/s
【ロ】
1 mm程度の境界層を通しての拡散流束は
J = DΔc/L = (1×10-5 m2 s-1) × (0.6 kg m-3)/(1×10-3 m) = 6 g m-2 s-1。
単位時間当たりの蒸発量は
JS = 6 g m-2 s-1×50 cm2 = 0.03 g s-1
【ハ】
蒸発流束は
J = DΔc/L = (1×10-5 m2 s-1) × (1.0 kg m-3)/(1×10-3 m) = 10 g m-2 s-1
蒸発による熱流束は
10 g m-2 s-1 × 300 J/g = 3000 W m-2
合成熱伝達率は500 W m
-2 K
-1 なのでフラスコ表面と液面の温度差は6 Kぐらいで、設定の35 °Cと一致する。
またこの時の蒸発速度は
3000 W m-2 × 50 cm2/(300 J/g) = 0.05 g/s
で 100 g 蒸発するのに 2000 s。30分ぐらいかかる。
11-2.
粘性が高いと熱伝達率が低くなり、蒸発熱の供給が滞るから。
輸送現象のページへ

