図1. 熱起電力による熱機関。 熱起電力を用いてモーターを回す。
ゼーベック Seebeck 効果やペルチエ Peltier 効果(ペルティエ、ペルチェとも)については、 耳にしたことがあるでしょう。 ここでは電子やフォノンといった話は置いておいて、 いったいどういう現象で、 どのように利用できるかに触れてもらえることを期待しています。

図1. 熱起電力による熱機関。 熱起電力を用いてモーターを回す。
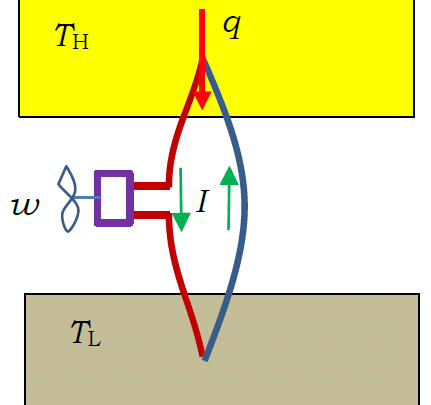
ゼーベック効果とペルチエ効果を考える上で、 熱力学で勉強する熱機関 heat engine の話は示唆に富んでいます。 温度差に応じて電圧が発生し(ゼーベック効果)、 電流に応じて熱の吸収・発生が起きる(ペルチエ効果)わけですが、 これから熱機関を構成することができます。 図 1 のように、温度 TH の高温熱源と温度 TL の低温熱源を考え (温度差 ΔT = TH - TL は十分小さい)、 そこに異なる材質 X と Y でできた2本の線でできた回路を挿入します。 そして回路の途中に高効率のモーターを付けて、仕事をさせることにします。
ゼーベック効果で温度差 ΔT = TH - TL に比例して熱起電力 V = S ΔT が発生したとしましょう。 この熱起電力で電流 I が生じ、 モーターが仕事をします。 これだけなら「永久機関」ですが、 電流が生じるとそれにともなって、熱の吸収、発生が起きるというペルチエ効果が働きます。 おおざっぱに言って、 単位時間当たりペルチエ効果で高温熱源から低温熱源に電流 I に比例して熱量 q = Π I が流れ、 そこからモーターの仕事が取り出されているわけです。
さて単位時間当たりのモーターの仕事は電圧×電流、VI であらわされますから、 熱効率は VI/q = S ΔT I / Π I = S ΔT / Π ということになります。 熱力学で温度差 ΔT の間で運転される熱機関の最大効率はΔT/TH と習いますが、 この熱起電力によるモーターの熱効率が最大効率であるとすると、 ゼーベック効果の大きさを表す係数 S とペルティエ効果の大きさを表す係数 Π との間に、 次の関係が成り立つことになります。
S TH = Π
ここでの説明は(例によって)いい加減ですが、 一つ付け加えると、低温熱源に運ばれる熱量は q - w になっているはずで、 ペルチエ効果から期待される発熱量 q が抑制される、 何らかのメカニズムがあるはずです。 これがトムソン効果として知られるものに対応することになります。 また抵抗による発熱、ジュール熱も気になるところですが、 ジュール熱は電流の2乗に比例するので、 十分電流の値を小さくとれば(「準静的過程」)無視できます。
熱電対は異なる材質の素線を組み合わせてできていて、 両端の温度に応じて電圧(熱起電力)が現れます。 今回取り上げる K 熱電対(クロメル-アルメル)、T 熱電対では、 室温付近で 10 °C あたり 0.4 mV ぐらいです。 ポイントはこの時生じる電圧が、中間の温度によらないということです。 例えばライターで熱電対の中間地点を焙っても、 電圧はまず変化しません。
実際には、熱電対線の組成が不均一だったり、歪が影響したりして変化することがあります (寄生熱起電力 parasitic emf (spurious emf) と呼ばれるもの。 むやみと熱電対線を捩ったりするのはよくない)。 また K 熱電対の場合、300 ~ 500 °C 程度で金属組織の変化が起き、 測っているうちに温度が数°C 高めに出てしまうことがあり(ショートレンジオーダリング short range ordering)、 あらかじめ熱処理しておくのがよいそうです。 先輩にそう言われたものの、ぼくはせいぜい200 °C までの実験をするだけだったので、 サボってました・・・
熱電対の起電力はマルチメータ(アジレント U1251A)で測ってもらいます。 今時のこのクラスのマルチメータ(~数万円)であれば、 熱電対の出力を温度に換算して出力するモードが標準で付いています。 直接電圧を読んでもらうもよし、 換算した温度を読んでもらうのもよしということにしています。
こうした熱電対線を使ったことのある人の中には、 ここで使用している K 熱電対線に緑色の縞が入っていて、 青ではないことに不審を持つかもしれません。 実は熱電対線のカラーコードは国によってちがい、 ここで使用している熱電対線が輸入品なので、普通、日本で使われている青ではないのです。 なお熱電対のJIS 規格 JIS C1602:2015では熱電対線のカラーコードは規定されておらず、 K 熱電対線に青が使われているのは、業界の暗黙のルールのようです (熱電対の補償導線の規格 JISC1610:2012 にはカラーコードが規定されています)。

|

|
| 図3. ペルチエ素子単体として市販されているもの (秋月電子で購入(Laird Thermal Systems社 CP1.0-1-05)。 背景は 1 mm角の方眼)。 放熱用のセラミック基板に n-型と p-型の半導体を Π型に取りつけてあります。 | |
ペルチエ素子が安価に入手できるようになり、 自動車で使う冷蔵庫、家庭用のワインセラーなどもよく目にするようになってきました。 ここで使うペルチエ素子(モジュール)は、 車載用と思われる、4 cm角で厚さ 4 mm 程度のセラミック製のタブレット状のもので、 定格 12 V 6 A で最大吸熱量 60 W 程度というものです (たまたま5枚で1500円ぐらいで売っていたのを買いました。 10枚買って2枚死んでいましたが、値段を考えるとまあ納得です)。 このセラミックのタブレットの中に、 図 3 に見るようなペルチエ素子の Π型のユニットが多数組み込まれて、 大きな吸熱量を実現していて、 赤線を正極、黒線を負極をつないで電気を流すと、 表(文字が書いてあるほう)が冷たくなり、裏が熱くなるのがわかります。 このままだとどんどん熱くなっていくので、 裏面にアルミの板を当てて放熱するようにします (極性を逆にすると、冷却、加熱が逆転します。 今回程度の電流だと問題ないですが、 冷却される側の耐熱性が低いので、 指定どおりの向きに流さないと定格内の電流でも故障します)。
実験では電源にお手軽な携帯用の USB 充電器を使うことにしました。 この USB 充電器では流せる電流が0.5 A までなので、 電流を落とすために 10 Ω ぐらいの抵抗を、 ペルチエ素子との間に入れてもらっています。 10 Ωの抵抗は細めのステンレス線(#30。直径0.3 mmぐらい)を 1 m ほど取って自作してもらいました (後輩たちはそれを使いまわしている・・・)。
テキストには「T 熱電対」と麗々しく書きましたが、 実体としてはコンスタンタン線の切れ端と銅線をつないだものです (コンスタンタンは銅とニッケルの合金)。 コンスタンタン線の両端に銅線をつなぎ、 その両接点をペルチエ素子モジュールの表と裏に貼りつけ、 発生する電圧を測ればよいわけです。 当方の希望は、こうして「熱電対で温度差がモニターできる」 ことを実感して欲しいことなんですが、 学生諸君は面倒がって、 一方の接点をモジュールの冷却面に付けるだけ済ましていることが多いです。 まあマルチメータのプローブ温度がアルミ板と同じと見なせばこれでもいいんですが・・・

|

|

|

|
| 図4a. 使用するペルチエ素子モジュール。 こちらの面は発熱する側で放熱が必要。 | 図4b. 実験の際の構成。 アルミ板を放熱板にし、 USB で給電し、10 Ω 程度の抵抗を直列に入れます。 | 図4c. 自作の10 Ω の抵抗。 サンプル管にステンレス線を巻きつけて作成。 | 図4d. T 熱電対を用いた温度差の測定。 手抜きですがこれでも可。 |
以前の学生さんの中に、溶媒和電子の青を見てみたかったという声があり、 何とか実現させてやろうと、2016年度から液体アンモニアの実験を組み込みました。 アンモニアの1 atm での沸点は -33 °C ですから、 ドライアイス温度なら余裕で液化可能です。 なお学生諸君の提出レポートを見ると、 金属ナトリウムのアンモニア溶液あるいは溶媒和電子それ自身より、 バーチ Birch 還元などの方に関心が向いているようです。 これは今の時代の空気なのかもしれませんが、個人的にはちょっと残念。
テキストにある「断熱容器」としては、 熱湯用の厚手の紙コップを使っています (1個で何とかなりますが、 2個かぶせて2重にすることを薦めています)。 ドライアイスをコップの1/4ほど入れて、 メタノールを同程度の量加えます。 最初激しく発泡しますが、 温度が下がるにつれて発泡は収まり、 時々、泡が発生するぐらいの状態で落ち着きます (この時点でメタノールには二酸化炭素が 20 mass% ぐらい溶けています)。
この時、原理的には二酸化炭素の1 atm での昇華点、-78.5 °C になって欲しいところですが、 実際には -70 °C 程度。 このあたりの温度で、 紙コップへの外部からの熱の流入と、ドライアイスの表面付近の蒸気膜内の熱伝導が、 釣り合っているもののようです。 けれどもアンモニアの液化に必要な -33 °C は余裕でクリアしているので問題ありません (ドライアイスでアンモニアの融点-77.7 °C をギリ達成できるはずですが、 ドライアイスだけでアンモニアを固化させるのは無理みたいです)。
実験に必要な液体アンモニアの量としては、 できるだけ少量で、かつ溶媒和電子の生成が確認できるところで 0.3 mL、 密度を 0.7 g/mL として 0.2 g ぐらいと設定しました。 アンモニアの発生法としては、 当初、昔ながらの塩化アンモニウムと消石灰を加熱するという手法を考えたのですが、 装置がいささか大仰になり、また反応が中途半端で終わりがちなので、 最近、小学校や中学校ではやっているという、 塩化アンモニウムに水酸化ナトリウムと水を加えるという手法を採用することにしました (水酸化カリウムにアンモニア水を加える手も考えましたが、 ちょっと臭くて危険なのでやめました)。
テキストにある「アンモニア発生装置」は、 図 6b に見るような 5 mL ぐらいのサンプル管のキャップに6 mm 径の穴を開け、 外径 6 mm のポリエチ管を差し込んだものです (穴をあけるには6 mmのセンタードリルを使うのが便利です。 なおポリエチ管は差し込み過ぎると、発泡した時、中の液が出てきてしまうので浅めに)。 水酸化ナトリウムと塩化アンモニウムをそれぞれ 1 g ずつ取ってサンプル管に入れ、 水を 1 mL 程度入れて蓋をします。 しばらく(20 秒ぐらいか)待つと発熱して、 アンモニアの発生が始まります (ここは手早くいきます。 ノソノソしていると発生が終わって、アンモニアの臭いだけが残る・・・)。
液体アンモニアは、発生したアンモニアの気体を、 図 6d のように、 ドライアイス-メタノールの低温浴に浸したビニル管(軟質塩ビ管)あるいはシリコンチューブに通じることで得ます。 軟質塩ビのガラス転移温度は -30 °C ぐらいなので、 この状態でビニル管を曲げようとすると、ポキンと折れたりすることがあるので注意が必要です。 この点ではビニル管ではなく、シリコンチューブ(ガラス転移温度は -100 °C 以下)を使った方が無難ですが、 透明度が低いのでどちらがいいかは難しいところです。 実験では両方出してあるので、好きな方を使ってもらうことにしています。
なおここでの問題は、 発生したアンモニアの乾燥でした。 最初はビニル管にソーダ石灰を詰めてみたりもしたのですが、 アンモニアの発生が激しいこともあって、チューブが外れるなどのトラブル続出。 そこで取りあえず乾燥剤なしで実験してみると、金属ナトリウムの溶解実験には支障がないことがわかり (水分はビニル管が低温浴に入るところまでで凝縮する)、 結局のところ、極めてシンプルな構成で勝負することとなりました。
|
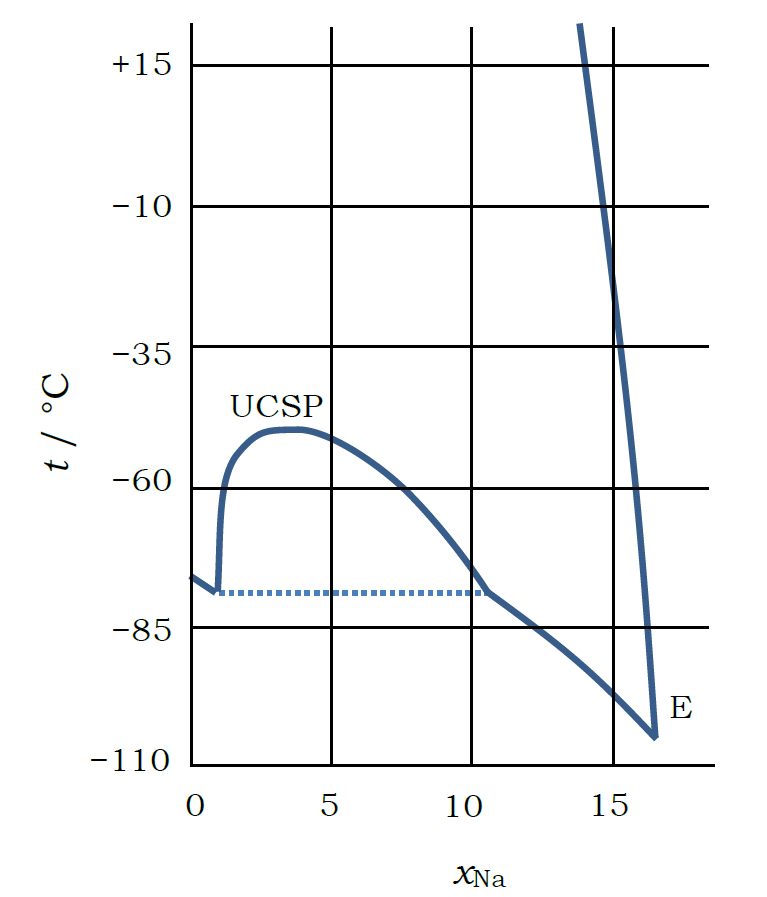
| 図7. 金属ナトリウムのアンモニアへの溶解挙動。 文献の図から作成。 横軸はナトリウムのモル分率。 |
アルカリ金属が液体アンモニアに溶けて青色の溶液になることは、 19 世紀の半ばごろには知られ、 図 7 に示すナトリウムの溶解度の挙動など 20 世紀の前半ごろまでにはすでに多くの知見が得られていました。 ナトリウムの溶解度は温度を上げると減少し、 -40 °C 以下に冷やすと2相分離が起きるようになります (上層の方がナトリウム濃度が高い)。 また溶解の際に、体積の大きな増加が起き(金属ナトリウムの原子容は 24 mL/mol だが、 アンモニア中での見かけの原子容は2倍以上、60 mL/mol 程度になる)、 濃度が高い方が体積増加が大きくなる傾向にあります。 ここでは取りあえず、 金属ナトリウムがアンモニアに溶解して、 どんな色の変化を示すかに注目してもらえればよいでしょう。
実験ではビニル管の中に溜めた液体アンモニアの中に、 金属ナトリウムを入れて様子を見てもらいます。 金属ナトリウムはナトリウム包丁 (という名前のただの包丁。 今では昔話となりましたが、 溶媒の乾燥に金属ナトリウムを使っていた関係で、 ぼくが学生時代には、まだ研究室に金属ナトリウムを切る包丁と、 金属ナトリウムを針金に引くナトリウムプレスがありました) で切り分けて、 小さいサイコロ状にしてスパチュラで入れてもらいます。 この金属ナトリウムを包丁で切るズキュという感覚は、 実際に体験してもらいたいところです。
金属ナトリウムの欠片が入ると、 青い色が現れてきます。 しばらくゆすぶってもらうと、ブルーブラックのインクのようになってきます。 辛抱強く混ぜるとナトリウム濃度が上がって色合いが変化してくるはずですが、 そこまでは待てないので取り出して、 アンモニアを蒸発させて様子を眺めてもらうのがいいでしょう。 すると青かったのが、茶色がかってくるのが分かると思います。 これは濃度上昇にともなう溶媒和電子の存在の様態の変化に対応しています (この時電気伝導度も数百倍大きくなります。 ここらへんの詳しい話は、 ちょっと古いですがSchindewolf の解説を当たってもらうのがよいでしょう)。 さらに温度が上がりアンモニアがなくなると、 うまくいけば金属ナトリウムの銀色が見られるようになります。 けれども水が入っていたりして、白色の粉末になることが多いです。

|

|

|

|
| 図8a. 金属ナトリウムの欠片を、 液体アンモニアの入ったビニル管に入れます。 | 図8b. 金属ナトリウムを入れると、 青い色が出現します。 | 図8c. 藍色の溶液になります。 | 図8d. アンモニアが蒸発し、 ナトリウム濃度が高くなると色がブロンズ調になります。 |
液体窒素を使った実験は、 こうした初心者向けの化学(科学)実験の定番と言っていいでしょう。 ここで特に課題として設定しているのは、 液体空気、液体酸素の性質で、 他は自由研究ということにしています (学生からの要望で超伝導体の実験などをやったこともありますが (当化学教室に専門の研究室があるのは心強い)、 最近、そうした積極的な声がないのはちょっと寂しい)。
断熱容器(発泡スチロールのお椀)に液体窒素を入れ、 空の試験管をしばらく浸しておくと、 液体空気が溜ってきます (霜が付いてちょっと濁る)。 これを取り出して蒸発させ、 残った気体に火を付けた線香を入れると、 明るく燃えるという実験です。
ほとんど(すべて?)の学生さんは気に留めていないようですが、 試験管の中で空気を冷やして作る「液体空気」の組成がどうなるかは、 難しいところです。 図9に窒素と酸素の沸点・露点曲線(Landolt-Börnstein IV/3 P. 35 (1975) のデータから作成)を示します。 試験管の中に新鮮な空気が常に供給され、 その露点で凝縮が起き続けるなら、 (アルゴン等の寄与を無視すると)液体空気の組成は図 9 の左側の矢印の組成、酸素が 50 mol%ぐらいのものになるはずです。 一方、外部からの空気の供給が不十分なら、すべて液化してもとの空気の組成、酸素が 20 mol%ぐらいのものになるでしょう。 実際には、この中間の酸素濃度でしょうが、 あまり明確にものが言えません。 同様のことは一般の「液体空気」についても言え、 何事も”空気を読む”のは難しいようです・・・
さてこの「液体空気」を液体窒素の容器から取り出して温め、 蒸発させていくと、窒素濃度の高い蒸気が揮発し、 液体の酸素濃度がさらに上がります。 この酸素濃度の上がり方も、精密に考えてみると難しいところで、 単蒸留として扱うと、いわゆるレイリーの式で評価でき、 当化学教室では3回生の実験で出会うことになります。 ともあれ、最終的にはかなり高濃度の酸素になります。 このことは、よく心にとめておいて欲しいところで、 液体窒素の実験で、 使用した容器などを安直に処理して高濃度の酸素が発生し、火災になることがあります。
酸素には不対電子が存在し、常磁性を示すといった話は、 ちょっと「大学の化学」を齧ると出てくる話で、 この液体酸素の絡む実験は、学生さんから受けが良いです。
液体空気では酸素濃度が心もとないので、 酸素富化空気の発生装置を利用します (家庭での介護関係の需要があって、 以前と比べると格段に安く入手できるようになりました)。 酸素富化空気をポリエチの袋に詰め、 液体窒素で冷やすと液化して、 見る見るひしゃげて、袋の底の方に液体酸素が溜まります。 霜が付いて少し見にくいですが、 少し動かしてやると、 青い色が付いていることが、 確認できます (ちなみにこの色が生じるには酸素2分子が絡むので、 酸素濃度とともに急速に色を増します)。
いつかどこかで見た実験、 あるいはどこかで聞いた実験、 そうした実験をこの機会にいろいろやってもらっています。 最近、ちょっと低調なのは気がかりなんですが、 変な仮説を立てて実験しているのを見ると、 さすが理学部と思うことも多いです。
|

|

|

|
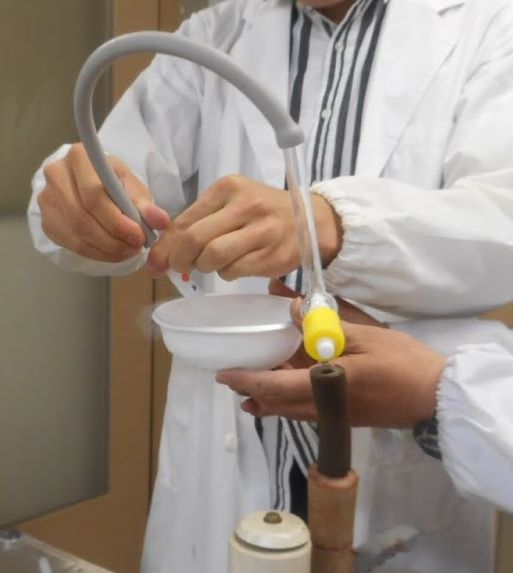
| 図12a. 試験管に入れた液体窒素を、 ロータリーポンプで減圧しているところ。 到達圧力 1 kPa 程度のダイアフラムポンプでは力不足のようです。 | 図12b. 液体窒素を急速に蒸発・冷却させた後、 フワフワの固体窒素が残ります。 | 図12c. バラの花を液体窒素で凍結させ、 金づちで叩いているところ。 | 図12d. 砕かれたバラの花。 |