|
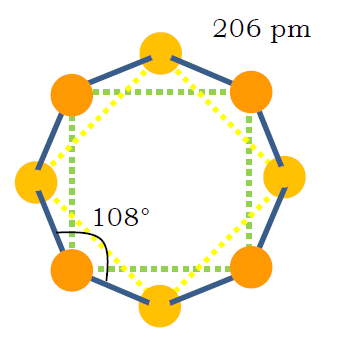
| 図1 S8分子の構造。 王冠型をしているのを、真上から見たところ。 |

|
| 図1 S8分子の構造。 王冠型をしているのを、真上から見たところ。 |
同素体 allotrope (ギリシャ語で「他の形」という意味らしい)というのは、 異なる性質を示す、元素だけからなる物質を意味します (これだけだと例えば気体と液体も同素体ということになりますが、 通常は「物質の三態」といった形で理解され、区別しません)。 同素体には大きく、分子であれば「異性体」isomer として区別される、酸素(O2)とオゾン(O3)といった化学結合の様式が異なるものと、 チョコレートでおなじみかもしれませんが「多形」polymorphism と呼ばれる、 分子の配列様式(結晶形)の異なるものがあります (チョコレートを作る時のテンパリングでは、 ココアバターが不安定な結晶から準安定な結晶になり、 さらに賞味期限より長く放置しておくと安定な結晶ができて白い斑点ができてくる(ブルーム現象))。
イオウは酸素と同族で、 蒸気中に二イオウ disulfur S2 やオゾンに相当する三イオウ S3(チオゾン thiozone とも) などが存在することが知られています。 けれどもイオウの同素体として著名なのは、 何といっても高校でも習う、環状 S8 分子からなる結晶形の異なる直方(斜方)イオウ(α-イオウ)と単斜イオウ(β-イオウ)、 そして種々のイオウ分子の混合物と考えられるゴム状イオウ(無定形イオウ)ということになるでしょう。 ここでは、実際にこうしたイオウの同素体の姿に触れてもらうとともに、 「結晶系」についても考えてもらおうということにしています。
イオウの同素体には、
高圧力を加えて得られる、セレン類似の鎖状分子からなるようなものなどもありますが、
有機化学的といっていいような手法で合成されたものも、
数多く知られています([Schmidt])。
よく知られている合成手法はポリサルファン polysulfane H2Sn
とジクロロポリサルファン Cl2Sn の反応で、
環状のイオウの同素体を得るものです(参考書):
H2Sm + Cl2Sn → cyclo-Sm+n + 2HCl
五硫化チタノセン TiCp2S5(Titanocene pentasulfide(Bis(cyclopentadienyl)titanium(IV) pentasulfide ))を、
利用する手法などもあります:
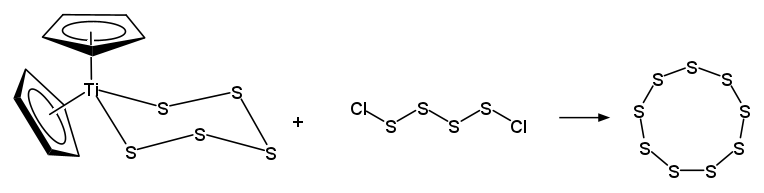
これまでに大きいところでは、20員環のイオウの同素体 cyclo-S20 まで単離、構造解析されています。
また小さいところでは、環状の S6 は100年以上前に得られていますが( "Engel のイオウ"などと呼ばれる)、
S5 は得られていないようです
([Meyer])。
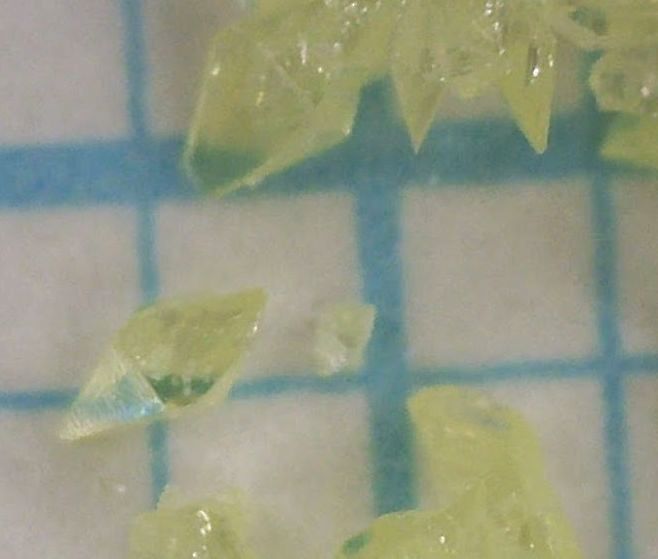
教科書で勉強していて、直方(斜方)晶系の単位格子が直方体であることは習っても、 なぜそれが「斜方」と呼ばれていた(る)か、はっきり説明がないことが多いと思います。 今回の実験で、直方イオウを実際に作ってみると、そのあたりが見えてくるでしょう。 図2 には結晶の析出が一段落して、 少し冷めたキシレン溶液から出てきた結晶のようすを示しています。 出てきた結晶の形が、ひし形に見えませんか? ひし形のことを昔、傾けた方形という意味で「斜方」と呼んだらしく、 結晶の対称性に注目して結晶を分類した時、 こうした結晶の仲間を「斜方晶」と呼んだようです (英語でひし形はrhombus。 昔の本には、今日orthorhombic crystal と呼んでいる結晶を、 rhombic crystal と書いてあります。 ちなみに単斜晶系 monoclinic system というのは、 直方体を一方向に(mono-)傾けた(-clinic。クリニック・診療所とは関係ない)、 つまりマッチ箱をつぶした形状、という意味らしいです)。
結晶の分類・用語などをめぐっては、 結晶学の長い歴史と伝統を背景に、 少し混乱があります。 「斜方晶系」を「直方晶系」と呼ぼうというのは、 日本結晶学会が2014年に出した方針で、 ここでもそれに従うようにしています。 けれど今も「斜方晶系」が幅を利かせていて、 たぶん「直方イオウ」などという呼び方をすると、試験では×になる可能性大。 なお余談ですが、ぼくが学生時分には、立方晶系を「等軸晶系 isometric system」と教わったものでした・・・
われわれが観察する結晶の形は、 結晶を構成する単位格子そのものではありません。 結晶が成長する時、 結晶の面によって成長速度は違い、 成長するにしたがって、 成長速度の速い面の占める割合は減っていき、 成長速度の遅い面が結晶全体の形状を決めます。 分子の密度の高い面の成長は一般に遅く、 表面に現れるのは分子密度の高い面であることが多いのです (ブラベの法則)。 直方晶系では、直方体の単位格子を斜めに切った面の分子密度が高いことが多く、 最終的な形状が直方体でなく、 しばしばひし形に見えます (直方晶系では面心型のブラベ格子が存在)。 このため、結晶の外形から判断を付ける立場からは、 「斜方晶(ひし形晶)」という呼び方が自然なわけです。

|

|
|
| 図2a 少し冷めたキシレン溶液から析出してくるイオウの結晶。 図3 a とは出方がずいぶんちがう。 | 図2b 析出してきた直方(斜方)イオウの結晶のマイクロスコープの写真。 | 図2c 翌日、少し大きく成長した直方(斜方)イオウの結晶。 方眼は 1 mm角。 |
この実験で溶媒にキシレンを使っているのは、 さして深い意味はなく、たまたま不良在庫のキシレンが手元にあったからです。 トルエンでも問題なく実験は可能です。 キシレンは沸点が 140 °C ぐらいで(o-、m-、p- の異性体で少し違う)、 温度を上げられるのはいいのですが、 イオウが融けるぐらいの温度で所定量(0.1 g/1 mL ∼ 10 mass%)は溶解するので、 がんばって沸騰するまで加熱する必要はありません (室温付近の溶解度は 2 %程度)。 ちなみに二硫化炭素に直方(斜方)イオウは、 室温付近で 30 % ぐらいまで溶けます([Meyer])。
テキストにあるように、試験管にキシレンと固体のイオウを入れ、 軽く振り混ぜながらヒートガンで加熱していくと、 キシレンにイオウが溶けて少し黄色くなります。 さらに加熱して融点を超えるとイオウが融け、 黄色いしずくになって試験管の底に沈みます。 それをさらに加熱すると、イオウは完全にキシレンに溶けてしまいます (単斜イオウへの転移温度 95 °C を超えても、 転移は緩慢で単斜イオウへの転移はたぶん見られません。 なおキシレンによる凝固点降下の影響で、 融点は低くなり 110 °C ぐらいで融けるようです)、
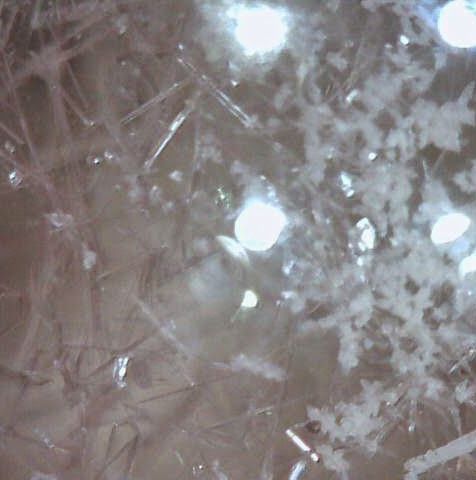
加熱を止め、このイオウのキシレン溶液を空気中で冷ましていくと、 針状の透明感のある薄黄色の結晶が析出し、 どんどん伸びていくのが観察できます。 これが単斜イオウ(β-イオウ)と呼ばれるものです。 単斜イオウは 95 °C 以下では、直方イオウより不安定なはずですが、 60 °C 程度になっても、もっぱら準安定な単斜イオウの析出が続きます。
こうして析出してきた針状結晶は、 数分経つとだんだん濁ってきて、形が崩れていきます。 これはより安定な直方イオウへの転移が起きるためです。 また冷めた溶液から析出してくる結晶は、先の図 2 のように、 針状ではなく、ひし形になってきます。

|

|

|
|
| 図3a 熱いキシレン溶液から析出してくる単斜イオウの結晶。 透明感のある針状の結晶。 | 図3b 冷めてしばらくすると、 直方(斜方)イオウへの転移が起きて、針状結晶が濁ってくる。 | 図3c 単斜イオウのマイクロスコープの写真。 | 図3d 単斜イオウが一部直方(斜方)イオウに転移した状態。 |
テキストの解説にもあるように、 同じ単斜晶系ながら、真珠母イオウ nacreous sulfur(γ-イオウ)と呼ばれる同素体も知られています(参考書)。 この結晶は、溶液を急冷すると析出してきたりすることがあるようですが、 今回の実験条件では出てこないようです (仮に出てきていても、ぼくには見えていないかも・・・。 なおエチルキサントゲン酸銅(I) CuSSC(OC2H5) とピリジンの反応で生成するとのこと)。 準安定な結晶(相図上で安定な温度・圧力領域がない)なのですが、 不思議なことに天然に鉱物として産出します(Rosickýite)。
イオウの液体中では、 単斜イオウなどの中に存在した S8 分子は一部解離、再結合して、 種々の分子種の混合物となります。 ですからイオウの融解挙動にも、不思議な挙動が現れます。 通常のハンドブック類にはイオウの融点として115 °C(115.2 °C)が記載されていますが、 直方(斜方)イオウをゆっくり加熱していくと、95 °Cで転移して単斜イオウになり、 115 °C より 5 °C 高い 120 °C で融解して液体になります。 またこれをすぐ冷やすと 120 °C で凝固します。 しかしこれを液体のまま数時間おいて冷やしていくと、 ハンドブックなどにあるように、 今度は 5 °Cほど低い 115 °C で凝固、 融解するようになります。 つまり単斜イオウを加熱融解させる時に最初できる液体は、 ほぼ純粋な S8 からできているのですが、 放置しておくと種々のイオウ分子(同素体)が生成して、 熱力学的に安定な平衡混合物となる結果、 ”凝固点降下”が起きるのです。 というわけで、ハンドブック類にはイオウの融点として、 熱力学的に妥当な値として 115 °C が記載されているのです。
さてイオウの液体は加熱していくと暗赤色となり、 ゆっくり加熱していくと 160 °C 付近を境に急激に粘度が増加し、 粘度は7 mPa s(常温の水の数倍程度)ぐらいから、 190 °C 付近で 90 Pa s と 10000 倍にもなり、 その後、再び減少に転じます。 今回の実験のように、急速加熱した場合にはこれほど大きな粘度の増加ではありませんが、 それでも十分大きな粘性の増大は見られます。 これはイオウの高分子化が 160 °C 前後から急速に進行するようになるためで、 この温度 160 °C(159 °C)はイオウの高分子化温度 polymerization temperature と呼ばれ (しばしば液体イオウの転移温度 transition temperature とも)、 密度、比熱などにも異常が現れます (以前は密度に極小が現れるとされていましたが([Meyer])、 その後の詳細な検討によると、膨張率の変動はあるものの、極小は現れないようです)。
この暗赤色の液体を急冷すると、 ゴム状イオウが得られます。 実験ではガラス細工してもらう関係で並ガラスのガラス管を使うので (今やブンゼンバーナーで細工できる並ガラス管は貴重品です)、 急冷するとたいてい図4c のようにガラス管はひび割れ、 その破片からゴム状イオウを取り出してもらうことになります (ビーカーなどから液体イオウを直接冷水中に流し込んでゴム状イオウを作るデモ実験もありますが、 イオウに火がついて亜硫酸ガスが出るので、ここではおとなしい設定にしました)。
さて実際にやってみると、 「ゴム状イオウ」と言っても、 できるゴム状イオウの性質はさまざまです。 図4c では全体としては透明なプラスチック状のものになってはいるものの、すでに一部結晶化が起きています (透明なゴム状イオウを作っても、放置しておくと速い時は半時間、 遅くとも翌週まで置いておくと、たいてい結晶化が起き、濁ってきます)。 また引っ張った時に、ずるずる引き延ばされて元に戻らず、 ゴムというよりは(塑性変形する)プラスチックというべきものになることも多いのです (日本では教科書で「ゴム状イオウ」で済ましていますが、 これはあまり適切とはいいがたく、無定形(アモルファス)イオウ、 プラスチックイオウとでもしておくのが妥当でしょう)。 こうした違いは、イオウの液体を何°C からどう急冷するか、 そもそものイオウの液体をどのように作ったか(それまでの温度履歴など)によって、 ゴム状イオウの組成が変動することによるもののようです。

|
|

|
| |
| 図4a 融点付近のイオウの液体。 流動性のある黄色い液体。 封じたガラス管は自分たちで作ってもらいます。 | 図4b 加熱していくと暗赤色になり、 高分子化して粘い液体になる。 | 図4c 暗赤色の液体を急冷すると、 ゴム状イオウになる。 ここでは一部結晶化している。 | 図4d 引き延ばすとプラスチックのような性質を示す。 |
このゴム状イオウの組成については、古くから研究され、 大まかに二硫化炭素(あるいはその他の溶媒)に溶けるもの(π-イオウ)と溶けないもの(μ-イオウ。不溶性イオウ)に分類されてきました ([参考書])。 この不溶性イオウ(μ-イオウ)は高分子化したイオウで、工業的に大量に生産されています (ゴムの加硫に用いられ、JIS 規格に種々のグレードが規定されています(JIS K6222-1「ゴム用配合剤-硫黄-試験方法」。 JIS では溶剤としてトルエンと二硫化炭素が採用されている))。 200 °C 程度まで加熱冷却したゴム状イオウでは、 およそ3割が高分子化したμ-イオウになっているようです。 一方可溶性の π-イオウは溶剤に溶けやすく、 二硫化炭素への溶解度は直方(斜方)イオウの数倍あります。 ピクレートの課題で扱う HPLC(高速液体クロマトグラフィー)を用いて分析した研究によると、 π-イオウは、8割がたは S8 なのですが、 それ以外に、S7、S6、S9等の、 多数の低分子量の同素体分子が含まれているようです(S23に相当するものまで検出)。
意外に最近の教科書に登場しない話題に、 イオウのアルカリ溶液への溶解があります。 イオウがアルカリに溶解して、暗赤色の溶液になることは古くから知られ、 「イオウの肝 liver of sulfur」と呼ばれています (カイガラムシの駆除などに使われる石灰硫黄合剤は、このイオウの肝に相当)。 またこうしたものから作られる、 イオウのコロイドは「イオウのミルク milk of sulfur」 として古くから知られていました。 ここでは実際にその後をなぞってみようという気分です。
「イオウのミルク(硫黄乳)」というのは、ヨーロッパでは13世紀、 アルベルトゥス・マグヌスの著書にすでに記載があり、 錬金術師(化学者・薬学者?)の間ではよく知られていたようです ([Mellor P. 2])。 なお「イオウのミルク lac sulfuris」は、イオウのコロイド溶液のことだったのですが、 蒸発乾固させた粉末が皮膚病などの塗り薬用に普及し、 もっぱら粉末状のものを指すようになったようです (「沈降イオウ」と称されるものが対応)。 なお「硫黄華 flower of sulfur」は、 元来はイオウを昇華・凝縮させたものを指すのですが、 イオウのミルクなどとしばしば混同されているようです (現在市販されている粉末のイオウ試薬はこの硫黄華に相当。 「昇華イオウ」と称される)。 温泉などで見かける入浴剤「湯の花」は、 たいていイオウのミルクに相当するものですが、 液状のものには「イオウの肝」に相当するものもあります。
予習チェックにもありましたが、 イオウは水酸化ナトリウム溶液と反応して、 チオ硫酸ナトリウムと硫化ナトリウムになります (S(0) が S(+II) と S(-II)に不均一化する)。
6NaOH + 4S → 2Na2S + Na2S2O3 + 3H2O
これだけであれば、溶液は無色のはずですが、 ここでの実験条件では3割がたイオウが過剰に存在しています。 そこで次の多硫化物イオン Sn2-の生成する反応が進行し、 赤褐色を呈するようになるのです (多硫化物イオンSn2- は直鎖状の分子で、n = 3 ぐらいから色が付き始める)。 温度を上げると、種々の多硫化物が生じて色が濃くなり、 下げると色が薄くなります。
Na2S + n S → Na2Sn+1
こうしてできたイオウのアルカリ溶液を酸性にすると、 イオウが析出してきて、 コロイド状になり、「イオウのミルク」ができます。 このイオウのミルクをろ紙で濾すと、 少し沈殿が濾しとられますが、 ミルクはそのままろ過されてきます。 ”コロイド” になったわけです。

|

|

|

| |
| 図5a 水酸化ナトリウム溶液にイオウを混ぜる。 最初、イオウは水をはじく。 | 図5b 暗赤色の溶液になってくる。”イオウの肝 liver of sulfur” | 図5c 冷却すると色が薄くなる(左方は氷水で冷却)。 | 図5d コロイド状のイオウ。イオウのミルク |
ここでイオウコロイドを作るのに、 リンゴ酸を使っているのは、たまたま薬品棚にリンゴ酸の在庫があったからで、 酢酸などでも問題はありません。 ただし強酸条件では、 油状のポリサルファン(多硫化水素) H2Sn ができます。 生成したポリサルファンを分留することで、 H2S2、H2S3が得られます (H2S3 は減圧蒸留する必要がある([Mellor P. 58])。 この他にもH2S8 ぐらいまで、 種々のポリサルファンが知られています([Earnshaw])。
イオウと鉄、銅との反応は、中学高校でも取り上げられる反応ですが、 意外に実際にやってみたという学生さんが少ないので、 取り入れてみることにしました。 ここではイオウと銅の反応について少し詳しく紹介します。
イオウと金属銅の反応は、 古くから化学実験の教材として知られています。 大幸勇吉「実験化学教科書」(1898)には、 次のようにあります (P. 67。原文縦書き。 読みやすいように、適宜句点を入れ、漢字など改めています)。
試験管に少量の硫黄を入れ、これを熱して硫黄を沸騰せしめ、
管内に褐色蒸気充満するに至りて、
螺旋状に捲きたる細き銅線をその中に降し、
その一端を沸騰せる硫黄に触れしめよ。
銅線は硫黄の蒸気中光輝を発して燃焼し、
脆弱の硫化銅を生ず。
(大幸勇吉「実験化学教科書」(1898)より)
|
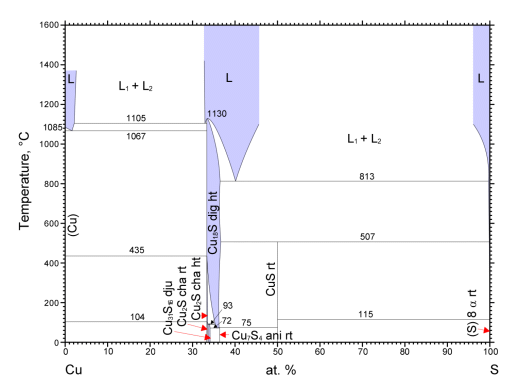
| 図6 Cu-S 系の相図。 国立研究開発法人物質・材料研究機構 AtomWork http://crystdb.nims.go.jp/ (参照: 2021.5.25) |
大幸先生のテキストでは銅線を採用していますが、 ちょうど銅粉の在庫が大量にあるのを幸い、 銅粉とイオウを混ぜて加熱するというお手軽実験にしました。 試験管に指定の量の銅粉とイオウ(質量比 2:1、物質量比 1:1)を混ぜて入れ、 少し加熱するとポッと発火、すぐに反応は終わり、 少し冷めてから内容物を取り出すと、青みを帯びた黒色の硫化銅が得られます。
ここで生成する「硫化銅」なのですが、 その実体はなかなかに複雑で、 「硫化銅」とくくっておくのが無難です。 硫化銅には種々の組成のものがあり、 CuS(コベリン、銅藍)、 Cu2S(カルコサイト、輝銅鉱)は有名ですが、 Cu9S5(ダイジェナイト)、 なども知られています。 図6 に銅-イオウの相図を示します。 今回の実験のように、銅とイオウをほぼ等モルで混合したとすると、 507 °C 以下であれば硫化銅(II) CuS が安定ですが、それ以上の温度では、 イオウとダイジェナイトCu9S5(≈ Cu2S)に分解します。 ですからルツボなどで CuS を 800 °C ぐらいまでに強熱すれば(空気酸化が起きなければ)、 イオウが蒸発して後にダイジェナイト Cu9S5(≈ Cu2S) が残ることになります。 実際、ルツボに銅とイオウを質量比で 2 :1(あるいはさらにイオウ過剰)で入れ、 加熱反応させた後、強熱して恒量化すると、 質量比でほぼ 4:1、物質量で言えば 2:1、 Cu2S (あるいはCu9S5) に相当する硫化物を得ることができます。
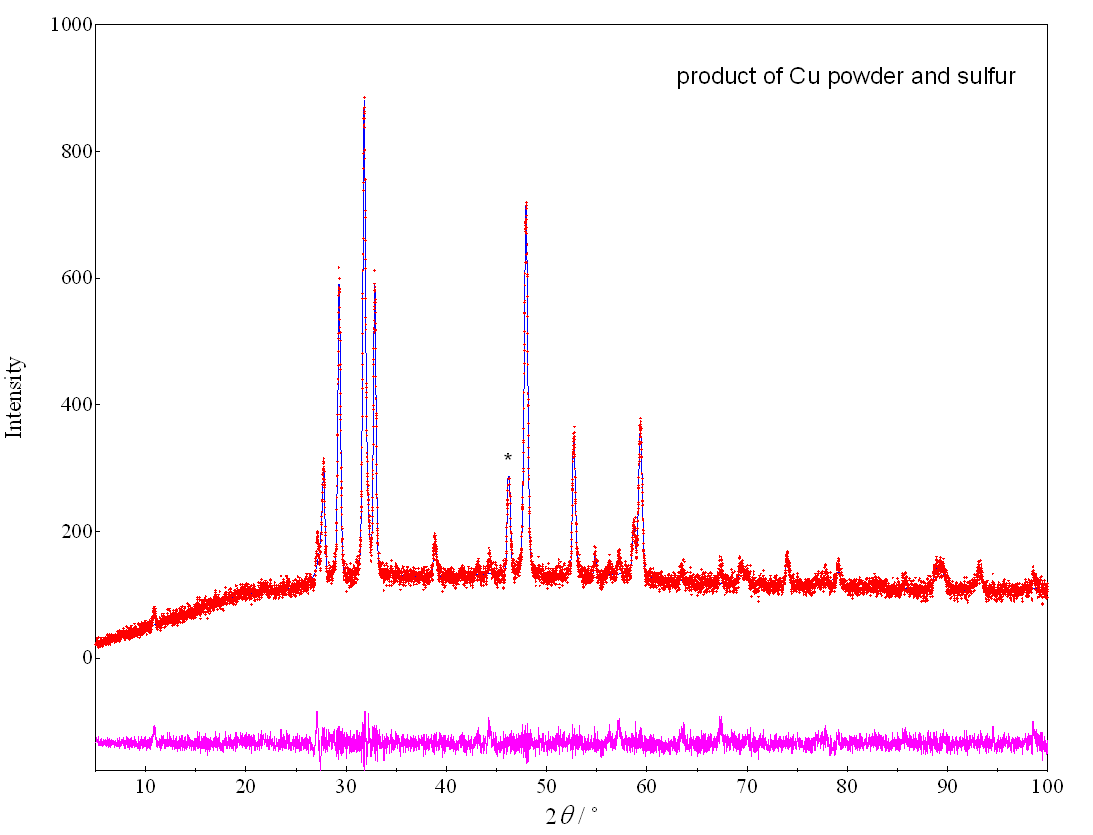
こうした銅とイオウの相図を踏まえると、試験管の中で銅粉とイオウ反応させた時、 激しく発熱するので、生成するのはCu9S5 のように思えます。 確認のため、実際に得られた少し青みがかった黒色の粉末の、 粉末 X 線回折を取ってみた結果を図7b に示します (CuS の結晶構造は単純ではありません。 そもそも硫化銅(II) と呼ぶことにも問題があります。 このあたりの事情はまた後で・・・)。 回折パターンはおおむね、硫化銅(II) CuS (コベリン)のものと一致します。 副生成物としてダイジェナイト Cu9S5 に帰属されるピークも見られますが、 この実験で得られる硫化銅は、 CuS と考えてよいようです。 燃焼反応で 500 °C 以上になっていると思われるのに、 硫化銅(II) CuS がえられるというのは意外ですが、 おそらく一度できたダイジェナイトCu9S5 が、 温度を下げる過程で再びイオウと反応し、硫化銅(II) CuS になったものと思われます。
なおこの実験では取りあえず、 テスターで電気抵抗を調べます(磁化率は次の課題)。 硫化鉄と比べ、よく電気を通すことを確認してもらえればいいでしょう。 酸化物高温超伝導体関連の話題で、 酸化物が電気を通す話に出会いますが、 こういうところでイオン性の物質が電気を通すのを、 経験しておいてもらうのもよいだろうと思っています。

|
|
| 図7a 生成した硫化銅 | 図7b 生成した硫化銅の粉末X線パターン(Kα線)。 * を付けた 2θ = 46.2° の回折は、 ダイジェナイト Cu9S5 に帰属できるが、 他はコベリン CuS の回析に帰属できる。 |
現行の課題構成では、 鉄や銅の硫化物を作ることになっていますが、 当初は硫化鉄や硫化銅の課題はなく、 イオウのアルカリ溶液を作った後、 チオ硫酸ナトリウムの合成を行っていました。 最後に、これがどういう実験だったか紹介しておきましょう。
チオ硫酸ナトリウム(ハイポ)Na2S2O3·5H2O の合成の課題は、 具体的にはイオウの同素体の実験操作に引き続き、 「イオウの肝」に二亜硫酸ナトリウム(ピロ亜硫酸水素ナトリウム)を加えて反応させてハイポを合成した後 (Na2SO3 + S → Na2S2O3)、 チオ硫酸イオンと銀の錯塩の生成を確認するという、 次の操作を付け加える形で実施していました。
この処方で苦心したのは、 ピロ亜硫酸水素ナトリウムを固体のまま加えるようにしたところです。 最初に考えた操作手順では、溶液で加えるようにしていたので、 濃縮操作が必要になり、 濃縮しすぎてうまくいかなくなるようなケースがありました。 この手順であれば、特に濃縮は必要なく、ハイポの結晶を得ることができます。 ただし溶液が過飽和になりやすく、 ハイポの結晶を出すには冷やしたり、こすったり、 いろいろ苦労してもらう必要があります。
イオウのアルカリ溶液の一連の実験の流れの中で、 亜硫酸塩との反応で多硫化物の赤黒い色が消え、 なかなか出てこないハイポの結晶を”祈り出す” という実験で、 学生の評判もそう悪くはありませんでした。 また何か「ものを作る」というのは、 大事な経験かと思います。 けれども残存する硫化物イオンで、 最後の銀との錯イオンを作るところで硫化銀が生じて浅黒い結果になったりするのが、 ちょっと残念でした。
ということもあって、 昔から著名で基礎的ではあるものの、 中学高校でその実験を経験している学生の少ない(というと他にどんな実験の経験があるか、疑問がありますが・・・)、 鉄や銅の硫化物の実験の方にシフトしました。 これがはたして、望ましい方向かどうかはよく分かりませんが、 固体化学とも切り結ぶ形で、取りあえずはこれで行ってみたらどうかと思っています。