|
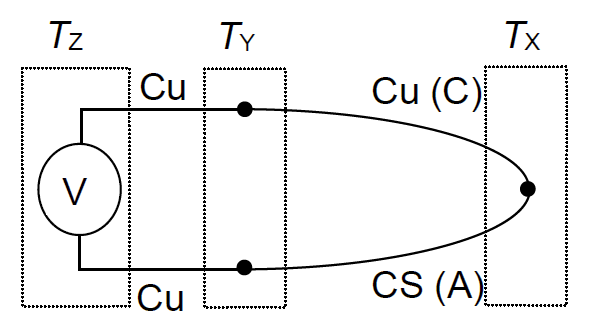
| 図1A1. 熱電対による温度測定の模式図 |
液体窒素温度(77 K)~ドライアイス温度(~200 K)程度の低温の世界に親しむとともに、熱電現象および熱電対を用いた温度測定の基礎を体得する。

|
| 図1A1. 熱電対による温度測定の模式図 |
抵抗線の両端に温度差があると、温度差に応じた電位差が現れる(熱起電力)。 今回の実験では、異なる材質からなる金属線の対(熱電対)(T ではCu(銅)とCS(コンスタンタン)、 K ではC(クロメル)とA(アルメル))を用いて図1A1のような回路を構成して、 温度 TX と TY における熱起電力の差を測定していることになる。 なおマルチメータは自身の温度 TZ と回路の電圧Vを測定し、 プローブと抵抗線との接合部の温度 TYがほぼ TZ に等しいものとして、 K 熱電対で測定した電圧から熱電対の接合部(熱接点)の温度 TX を算出して表示する。
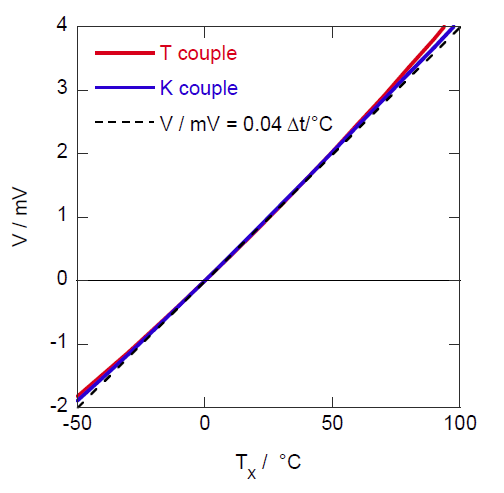
T 熱電対とK 熱電対の室温付近での熱起電力 V の挙動は似ていて、 -30~70 °Cの範囲であれば、大まかに温度差 Δt に比例するとみてよく
V / mV = 0.040 (Δt / °C)
の関係が成立する(誤差は5%以内程度)。
|
図1A2. K 熱電対と T 熱電対の熱起電力(TY = 0 °C) |
二酸化炭素の三重点(-56.6 °C、0.52 MPa)の圧力は高く、常圧で液体は安定に存在できない。 通常ドライアイスの温度とされるものは二酸化炭素の1 気圧での昇華点(-78.5 °C)に相当する。 ドライアイスにメタノールを混ぜると熱伝導がよくなり、ドライアイスのメタノールへの溶解・気化による周辺温度の低下が促進され効率的な冷却が可能となる。
アンモニア(三重点 -77.8 °C、6.1 kPa)の1気圧における沸点は-33.3 °Cであり、 ドライアイス-メタノールで液化できる。 溶媒としての液体アンモニアの特異な性質として、アルカリ金属、アルカリ土類金属を溶解することが挙げられる(ただしBe、Mgはほとんど溶けない)。 金属ナトリウムは -40 °Cで約20 mass%まで液体アンモニアに溶け、溶媒和電子を生じることが知られている。
窒素、酸素の標準沸点はそれぞれ -195.8 °Cと -183.0 °Cである(融点は -210.0 °Cと -218.8 °C)。 液体空気(沸点は -194 °C。露点は -192 °C)を蒸発させると最初窒素に富んだ組成の空気が蒸発し、酸素に富んだ組成の空気が残る。 酸素濃度が高くなると、酸素は常磁性を示すので磁石に強く引き寄せられるようになり、また青い色を示すようになる。 なお真空ポンプで急速に減圧することで蒸発熱が奪われ、容易に固体窒素をえることができる。
この課題では、ドライアイス温度から液体窒素温度ぐらい、 -30 °C ~ -200 °Cぐらいの、 家庭用冷蔵庫では実現できない低温の世界を扱います。 当初は、熱電対による温度測定の原理に触れ、 ドライアイス-メタノールの挙動の検討(メタノールにドライアイスはどれだけ溶けるか)、 液体空気の製造ぐらいを課題に指定して、 「後は(危なくない程度に)お好きにどうぞ」 というスタンスでした。 それがだんだんに膨らんで、 液体酸素、液体アンモニアへの金属ナトリウムの溶解、 ペルチエ素子といった要素を取り込んで、 いささか欲張った内容になっています。
できるだけコンパクトな構成で、 それぞれどのように実験してもらうかについては、 結構苦労しました。 例によって話が長くなるので、 実験の少し詳しい話は下記サイトを参照ください。