|
| 図 1. 極めて単純化した再結晶による精製プロセス。 |
再結晶による物質の精製は、広くシリコン半導体の製造におけるゾーンメルティング法など種々の場面で用いられていますが、 ここでは実験室的に、特に有機化学分野などで日常的に行われる溶媒を用いた再結晶手法について整理しておきます。 再結晶による物質精製に当たっては、一般に次のようなステップを踏みます: (1)溶媒の選択、(2)試料の溶解、(3)不溶物等の除去、 (4)結晶化、(5)結晶の採取、(6)乾燥。 狭い意味での再結晶法は(4)のステップを指しますが、試料の精製・回収という観点からは、 その前後のステップがしばしば決定的に重要になります。 ここでは再結晶による精製の原理等を簡単に見た後、再結晶の手順について略述します。
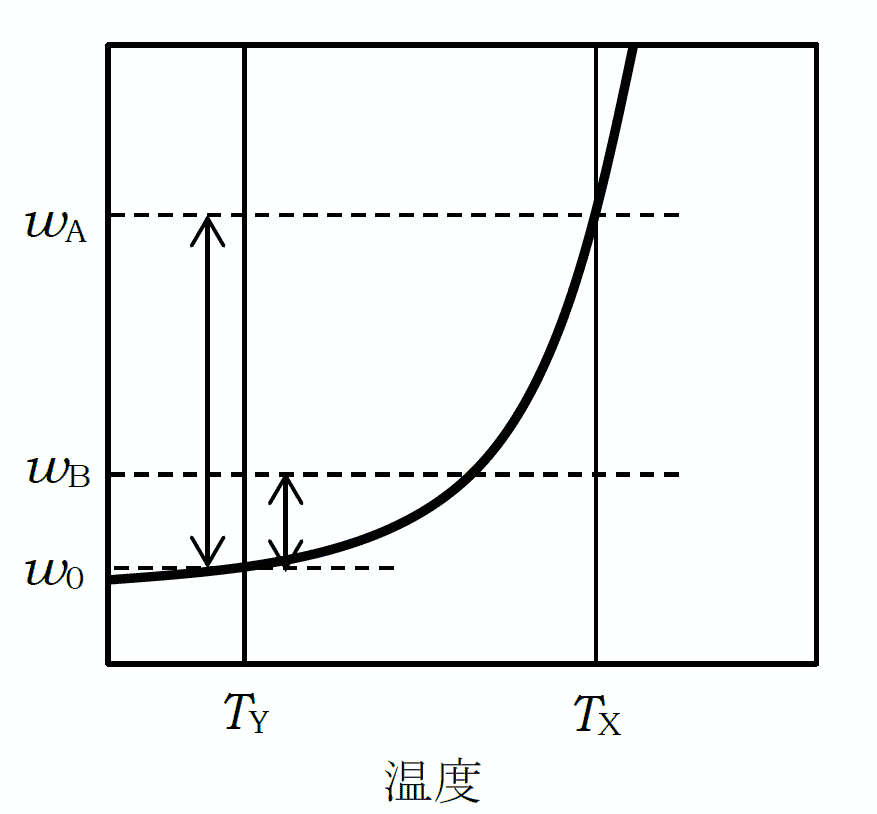
異なる物質同士は、結晶状態では、たいていの場合ほとんど混ざり合いません(固溶体を作るケースはまれ)。 所望の結晶性の物質 A に不純物 B が混入していて、 簡単のため質量ベースの溶解度がまったく同じであるとしましょう。 A と B がそれぞれ wA、wB 含まれているとして(wA ≫ wB)、 これを少量の溶媒とともに三角フラスコに入れ、温度 TX に加熱して溶媒を少しずつ加え、 ちょうど A が全量溶解する状態にしたとします。 この溶液を温度 TY まで冷却し、溶解する重さが w0 まで低下した時、 析出した結晶固体中の A と B の組成比は wB > w0 であれば、
(wB - w0)/(wA - w0) < wB/wA
となり、Aの純度が向上することがわかります。 特に wB < w0 であれば、Bは完全に除去できます。
実際には溶解度は物質によって異なり、さらには A、B それぞれの融解挙動も関わったりして事態は単純ではありませんが、 再結晶による精製に当たっては、溶存して除かれる物質の量 w0 をうまく調整することが重要です。 w0 を大きくとれば純度は向上しますが、回収率 (wA - w0)/wA は低下します。 一方小さくすれば回収率は向上しますが、純度の向上は望めません。
前節では結晶と溶液が平衡状態で存在し、明確に分離できるという前提で取り扱いましたが、 実際には結晶と溶液を完全に分離することは困難で、不純物を含んだ溶液(母液)を含んだ湿った状態で、 結晶は分取されます。 結晶粒が液体に濡れた状態は大まかに図 2 のように分類されます。 母液に完全に浸った状態から、重力式のろ過で結晶を分取すると、 最初は内部が母液で満たされた空隙のない状態(毛管 capillary 状態。土壌関係の分野から来た言葉らしい)で結晶が得られます。 母液が失われるにつれ内部に空隙ができ(索状 funicular 状態。“湿った土”)、 さらに空隙が増え母液間の連絡が失われ、結晶粒間に挟まったような状態(懸垂 pendular 状態。“乾いた土”)に至ります。 懸垂 pendular 状態になると、物理的に母液を除くことは極めて困難になります。 したがって懸垂 pendular 状態になった状態で、溶媒を加えてcapillary 状態にして母液を希釈して洗い落とし、 再び pendular 状態にすることで母液を除くことが行われます(いわば “上がり湯” です)。
重力式のろ過だけで capillary 状態から pendular 状態にまでする(“水切り”)には、 数時間程度必要とすることも多く、capillary 状態のまま母液を溶媒で洗い落として、 capillary 状態でろ紙に挟んで溶液を吸い取るといった手法がとられることもあります。 しかしこれでは多くの溶媒を要し、回収率も落ちるので、通常は、吸引ろ過を行うことで結晶粒間に空気を通じて迅速化を図ります (洗濯機の脱水のように遠心力を用いて脱溶媒を図ることもあります)。 結晶の量が少ない時には、吸引ろ過を行わず、スポイトやパスツールピペットで溶媒を除去することで、結晶を回収することもあります。
結晶粒に凹凸がなく大きいほど表面積が小さくなり、母液からの分離がよくなります。 結晶を析出させる際に急冷すると、樹状結晶(デンドライト)や微細な結晶が生じるので、 急冷は避けます。 沸点近くまで加熱した溶液を冷却する際、一端室温付近まで冷却してある程度結晶を析出させてから、 さらに氷冷して結晶を得るのは、この点理にかなった手法です。 温度を下げるのではなく、例えば水溶液にエタノールを加えて塩を析出させる、エタノール溶液にヘキサンを加えて極性物質を析出させるという手法は、 混合の際に2種類の液体界面付近で溶液組成の急激な変化をともなうので、 物質の回収という点ではよくても、精製という観点からは余り好ましくありません。 均一沈殿法(precipitation from homogeneous solution。PFHS)は、化学反応を利用するなどして、 徐々に溶液組成を変化させて結晶を析出させる手法で、 純度の高い物質を得る上からも有用です。
上記の再結晶操作の原理を踏まえ、学生実験で出会う再結晶操作は、 すでに再結晶溶媒の選択が終わったところから始まるので、 おおむね次のような手順に沿って行うことになります。
三角フラスコ(あるいはビーカー) に試料と少量の溶媒を加え、 ホットプレート等で加熱しておだやかに沸騰する程度にし、溶媒を滴下して完全に溶解させます。 試料の融点が低い場合には、試料の 2 ~ 3 倍程度の溶媒を加えて加熱溶解すればよいでしょう。
溶媒の揮散を防ぐことができるので、有機化学では三角フラスコが好まれます。 また三角フラスコは自然対流を促進し、結晶を析出させる上で有利です(ボイコット効果と呼ばれます)。
不溶性の物質が存在する時には、熱時ろ過を行います。 熱時ろ過を行うにあたっては、ろ過の間に溶液が冷えて結晶が析出してくるのを防ぐため、 1割程度溶媒を余分に加えてからろ過します。 また物質が重縮合等して有色の不純物が生成していたりする場合には、 活性炭を少量加えて吸着させた後ろ過して、不純物を除くこともあります。
沸点近くでほぼ飽和に達した溶液を、室温付近まで放冷して結晶を析出させます。 結晶の析出が収まったら、氷冷してさらに結晶を析出させます。 放冷して結晶が出てこない場合には、ガラス棒やスパチュラで器壁をこすって、結晶の析出を促します。 それでも析出してこないなら氷冷してみます。 それでだめなら種結晶を加えたりして、結晶を析出させ(”祈り出し”)ます。
吸引ろ過して結晶を採取します。 しばらく吸引してろ紙上の結晶の液切りが終わったら、一端吸引を止め、 冷やした溶媒を結晶が浸る程度加えた後、再び吸引して液切りして母液を除き、 ろ紙上の結晶を集めます。
得られた結晶が少ない場合には、ブフナーロート等で吸引ろ過すると、 ろ紙に付着したりして失われる量が大きくなります。 そうした場合には、小さい三角フラスコなどに試料を取って、 少量の溶媒を加えて加熱しながら溶かし、室温に戻してから氷冷して結晶を析出させます。 ここでスポイトで母液を取り除き、冷やした溶媒を少量加えて振り混ぜ、 ふたたびスポイトで液体を除いた後、三角フラスコに残った結晶を回収するといった手法が有効です。
真空乾燥器を用い、溶媒の標準沸点から 20 ~ 30 °C 程度低い温度で、 1 ~ 3 kPa 程度に減圧して乾燥します。 なお有機結晶の場合、結晶の融点近くまで加熱して、”汗をかかせる” のが有効なようですが、 学生実験ではそこまで追求しません。
ミョウバンなど結晶水を含むような物質を得る場合には、室温、空気中で乾燥を行うことが多いでしょう。 風解・潮解する試料の場合には、定湿溶液(飽和食塩水など)を用いるなどして調湿する場合もあります。