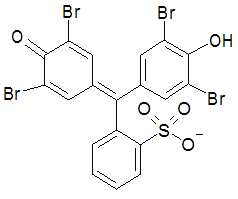
ブロモフェノールブルー(BPB) |
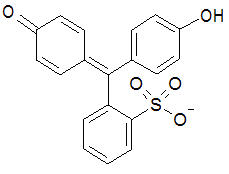
フェノールレッド(PR) |
| 図 1-1.用いる酸塩基指示薬の構造式。 | |
酸塩基指示薬は自身が酸・塩基として機能します。 そして共役酸・塩基であるHX、X-の色、吸収スペクトルが大きく異なることを利用してpHの変化を色の変化として検出します。 ですから平衡状態において、次の関係が成立します。
HX ⇔ H+ + X- (1-1)
KI = [H+] [X-] / [HX] (1-2)
pKI ≡ - log KI = pH - log ([X-] / [HX]) (1-3)
ここで KI は酸塩基指示薬の解離定数です。 (1-3) 式からも明らかに、pH が決まると酸塩基指示薬の酸型 HX と塩基型 X- の濃度比は一定になる、 あるいは pH が分かっておれば、HX と X- の濃度比から酸解離定数の値 pKI が決まります。

ブロモフェノールブルー(BPB) |

フェノールレッド(PR) |
| 図 1-1.用いる酸塩基指示薬の構造式。 | |
実験では、酢酸緩衝液(pH 4.5 近傍)、あるいはトリス緩衝液(pH 8 近傍)中での、 ブロモフェノールブルー(BPB)あるいはフェノールレッド(PR)の酸解離平衡を、分光光度計を用いて調べます。 BPB、PR はそれぞれ、図1-1 に示すような類似の構造を持つ、トリフェニルメタン系の色素です。 BPB は pH 3.0 - 4.6 に変色域(酸性で黄、塩基性で青紫)を持ち、PR は pH 6.8 - 8.4 に変色域(酸性で黄、塩基性で赤)を持ちます。
BPB (あるいは PR)が (1-1) 式のような酸解離平衡を示すとき、 ある波長λでの吸光度 A は、酸型 HX、塩基型 X- の吸光度の和として、 次のように表すことができます(ベールの法則)。
A = εHX [HX] + εX- [X-] (1-4)
ここで εHX、εX- はそれぞれ、 酸型 HX、塩基型 X- の吸光係数で、光路長は 1 としました。
BPB (あるいは PR)の全濃度 c = [HX] + [X-] が一定であっても、 pH が変化すると、(1-3) 式に従って HX と X- の濃度比が変化し、 吸光度も変化します。 全濃度 c が一定の時、(1-4) 式を X- の濃度について整理すると次式となります。
A = εHX c + (εX- - εHX) [X-] (1-5)
一般には pH を変えると X- の濃度が変化し吸光度も変化するのですが、 かりに εX- = εHX となる波長に注目すると、 その波長では pH を変化させても吸光度は εHX c で一定となります。 こうした点を等吸収点(isosbestic point)と呼び、 スペクトルの変化に関与する反応が1種類であることの強い証拠となります (かりに2種以上の反応が関与していると、一般に等吸収点は現われません)。
指示薬の濃度([X-] + [HX])が一定の条件下、 pH を変化させた場合の BPB、PR それぞれについての吸収スペクトル変化の典型的な結果を図 1-2 に示します。
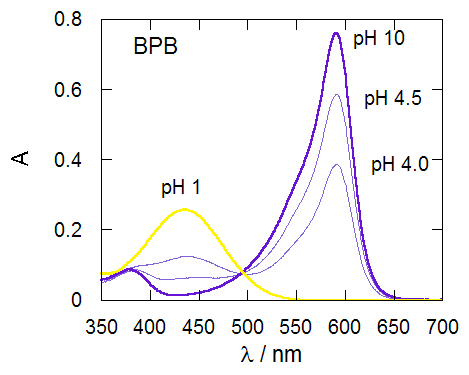
図 1-2a.種々のpHにおけるBPB溶液の吸収スペクトル。pH 4.0、4.5の 0.1 mol/L 酢酸緩衝液使用。 pH 10 はトロナ(セスキ炭酸ナトリウム)溶液(炭酸塩緩衝液に相当)。 |
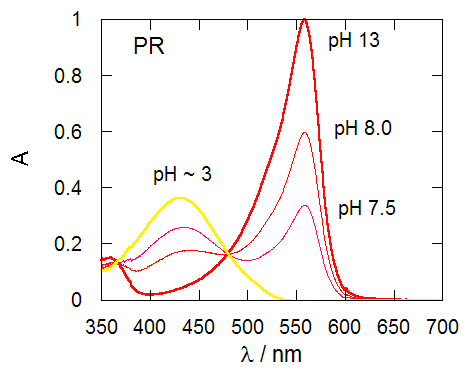
図 1-2b.種々のpHにおけるPRの吸収スペクトル。pH 7.5、8.0 の 0.05 mol/L トリス緩衝液使用。 |
図1-1 に見るように BPB は PR を臭素化したものに相当します。 両者のスペクトルが(30 nmほどシフトしていますが)よく似通っていることに注目ください。 また図1-2a、図1-2b ともにそれぞれ等吸収点が現われており、 1種類の化学平衡の関与を考えれば十分であることを示しています。
BPB については590 nm付近、PR については560 nm付近の吸収に注目すると、 強酸性条件でほぼ0ですから、BPB 及び PR の酸型の分子種は、ここに吸収を持たないことが分かります(εHX = 0)。 ですからこの波長に注目すれば (1-5) 式は単に
A = εX- [X-] (1-6)
となります。 したがって指示薬の全濃度が一定の条件下で pH を変えて吸光度を測定すると、 指示薬の酸型と塩基型の比が各pHで次の式で求まります:
[X-] / [HX] = A/(A0 - A) (1-7)
ここでAは測定条件での 590 nm(BPBについて。PRについては560 nm)の吸光度、 A0は強塩基条件(完全に塩基型になっている条件)での吸光度(= εX- c)です。 結局、指示薬の酸解離定数は次式で計算できることになります。
pKI = pH - log [A/(A0 - A)] (1-8)
実際に実験してみると BPB については 4.0 程度、PR については 7.9 程度の pKI の値が得られます。 ここでは簡単のため強酸性条件で吸光度が 0 になる波長の吸光度に注目しましたが、 440 nm 付近の吸光度が 0 にならない波長に注目しても(計算は煩雑になりますが)、同様に酸解離定数を得ることができます。
なお PR については、強酸性条件での測定で pH が 3 程度以下になると pH が低くなりすぎ、PR への水素イオン付加がさらに進んだ分子種が生成して話は厄介になります(等吸収点も崩れて見られなくなります)。 皆さん小学校時代に経験したことかもしれませんが、BTB 指示薬を強塩酸に垂らすと黄色を通り越して赤くなります。 PR でも同様の現象が起きるのです。 pH が 4 程度のフタル酸水素カリウムの溶液などが適当でしょう。