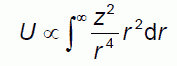 (2-4)
(2-4)
pH によって酸塩基指示薬の酸型と塩基型の分子種の比率が変化し、それにともなって吸収スペクトルに変動が現われることを見ました。 pH ほど大きな変化を引き起こすわけではありませんが、食塩など中性の塩類の添加によっても分子種の比率の変化がおきます。 これを共存イオン効果(coexistent ion effect ? 塩効果 salt effect と呼ぶのがおそらくフツウですが、 ここでは最近の学生さんの慣用に従います。 「共通イオン効果 common ion effect」と混同する人も時々いますが別物です)と呼びます。 この共存イオン効果について少し誤解もあるようなので、簡単に説明しておきます。
まず溶液中における平衡定数について復習しておきましょう。
HX ⇔ H+ + X- (2-1)
K = [H+] [X-] / [HX] (2-2)
という酸解離平衡をとると、反応に関与する分子種 HX、H+、X- の濃度が十分低ければ(無限希釈条件)、 (2-2) 式の K は一定になり(質量作用の法則)、 これを平衡定数、この場合特に酸解離定数 Ka と呼びます。 ここでポイントは、 反応と無関係な共存物質(アルコールや食塩を考えてください)が多量にあったとしても、 その濃度が一定であれば、 反応に関与する分子種の濃度が十分低ければ質量作用の法則は成り立つということです。 そして平衡定数の値は、一般に共存物質の濃度に依存します。 いわば反応と無関係な共存物質と溶媒(水)とをひっくるめて、 新たな溶媒と考えたと思っていただければよいでしょう。
酸解離平衡などイオンの関係する化学平衡の場合、 この共存物質が塩類である時には 10-3 mol/L でも 10% 程度におよぶかなり大きな効果が観察され、 1価のイオンからなる塩類では、イオンの種類にあまり依存しないことが知られています。 これを特に「共存イオン効果(塩効果)」として、別格の扱いがなされます。 そしてイオンの関係する反応を取り扱う際には、この効果を前もって考慮に入れ、 高濃度の反応性の低い塩(過塩素酸ナトリウムがよく用いられます)の溶液を溶媒として用いることが一般に行われます。 あらかじめ塩濃度を高くしておくことで、 化学反応で生じるイオン種の濃度の増減の効果、 あるいは緩衝液などに含まれるイオン種の影響を減殺できるからです。
ですから文献に記載されている酸解離定数のデータなどを扱うときにも注意が必要です。 たとえば25℃での酢酸の酸解離定数をデータブックで調べてみると、 pKa の値として 4.56(たとえば理科年表)、あるいは 4.76 (たとえば実験化学ガイドブック)という数値が載っています。 どちらかがまちがっているわけではなく、 両方正しいのです。 pKa が 4.56 というは塩濃度が 0.1 mol/Lの場合、4.76 というのは塩濃度が 0 の場合の値に相当しています。 pKa で 0.21 大きいということは、Ka が4割小さいということですから、 色の変化を議論するうえでは、ちょっと無視できない話になります。
水の中に電荷 ze を持つイオンXがごく微量溶けているものとしましょう。 ここに何らかの塩を溶かすと、一般にイオンXは安定化されます。 塩濃度が比較的低い時(< 10-3 mol/L)この効果を精密に評価する理論としてデバイ-ヒュッケルの極限則があります。
水に電場をかけると、電場に概ね比例して分極がおきます(双極子モーメントが発生)。 この分極のエネルギーは、分極の大きさに電場をかけたもので評価できます(双極子モーメント×電場=エネルギー)。 分極の大きさが電場Eに比例するので、分極のエネルギー密度uはその場所での電場の2乗に比例します:
u ∝ E2 (2-3)
イオンの作る電場はイオンの電荷に比例し、距離の2乗に反比例しますから、分極のエネルギーUは次のような式で評価できます:
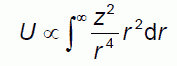 (2-4)
(2-4)
共存するイオンがなければ、水中のイオンはこれだけ余分のエネルギーを持っていると考えることができます。
デバイ-ヒュッケルの極限則は、共存するイオンによって、ある距離 rD (デバイ距離と呼ぶ)より遠方にはイオンの電場が届かなくなる(=遮蔽される)と考える理論だと考えることができます。 この距離 rD は溶存しているイオン種の濃度 c (より正確にはイオン強度)の平方根に逆比例して小さくなり、室温の水中では概ね下式で評価されます:
![]() (2-5)
(2-5)
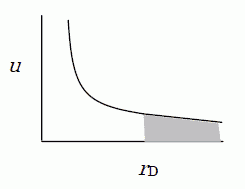
図 2-1. 遮蔽効果によるイオンの安定化。 距離 rD 以遠の水との相互作用は働かないものとみなせる。 |
10-3 mol/L程度なら rD は10 nm程度、10-1 mol/L 程度なら1 nm 程度です。 この距離以遠に電場が届かないとすると、イオンXは図3の灰色の部分に相当する領域のエネルギー ΔUだけ、安定化されることになります。 ΔUは電荷の大きさの2乗に比例し、デバイ距離に反比例します。
ΔU ∝ -z2/rD (2-6)
室温の水中でのデバイ距離の表現を用いると、注目するイオンの電場が共存イオンによって遮蔽されることによる安定化エネルギーは次式のように評価できます。
![]() (2-7)
(2-7)
さてここで化学平衡が塩の添加でどのような影響を受けるか、具体的に見てみることにしましょう。まず次の酸塩基平衡を考えます。
HX ⇔ H+ + X- (2-8)
塩の添加で水素イオン、X-イオンともに安定化され、上記安定化エネルギーに比例してpKIは変化します。 1価のイオンについて、このpKIの変化の度合いを f で表示しましょう。 塩を添加した時のpKIをpKI'で示すと次式で書けます。
pKI' = pKI - 2f (2-9)
一方もし次のような解離平衡ではどうでしょう?
HX+ ⇔ H+ + X (2-10)
塩の添加で、HX+イオン、水素イオンともに安定化され、結局のところ平衡定数に変化は現われません。
pKI' = pKI (2-11)
ここまでの話はいいでしょうか?では今回の実験の結果を少し詳しく見てみましょう。
図1-2 で見た系に食塩を加えると、 図2-1 に見るような吸収スペクトルの変化が観察されます。 吸収スペクトルの形状の変化、等吸収点の移動は認められず、 食塩と BPB あるいは PR とが何らかの会合体を作っているわけではなく、 食塩を加えたことで、酸塩基指示薬の酸型と塩基型の割合が変化したと判断されます。 食塩の添加で、BPB、PRともに塩基型の比率が大きくなります。 そして BPB より PR の方が共存イオン効果を強く受けます(BPB は pKI が 0.1 小さくなるのに対し、 PR では 0.3 程度小さくなる)。
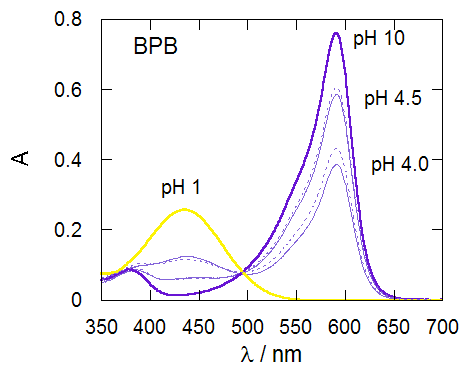
図2-2a.食塩添加による BPB 溶液の吸収スペクトルの変化。 pH 4.0、4.5の溶液は 0.1 mol/L 酢酸緩衝溶液使用。 図中点線は食塩添加後(NaCl 0.2 mol/L)のスペクトル。 |
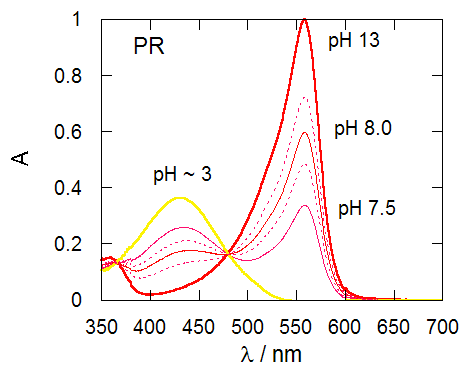
図2-2b.食塩添加による PR 溶液の吸収スペクトルの変化。 pH 7.5、8.0の溶液は 0.05 mol/L トリス緩衝溶液使用。 図中点線は食塩添加後(NaCl 0.2 mol/L)のスペクトル。 |
この効果を考えるポイントは、緩衝溶液それ自体に目を向けることでしょう。 緩衝溶液を構成する弱酸-弱塩基の解離平衡、pHも共存イオン効果を受けます。 BPBの場合は酢酸緩衝液でした。 ですから次のような平衡を考えることができます:
HA ⇔ H+ + A- (2-12)
HX ⇔ H+ + X- (2-13)
ここから次の関係を得ます
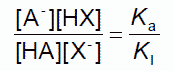 (2-14)
(2-14)
酢酸の陰イオン A- と酢酸 HA の濃度の比が一定になるように緩衝液は調製されています([A-]/[HA] = const)。 酢酸の酸解離定数に対する共存イオン効果(pKa' = pKa - 2f)と、 指示薬の酸解離定数に対する共存イオン効果がつりあっておれば、指示薬の共役酸・塩基の比[X-]/[HX]に変化はありません。 実験でBPBの塩基型が増えたのは、BPBの解離平衡に関与する分子種の電荷が大きかったものとして理解できます((2-6)式で見たように安定化エネルギーが電荷の2乗に比例することを思い出してください)。
この一方トリス緩衝液中では次のような平衡を考えることになります(トリスはアミンですから、 共役酸はカチオンで HA+ という形をとります)。
HA+ ⇔ H+ + A (2-15)
HX ⇔ H+ + X+ (2-16)
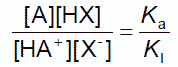 (2-17)
(2-17)
酢酸緩衝液の場合同様、トリス陽イオンとトリスの濃度の比が一定になるように緩衝液は調製されています([A]/[HA+] = const)。 酢酸と違ってトリスの酸解離定数に対する共存イオン効果はほとんどないので(pKa' = pKa)、指示薬の酸解離定数に対する共存イオン効果が、そのまま指示薬の共役酸・塩基の比[X-]/[HX]に反映される。 つまりBPBの場合に比して、大きな共存イオン効果が観察されるわけです(KIは共存イオン効果で大きくなるので、塩基型X-が増える)。
なお「共存イオン効果」には、ここで見たようなデバイ-ヒュッケル理論に基づくような効果以外に、 濃度が高くなるに従ってイオン対の生成(X+Y-といった“排他的”な相互作用=化学結合の形成。 イオンの電荷だけではなくその“個性”が光る)も大きな役割を果たします。 また濃度の高いところでは中性の溶質にも作用する塩析salt out効果(塩入salt in効果もあるがちょっと例外的)も重要になってきます。 塩析は、水溶液に食塩を溶かすと、溶けていた有機物が分離析出してくるといった現象で、 有機化学実験で水相からの有機物の抽出などの際によく出会うことでしょう。