|
|
吸収・発光の波長の精度をさして求めない実験課題を行っていて、 波長較正操作を入れないでいたのですが、 何らかの衝撃を与えたためか、大きく波長のずれる分光器が出たことをきっかけに、 2015年度から波長較正操作を考慮するようにしました。 また excel で吸光度データ等を処理するようになり、 CHEMUSB 4 から吐き出されるデータ量の圧縮・正規化(波長を揃える)も行うようにしました。 具体的には次のようなデータ処理をおこなうようにしています。
分光器で測定される波長が正確かどうかは、少し精密な実験になると大きな問題になっていきます。 たとえば空気中で測っているなら、空気の屈折率の影響(真空中に比べて波長が0.03 %短い)もあるのです (市販の分光光度計は、何も言わなければ真空中での波長の値を出力するように調整されています)。
CHEMUSB4では、メーカーからの出荷段階で、分光器内に配置された各光学素子が受光する光の波長が、 あらかじめ標準光源を用いて測定・記憶させてあり、それに基づいてデータが出力されてきます。 けれども温度の変動や衝撃等の影響で、設定波長は微妙にずれてきます。 実際CHEMUSB4の場合、装置を起動して温まってくると1 nm程度の波長のドリフトは起きるようです。
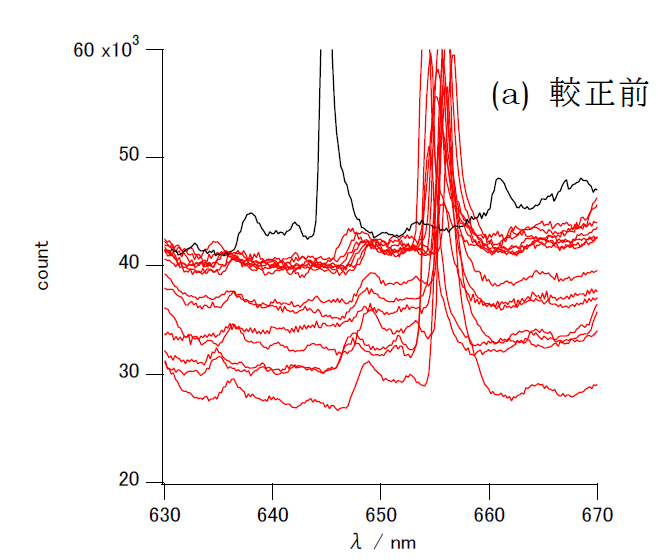
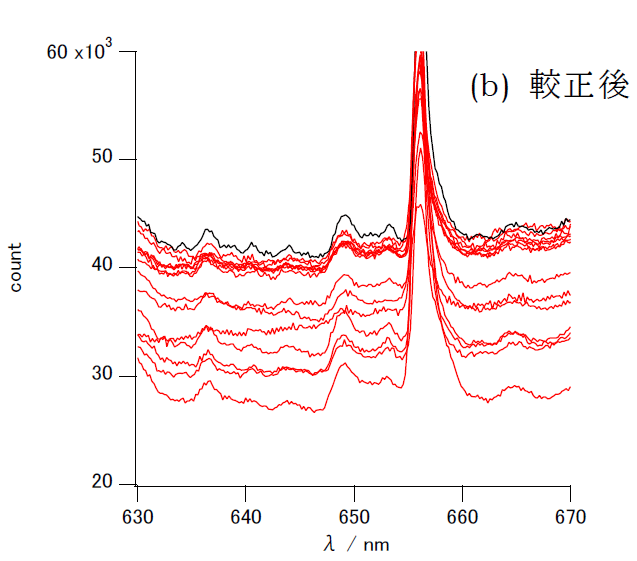
こうした影響を取り除くために、安定した波長を与える光源の輝線(CHEMUSB4で使用しているD2ランプのスペクトルの656.1 nmの輝線 )を利用して、 較正を行います(こうした波長較正は、ちょっと高価な市販の装置では、起動時に自動で行われいて、あからさまに意識されることは少ないようです)。 図1に示すのは、以前1台のCHEMUSB4の波長設定に大きな誤差が現れた時に、光源の発光スペクトルを取ってみた結果です。 D2ランプの656.1 nmの輝線が11 nm程度短波長側にずれていることが分かります。 他の14台については、おおむね2 nm程度のずれに止まっています。 これを輝線の位置が656.1 nmになるように平行移動させて較正した結果を見ると、大きく外れた機種も含めて、 光源の発光強度の細かいプロフィルも一致していることがわかります。
656.1 nmの輝線はいわゆる Hα 線に相当します。 重水素を使用しているので、通常水素の発光スペクトルの輝線としてハンドブックなどに載っている 656.3 nm より少し短波長になります (この微妙な差がユーレー Urey の重水素の発見につながったのは有名)。 なお興味のある人はボーアの水素原子モデルに基づいて、リドベルグ定数から計算してみましょう。 計算してみると正確には656.1 nmになりませんよね。 なぜでしょう?

|

|
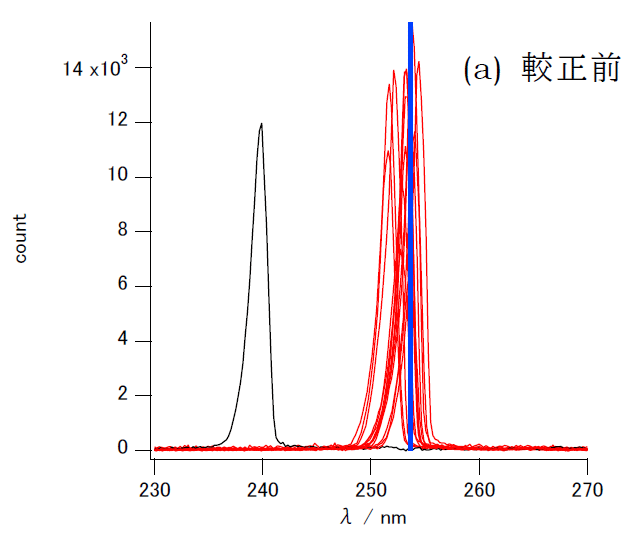
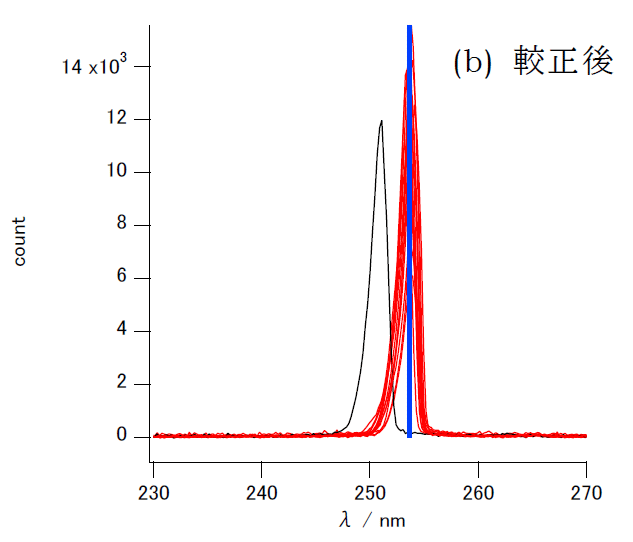
けれども656 nmでの偏倚の分だけ「平行移動」(ゼロ次の補正)したからからといって他の波長、例えば300 nmでの偏倚が除けるかどうかは問題です。 低波長側での較正の様子を見るため、 図2にはブラックライト(低圧水銀灯)の253.7 nmの水銀の輝線スペクトルを測った結果を示します。 656 nmで大きくずれていた分光器は、656 nmで合うようにシフトさせただけでは較正が不十分で、3 nm程度の偏倚が残っています。 でもそれ以外の機種については、656 nmで較正することで、一致は非常によくなっています。
|
|
この大きく外れた分光器については、もう少し手の込んだ較正をすることも考えられます(波長に依存する較正)。 けれども学生実験の実際を考え、メーカーに依頼して、標準光源を用いてもう一度装置に記憶されている波長データを書き直してもらうことにしました。
というわけでCHEMUSB4について、656 nm付近で2~3 nm程度のずれがあっても、単純に平行移動するだけで波長較正は十分。 ただし10 nmも外れると考え直す必要アリということです。 大きな波長のずれは、装置を乱暴に取り扱ったことによる(落としたり、ゆすぶったり・・・)ものと思われます。 分光光度計はデリケートな装置。 やさしく取り扱って欲しいところですが・・・
付属ソフトの SpectraSuite から得られるスペクトルデータは、 CCD に対応してほぼ0.2 nmごと3648個のデータになっていて、 それぞれの対応する波長の値は、機種ごとにちがっています (たとえばある機種は 177.70、177.92、178.13、178.35、・・・ nm であるのに対し、他の機種だと178.56、178.78、179.00、179.22、・・・nm といった具合。 このデータは各機種のメモリーに書き込まれている)。 以前は Igor Pro を用いてデータを読み込んでスペクトルを得るかたちだったので、 データの圧縮や正規化(波長を揃える)などをあまり追求していませんでした。 それを Igor Pro のライセンス契約が変更になり、 また当初から Igor Pro を用いるのは学生の負担が大きい(教員スタッフも)こともあって、 excel を用いた解析に変更することになり、 思い切って excel のマクロを用いたデータの圧縮・正規化をするようにしました。
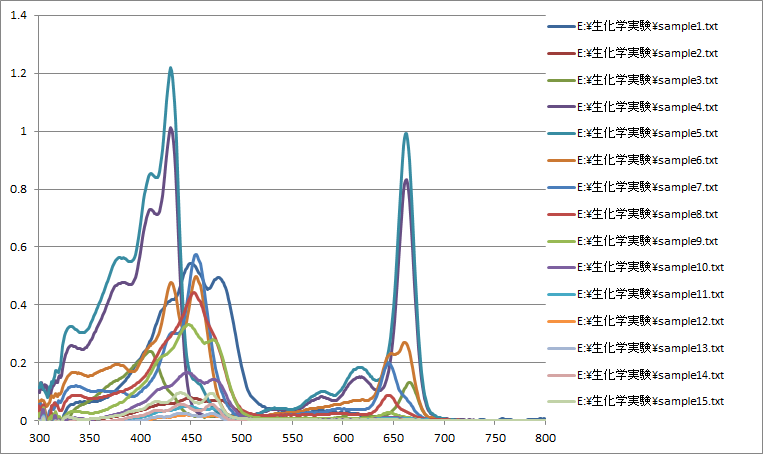
クロロフィルなど脂溶性の植物色素のクロマトグラフィーを行う実験についての、 excel のマクロ付きのサンプルシートを紹介しておきます (biodye_sample.xlsm)。 SpectraSuite から得られるスペクトルデータを読み込んで、 300 ~ 800 nm まで、1 nm 刻みのデータに変換するマクロを組み込んであります (個人的な好みとしては VB には触りたくなかったのですが、・・・)。
なお実際には、こうしたサンプルシートの利用は、 適切に行われているとはいえません。 学生の excel などの取り扱いのスキルの問題も大きいのですが、 何より問題は教員スタッフの意欲・能力にあるように感じます。
|
|