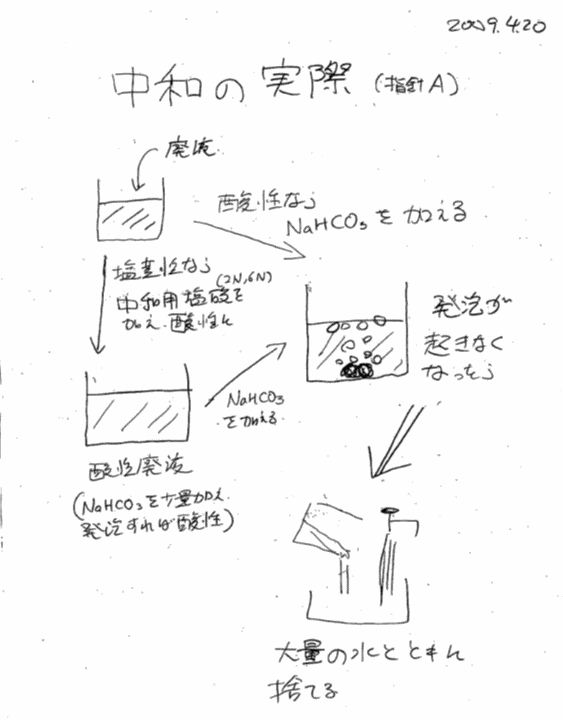
<概要>
学生実験で出る廃液の中で、有害な薬品を含まない強酸の溶液は直接、強アルカリの溶液は一旦酸性にしてから、 過剰の炭酸水素ナトリウム(重曹)で中和して排出することにしている。 ここでは炭酸水素ナトリウム溶液のpHが、酸やアルカリの添加でどのような変動を示すのかを調べる。
<実験>
- ビーカーに0.5 mol/L炭酸水素ナトリウム溶液50 mL程度を取りpH計でpHを測定する。
- マグネチック・スターラーを用いて攪拌しながら、 (1)の溶液に駒込ピペットを用いて1 mol/L塩酸を0.5 mL滴下して加えpHを測定する(発泡に注意)。さらに0.5 mL加え、pHを測定する。
- 同様に攪拌しながら(2)でpHを測定し終えた溶液に、駒込ピペットを用いて1 mol/L水酸化ナトリウム溶液を1.0 mL加えて中和しpHを測定する。 その後、1 mol/L水酸化ナトリウム溶液を0.5 mL加えpHを測定する。またさらに0.5 mL加えpHを測定する。
- (3)でpHを測定し終えた溶液に1 mol/L水酸化ナトリウム溶液をメートルグラスで5 mL測って加えpHを測定する。 さらに水酸化ナトリウム溶液5 mLを追加してpHを測定する。
- (4)でpHを測定し終えた溶液に1 mol/L塩酸をメートルグラスで11 mL測って加え中和した後、 塩酸5 mLを加えpHを測定する(発泡注意)。さらに塩酸5 mLを追加してpHを測定する。
<検討>
- 吉田地区の排水のpH値の排出基準は5~9である。実験値に基づいて、炭酸水素ナトリウム10 g(0.12 mol)で、 1 mol/L塩酸を何mL程度中和処理して排水に流すことができるようにできるか推定せよ。
- 図2-3に炭酸水素イオン0.1 mol/Lの溶液に塩酸/水酸化ナトリウムを加えた場合の炭酸の各イオン種 (炭酸H2CO3、炭酸水素イオンHCO3- と炭酸イオンCO32-)の濃度変化とpH変化の計算値を示す (20 °Cで二酸化炭素分圧が 1 atmの時の二酸化炭素の飽和濃度は 0.04 mol/L程度なので、 塩酸を加えていくと途中で過飽和状態になる)。 炭酸水素ナトリウム10 g(0.12 mol)で、1 mol/L塩酸を何mL程度中和処理して排水に流すことができるようにできるか推定し、実験値と比較せよ。
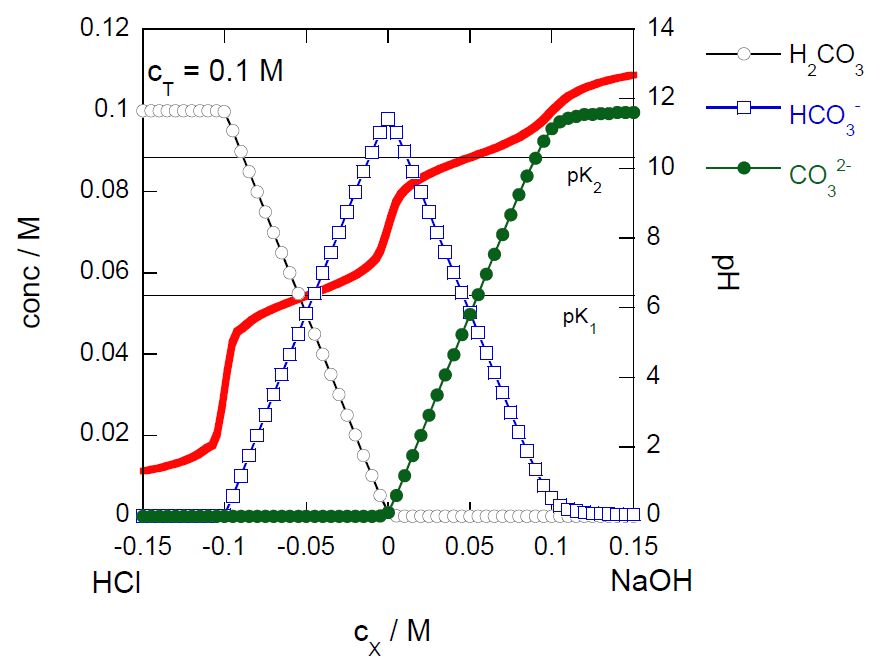
図2-3 炭酸水素ナトリウム溶液に塩酸/水酸化ナトリウム溶液を加えた時の炭酸の各イオン種の濃度変化とpH変化の計算値。 炭酸イオンの総濃度cT = [H2CO3] + [HCO3-] + [CO32-]を 0.1 mol/Lとし、 そこに水酸化ナトリウムを加えた場合を +、塩酸を加えた場合を - にとってある。 炭酸の第1解離定数 pK1は6.4、第2解離定数pK2は10.3程度である(資料編V-15参照)。