<概要>
酸・塩基の滴定に用いる指示薬は、溶液のpHによって色が変わる。この変化は酸塩基指示薬が弱酸(塩基)である性質を利用しているのである。 ここでは分光光度計を用いて、実際に共役酸、共役塩基の濃度比のpH依存性を調べ、酸塩基指示薬の解離平衡定数を定める。
<試薬>
- ブロモフェノールブルー(BPB)0.1%溶液{フェノールレッド(PR)0.1%溶液}
- pH 10炭酸塩緩衝溶液{0.2 mol/L炭酸ナトリウム溶液}
<原理>
酸塩基指示薬(HX)の色の変化は、一般に次のような化学平衡に基づくものである。
HX ⇔ H+ + X-
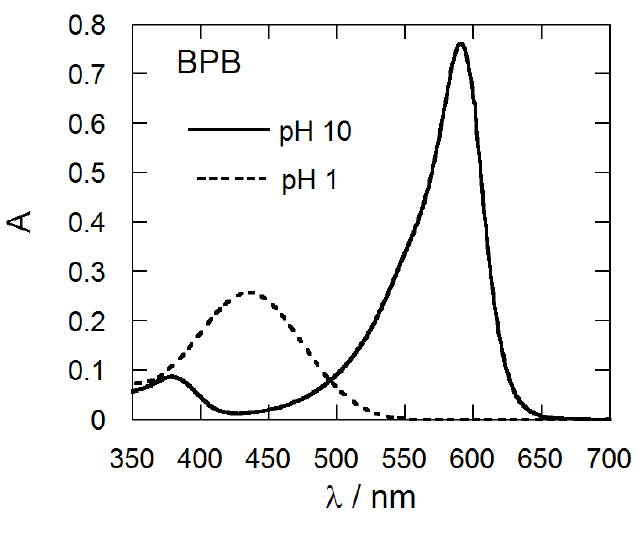
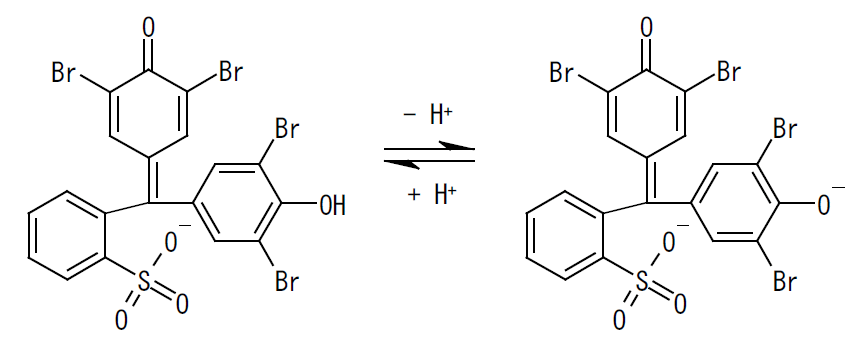
解離平衡の式から、水素イオン濃度が指示薬の酸解離定数 KI の値に近いとき、 pHの変動にともなって、共役酸・塩基の存在量の逆転が起きることがわかる。 指示薬に使われる物質では、この共役酸 HX と共役塩基 X- の光の吸収帯に大きな違いがあり、 pKI 付近の pH で大きな色の変化が起きる。 右図にはブロモフェノールブルー(BPB)の強酸性とアルカリ性での吸収スペクトルを示す。 溶液中で BPB は次の式のような解離平衡にあると考えられ、 アルカリ側では右側の共役塩基型になり590 nm付近に大きな光の吸収を示すようになるわけである(注1)。
したがってBPBの吸光度から共役酸・塩基の比率を定めることができれば、その時のpHの値を用いて、 BPBの酸解離定数を定めることができる。同様にしてフェノールレッド(PR)についても酸解離定数を得ることができる。 先に8-2で調製した緩衝溶液を用いて、酢酸緩衝溶液を調製したグループはBPBを、トリス緩衝溶液を調製したグループはPRについて酸解離定数の決定を行う。
(注1)強アルカリ条件ではBPBへの水酸化物イオンの付加が起き退色する(この変化は比較的遅い)。 またフェノールレッド(PR)では強酸条件でさらなる水素イオンの付加が速やかに起きる。
<操作>
- イオン交換水を30 mL取り、ここに用意してあるブロモフェノールブルー(BPB)溶液{フェノールレッド(PR)溶液}を0.3 mL(あるいは0.3 g)程度加えよく混ぜる。
- 乾燥させたサンプル管を4個用意し、それぞれに(1)で作ったBPB溶液{PR溶液}をメスピペットで3.00 mLずつ取る。
- (2)のサンプル管に、(a) pH 10炭酸塩緩衝溶液、(b) pH 4.0、(c) pH 4.5の酢酸-酢酸カリウム緩衝溶液、(d) 0.1 mol/L塩酸{(a) 0.2 mol/L炭酸ナトリウム溶液、(b) pH 7.5、(c) pH 8.0のトリス緩衝溶液、(d) フタル酸水素カリウム緩衝液}を、それぞれメスピペットで3.00 mLずつ加えて混ぜる。
- イオン交換水をリファレンスとして、作製した4種のBPB溶液{PR溶液}について、350 nmから750 nmの吸光度を測定する。
<検討>
- 470 nmから520 nmの領域に等吸収点(吸光度が変化しない点)があらわれることを確認せよ。このことは何を意味するか?
- 590 nm{560 nm}付近の吸光度を用い、pH 4.0とpH 4.5{pH 7.5とpH 8.0}での指示薬の共役酸・塩基の比を求め、BPB{PR}の酸解離定数を計算せよ。
- 他の波長(例えば440 nm{430 nm}付近)における吸光度を用いて、BPB{PR}の酸解離定数を求め(3)で得た結果と一致するか確かめよ。
- pH 4.0と4.5{pH 7.5と8.0}の吸収スペクトルの差が完全な酸型と塩基型のスペクトルの差に相当することを、式、及び実測で確かめる。
- 今回のように色合いが大きく変化する場合、比色法を用い肉眼で指示薬の解離定数を推定するには、どのようなことが必要になるだろうか? 画像解析も試みて検討してみよ(RGB値のGの値のpH依存性を調べてみよ。指示薬がBPBの場合であればRの値のpH依存性でもよい)。
<廃棄物処理>
指示薬の入っている溶液は指針Bに従って処理し、その他は指針Aに従って処理する。