<概要>
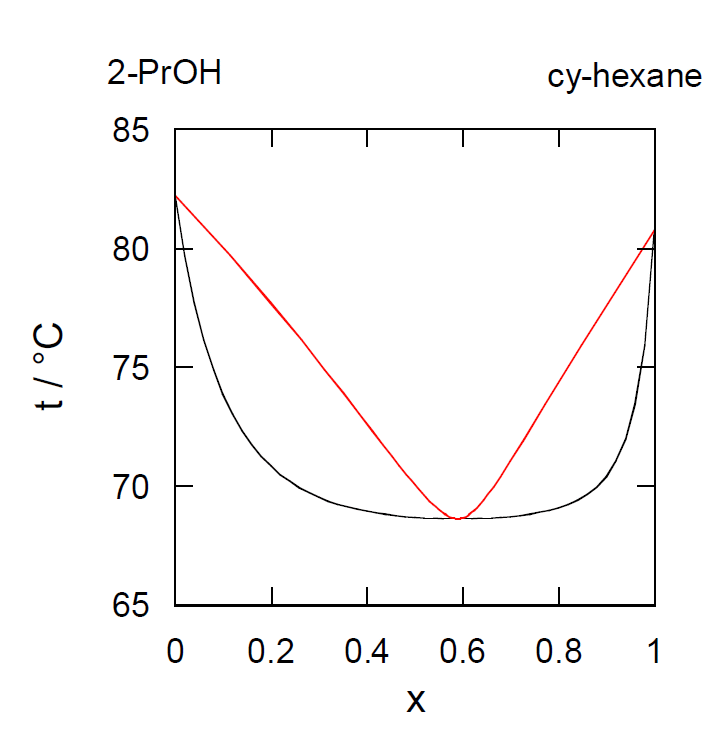
シクロヘキサン(沸点80.7 °C)と2-プロパノール(沸点82.3 °C)の溶液を蒸留すると、 溶液の組成によっては双方の純粋な状態よりも低い70 °Cで沸騰が起きる。 これはこの系の沸点-組成曲線が図6-5 に示すような極小値を示すからである。 この現象を共沸azeotrope、極値を示す点を共沸点と呼ぶ(塩酸など極大を示す場合と区別するため、正の共沸と呼ぶこともある)。 共沸点では蒸気相と液相の組成が一致し、あたかも溶液は1成分溶液のように振る舞い、蒸留によって構成成分に分離することはできない。
 |
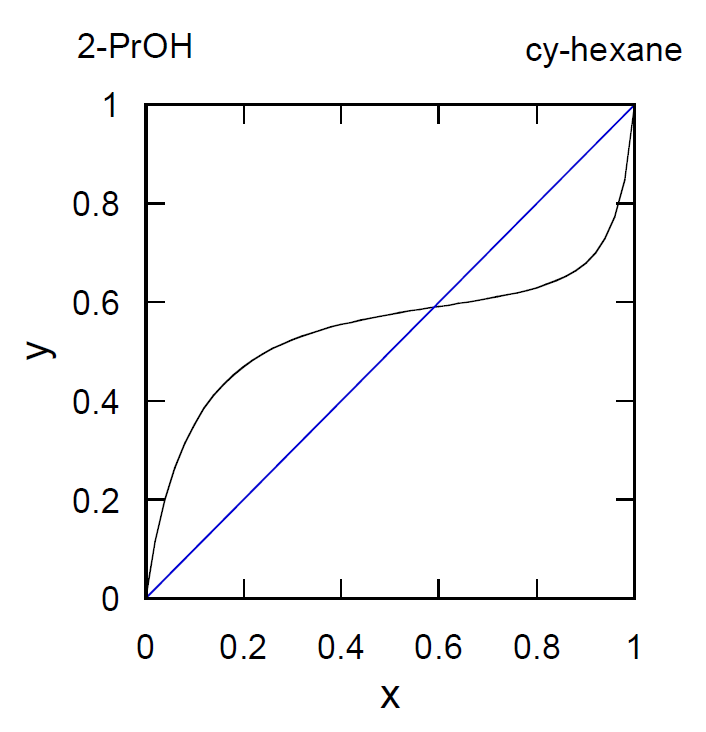 |
| 図6-5 シクロヘキサン-2-プロパノール系の沸点組成曲線。 | 図6-6 シクロヘキサン-2-プロパノール系の液相蒸気組成曲線。 |
なお混合液体が双方の純粋な状態よりも低い温度で沸騰するのは、 水とシクロヘキサンのように液液分離を起こす場合には一般に起きる現象であり、 水蒸気蒸留などの形で物質分離にも利用されている。
<操作>
- 100 mLの三口フラスコにシクロヘキサンと2-プロパノールをそれぞれ 15 g程度ずつ、 0.01 gまで精確に秤量して入れる(量比は適宜変えてよい)。
- シクロヘキサン-トルエン混合液体の時と同様に、ト字管を取りつけ蒸留を行う。 留分をおよそ2~3 g程度ずつ採取し温度を記録する。
- 各留分の屈折率を測り各留分の組成を求める(注1)。
(注1)濃度を変えて屈折率を測定し検量線を作成するのが望ましいが、純2-プロパノールの屈折率n2を測定し、 シクロヘキサン-トルエンと同様、屈折率 n が n = n2 + (n1 - n2)m + k m (1 - m) という実験式に従うものとし、 k = -0.013(過去のデータによると室温付近ではこの程度の値になる)として算出する程度でよい。
<実験結果の解析>
- 留出量と留出温度・留出液の組成の関係を図示せよ。
- 文献によるとシクロヘキサンと2-プロパノールの共沸点は69 °C、共沸組成はシクロヘキサンのモル分率0.59とされている。実験結果から共沸点、共沸組成としてどの程度の値になるか求めよ。
<実験例>
シクロヘキサン-2-プロパノール混合液体(シクロヘキサンの質量分率0.49)を蒸留した実験
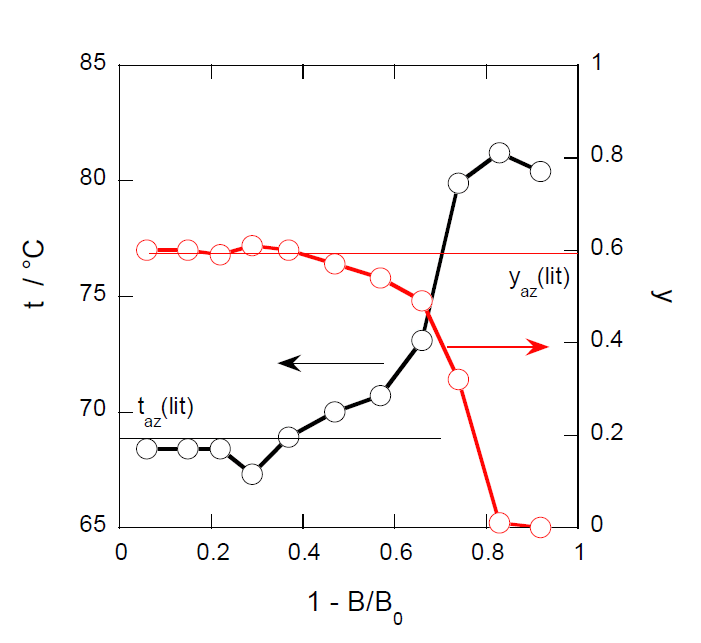 |
図6-7 シクロヘキサン-2-プロパノール混合液体の蒸留にともなう留出温度 t、 留出液中のシクロヘキサンのモル分率 y の変化。 図中 taz(lit)、yaz(lit)は共沸温度、共沸組成の文献値。 |
<検討>
- ウィルソンWilson式を用いて共沸現象が再現できるかどうか確認せよ。
2成分系についてウィルソン式は活量係数 \(\gamma_1\)、\(\gamma_2\)を次式で評価する(\(P = \gamma_1 x_1 P_1^\bullet + \gamma_2 x_2 P_2^\bullet\)):
\begin{equation} \ln \gamma_1 = -\ln (x_1 + \Lambda_{12} x_2) + x_2 \left[ \frac{\Lambda_{12}}{x_1 + \Lambda_{12} x_2} - \frac{\Lambda_{21}}{\Lambda_{21} x_1 + x_2} \right] \\ \ln \gamma_2 = -\ln (\Lambda_{21} x_1 + x_2) + x_1 \left[ \frac{\Lambda_{21}}{\Lambda_{21} x_1 + x_2} - \frac{\Lambda_{12}}{x_1 + \Lambda_{12} x_2} \right] \label{eq:Wilson} \end{equation}
シクロヘキサン(1)-2-プロパノール(2)系については、\(\Lambda_{12} = 0.35942\)、\(\Lambda_{21} = 0.15354\) という値が報告されている。 ここでは相対揮発度 \(\alpha = P_1^\bullet /P_2^\bullet\) を 1 として、\(x_1\) と \(y_1 = \gamma_1 x_1 /(\gamma_1 x_1 + \gamma_2 x_2)\) をプロットして、 図6-6に相当する図を描いてみればよい。 - シクロヘキサンと水を同じ重さ含む混合物を蒸留する場合、何°Cで沸騰が起きるだろうか。 また留出液の温度・組成はどのように変化するだろうか。 シクロヘキサンと水は液相では互いに溶け合わないものと考えることができ、混合液の蒸気圧が純粋なシクロヘキサンと水の蒸気圧の和で評価できるものとする。