<概要>
酸性条件下においてアセトンはヨウ素と反応して、ヨードアセトンとなる。
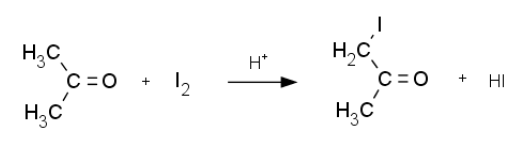 (C)
(C)
アセトンが大過剰の条件下でこの反応を行わせると、ヨウ素濃度がほぼ一定速度で減少する、 ヨウ素濃度について0次の速度則が現われる。 このことを実験的に確認し、反応機構について考察する。
C-1 実験操作
C-1-1.試料溶液の準備
塩酸は用意してあるものをそのまま使用すればよい。 アセトン溶液、ヨウ素溶液はいずれも15 mLの遠沈管を用い、濃度は数%の精度で調製すればよい。
- 1.0 mol/L塩酸
- 1.0 mol/Lアセトン溶液:アセトン0.58 gを水に溶かして10 mLにする。
- 3 mmol/Lヨウ素溶液:ヨウ化カリウム0.08 gを取り、1 mL程度の水を加えて溶解させる。 ここに用意してある0.10 mol/Lヨウ素酸カリウム溶液0.10 mLと1 mol/L塩酸 0.1 mLを加えて混合し、水を加えて10 mLにする。
C-1-2.反応速度の測定
光学セルにアセトン溶液1.0 mLと塩酸1.0 mLを入れてふり混ぜる。 ここにヨウ素溶液0.5 mLを加えて手早く混合し、ただちに吸収スペクトルの時間変化を測定する (変化が収まるまで、おおむね5~10秒おきに記録すればよい)。 ついで溶液をメスピペットでそれぞれ次の表のイ~ハに示す量ずつ取って混合し、 吸光度の時間変化をストリップチャートモードで測定する。 350 nm、400 nm、450 nm付近の吸収に注目し、 およそ2秒程度の間隔で吸収の減少が収まるまで測定する。
| アセトン溶液 /mL | 塩酸 /mL | ヨウ素溶液 / mL | 水 /mL | |
| ア | 1.0 | 1.0 | 0.5 | 0.0 |
| イ | 0.5 | 1.0 | 0.5 | 0.5 |
| ウ | 1.0 | 0.5 | 0.5 | 0.5 |
| エ | 0.5 | 0.5 | 0.5 | 1.0 |
C-2実験結果の解析と課題
C-2-1.速度則の決定
記録した吸光度の時間変化から、反応開始からヨウ素の減少量90%以上に到るまで、 ヨウ素の吸光度の減少速度がほぼ一定であることを確認し(吸光度が1.5以下の領域に注目する)、 ア~エの混合比の場合について、注目したそれぞれの波長における吸光度の時間変化を表にまとめよ。 溶液の混合比を変えた時のヨウ素の減少速度から、 ヨウ素の減少速度が次の速度則に従うことを確認し、速度定数 \(k\) を定めよ。ここで [HA] はアセトン濃度。
\begin{equation} \frac{\mrm{d~[I_2]}}{\rmd t} = -k \mrm{[H^{+}] [HA]} \label{eq:aci2_rate} \end{equation}
C-2-2.低ヨウ素濃度領域の挙動
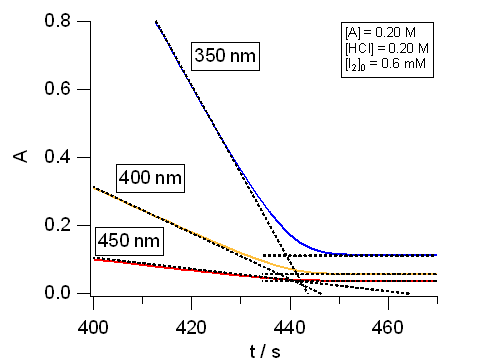
完全にヨウ素濃度について 0 次の反応であれば、 ヨウ素の吸光度変化はヨウ素濃度が 0 になる時点で折れ曲がり、 反応速度が不連続に変化するはずである。 しかし特に 350 nm付近など、 吸光係数の大きい波長域での吸光度変化には反応が収束する時間の近傍で、 非線形の挙動が認められる。 ヨウ素濃度がどの程度以下になったら 0 次の反応速度の挙動が消失するかを評価せよ。
C-2-3.反応機構の推定
実験結果を説明するために、次のような反応機構を考え、
HA + H+ ⇄ H2A+
H2A+ + I2 → AI + HI + H+
それぞれの速度則が次の反応速度則に従うものとする (HAはアセトン、H2A+ はアセトンに水素イオンが付加した中間体、 AIはヨードアセトン):
\begin{eqnarray} \frac{\mrm{d~[HA]}}{\rmd t} &=& -k_{+1} \mrm{[H^{+}] [HA]} + k_{-1} \mrm{[H_2 A^{+}]} \\ \frac{\mrm{d~[I_2 ]}}{\rmd t} &=& -k_{2} \mrm{[H_2 A^{+}] [I_2 ]} \label{eq:aci2_rateeqs} \end{eqnarray}
アセトン濃度 [HA] が十分大きいとして、 ヨウ素濃度[I2]、速度定数 \(k_{+1}\)、\(k_{-1}\)、\(k_{2}\) がどのような要件を満たしておれば、 ヨウ素濃度の減少が一定になる(0次になる)とみなせるだろうか? またヨウ素濃度が、どの程度まで減少すると 0 次でなくなるだろうか?
なお通常、有機化学ではエノール型の中間体を経由する次のような反応機構で、 α炭素へのハロゲンの付加が説明されている:
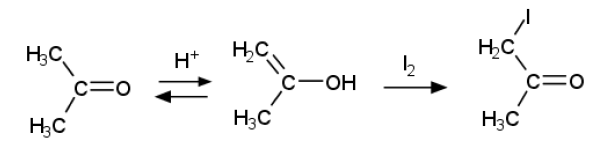
この反応機構に基づくと、今回の実験結果はどのように説明されるだろうか?
実験例
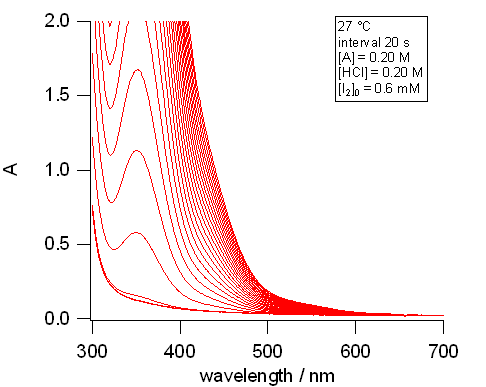
|
図7. アセトン-ヨウ素の反応にともなうスペクトル変化の実験例(27 °C)。 [HA] = 0.20 M、[HCl] = 0.20 M、[I2]0 = 0.6 mM |
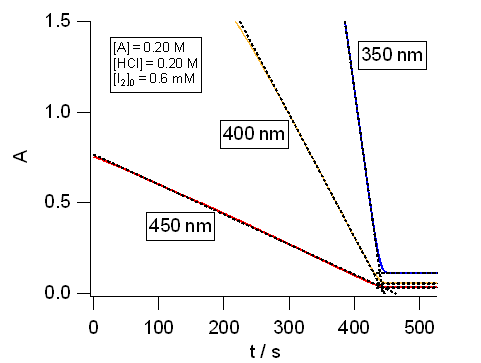
|
|
| 図8. アセトン-ヨウ素の反応にともなういくつかの波長での吸光度変化の実験例(27 °C)。 右は反応終了前後の拡大図。 [HA] = 0.20 M、[HCl] = 0.20 M、[I2]0 = 0.6 mM | |