last revised 2020.7 / 2020.5
吉村洋介
3 . 容量分析の初歩
3-1 乳酸の分析 ―― 中和滴定
<概要>
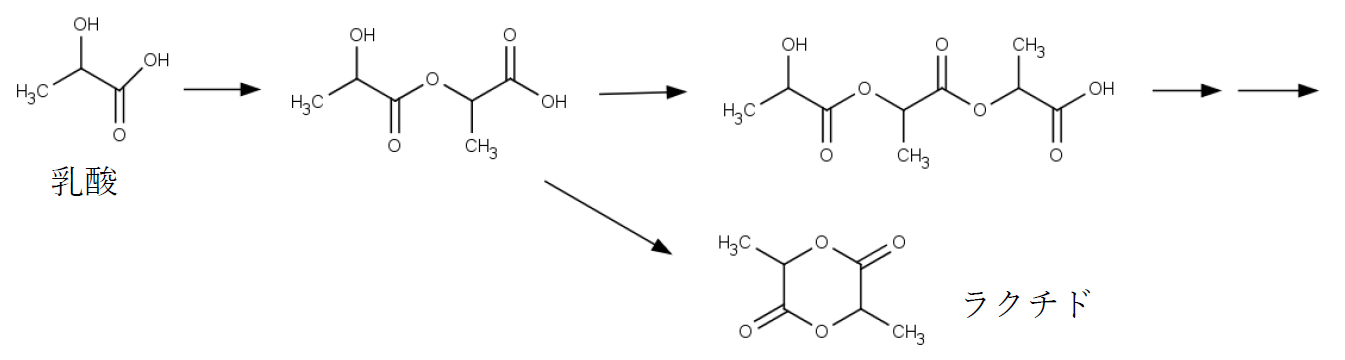
乳酸C3H6O3(分子量90.08)は加熱等によって容易に縮合反応を起こしてエステルを形成し、
種々のオリゴマー(縮合酸・ラクチド)を生じることが知られている 。
市販の乳酸中にはオリゴマー(主に二量体である無水乳酸)が相当程度含まれており、
またそうしたオリゴマーの生成を避けるため市販試薬の乳酸の含量は低めに設定されている(JIS規格では85.0~92.0%。JIS K8726)。
ここでは中和滴定(酸塩基滴定)によって、市販の乳酸の総乳酸量とその中の縮合した乳酸の割合を求める実験を行う。
エステルを形成していない遊離のカルボキシ基の量(遊離酸量)は、市販の乳酸を水酸化ナトリウムで直接滴定することによって、
また総乳酸量(縮合した乳酸をすべて加水分解した場合に得られる乳酸量)は水酸化ナトリウムでオリゴマーを加水分解した後、
過剰の水酸化ナトリウムを塩酸で逆滴定することによって定める。
なお実験に先立って資料編II-2の<容量分析操作の実際>に目を通しておくこと。
3-1-1 乳酸の直接滴定と加水分解
<操作>
- 水酸化ナトリウム約0.8 gをビーカーにはかり取り、イオン交換水100 mLを加えて溶かす。
調製した溶液はアルカリ用の試薬瓶に入れる(0.2 mol/L (0.2 N)水酸化ナトリウム溶液)。
- 用意してある乳酸溶液(市販の試薬を水で50 mass%に希釈したもの。精確な濃度は乳酸溶液の瓶に表記)
約0.36 gをスポイトを用いて0.1 mgまで精確にコニカルビーカーにはかりとり(注1)、
メートルグラスを用いてイオン交換水5 mLを加える。
- ビュレットをイオン交換水で洗浄した後、少量の0.2 mol/L水酸化ナトリウム溶液で共洗いし、
ビュレットに0.2 mol/L水酸化ナトリウム溶液を注ぎ込む。
- フェノールフタレイン指示薬を数滴加え、水酸化ナトリウム溶液で乳酸を滴定する(注2)。
溶液に赤みがさすところが終点である(注3)。終点までに加えた0.2 mol/L水酸化ナトリウム溶液の量を記録する。
- さらにビュレットから0.2 mol/L水酸化ナトリウム溶液約10 mLを0.01 mLまで精確に加える(注4)。
滴定終点から過剰に加えた水酸化ナトリウム量を、後で塩酸を用いて滴定することになる。
- 水酸化ナトリウム溶液を加えた乳酸溶液の入ったコニカルビーカーにラップをして(注5)、
穏やかに沸騰している水浴中に置き(注6)、約30分程度加熱して乳酸のオリゴマーを加水分解する。
(注1)蒸発による減量が起きるので手早く作業する。
(注2)ガラス製の活栓を用いたビュレットの場合、アルカリ性の溶液を用いて長時間(濃度にもよるが1時間程度)操作すると活栓が動きにくくなり、
1日放置すると動かなくなることもある。
使用後はすぐに洗浄し活栓を外しておくこと。一般にすり付のガラス容器を用いるときも同様の注意が必要で、
水酸化ナトリウム溶液を保管するのにはすり付の試薬瓶は用いず、ゴム栓を使ったアルカリ用の試薬瓶を用いる。
(注3)いったん変色したものをしばらくおくと、空気中の二酸化炭素の影響でまた無色に戻ることがある。
ここでは最初に変色した時点での滴定値を採用する。
(注4)流下速度が速すぎると、加えた水酸化ナトリウム溶液の量が見かけ上多目に出る。1~2分程度かけて加える。
(注5)空気中の二酸化炭素の吸収を防ぐためにラップしておく。時計皿で蓋をしておいてもよい。
(注6)各机に置かれたホットプレートに水を入れ(入れすぎるとビーカーが転倒するので注意)、
穏やかに沸騰する程度にして使用する。蒸発を防ぐため、発泡スチロール製のビーズを浮かべるとよい。
ビーカーや手についたビーズは流水で洗い落とし、笊を使って回収する。
3-1-2 0.2 mol/L塩酸標準溶液の調製と標定
<操作>
- 6 mol/Lの塩酸3.4 mL(3.7 g)を200 mLのビーカーに取り、イオン交換水を加えて希釈し約100 mLにする。
調製した溶液は試薬瓶に入れる(0.2 mol/L (0.2 N)塩酸。
この溶液は後の「4-3-1 アルカリ度(酸消費量)」でも使用するので、乳酸の課題が終わっても捨てないでとっておくこと)。
- 無水炭酸ナトリウム(Na2CO3、式量105.99)約1.1 gを0.1 mgまで精確に秤量し(注1)、
メスフラスコを用い、イオン交換水に溶かして精確に100 mLにする。(0.1 mol/L (0.2 N)炭酸ナトリウム標準溶液)
- ビュレットをイオン交換水で洗浄し、少量の0.2 mol/L塩酸で共洗いした後、ビュレットに0.2 mol/L塩酸を注ぎ込む。
- 10 mLのホールピペットをイオン交換水で洗浄し、少量の0.1 mol/L炭酸ナトリウム溶液で共洗いする。
このホールピペットで0.1 mol/L炭酸ナトリウム溶液を精確に10 mLコニカルビーカーにはかりとる。
ここにメートルグラスを用いてイオン交換水20 mLを加え、ブロモフェノールブルー(BPB)あるいはメチルオレンジ(MO)指示薬を用いて、
0.2 mol/L塩酸で滴定する。終点付近になったら一度溶液をおだやかに煮沸して二酸化炭素を追い出した後、滴定を継続する(注2)。
指示薬にBPBを用いるときには溶液が青紫から灰緑色(青みの緑)になった時、MOを用いるときには溶液が黄色から橙色になった時を滴定終点とする。
標定操作は複数回行なうのが望ましい(注3)。
(注1)精秤する際に薬包紙を用いるのは、薬包紙に試薬が付着したり(場合によるが通常数mg)湿気を吸ったりして
(場合によるが0.1 mg程度)誤差の原因となるので好ましくない。
時計皿を使用して秤量し、洗瓶を用いてはかり取った試薬を時計皿からイオン交換水で、ロートを介してメスフラスコ中に直接洗い落とすのが簡単。
十分撹拌するのを怠らぬよう。
(注2)終点付近になったことは、塩酸を滴下した後の色の変化から判断すればよい。一端変色を確認してから煮沸操作に移ってもよい。
(注3)滴定溶液が多めにあるので、滴定操作の練習の意味もあって複数回行うことを推奨する。
滴定操作を繰り返す時は、試料溶液をホールピペットで採取するところから始めて、滴定を終了するまでの操作を繰り返すのが望ましい。
連続して溶液を採取して、滴定する溶液を複数調製し、それぞれの溶液を連続して滴定した方が手早いが、個々の測定の独立性が弱まり、データのかたよりが生まれる危険が大きい。
3-1-3 乳酸の逆滴定
<操作>
- 【空滴定】ホールピペットをイオン交換水で洗浄し、少量の0.2 mol/L水酸化ナトリウム溶液で共洗いする。
このホールピペットで0.2 mol/L水酸化ナトリウム溶液を精確に10 mLコニカルビーカーにはかりとる。
ここにメートルグラスを用いてイオン交換水20 mLを加え、フェノールフタレイン指示薬を数滴加え、
0.2 mol/L塩酸で滴定する。赤い色が消えたところが終点である(注1)。
- 水酸化ナトリウム溶液を加えた乳酸を、水浴から取り出し少し冷ます。
- フェノールフタレインの呈色が弱くなっているようならフェノールフタレイン指示薬を追加した後、
0.2 mol/L塩酸で滴定する。赤い色が消えたところが終点である(注1)。
(注1)色が消失するところを終点とするので変色の挙動に注意する。また溶存する二酸化炭素の影響で変色が鮮明でない場合がある。かすかに赤色が残っていても終点と判定する。不安を感じるものは空滴定を複数回行うのが望ましい。
<検討>
- 4-1-2の標定の際の炭酸ナトリウムの秤量値をwNa2CO3 g、
塩酸の滴下量をV0 mLとすると0.2 mol/L塩酸の精確な濃度 cHCl mol/L は次式で与えられる
(ホールピペット、メスフラスコの精度が1/1000まであるとする):
\[
\rm{
c_{HCl} = 2 \times \frac{1 ~L}{100.0 ~mL} \times \frac{w_{Na2CO3}}{105.99} \times \frac{10.00}{V_0} = \frac{w_{Na2CO3}}{105.99} \times \frac{200.0}{V_0} ~~~(4.1)
}
\]
3-1-3(1)の水酸化ナトリウム溶液の空滴定での塩酸の滴下量をV1 mL、
4-1-1で乳酸溶液に加えた水酸化ナトリウム溶液の総量をVT mL、
4-1-3(3)の加水分解後の溶液の滴定に要した塩酸の滴下量をV2 mLとする。
はかり取った乳酸溶液中の総乳酸量wTLA gは次式で与えられる:
\[
\rm{
w_{TLA} = 0.09008 ~c_{HCl} \frac{V_1 V_T - 10.00 ~V_2}{10.00} ~~~(4.2)
}
\]
この式が成立することを示せ。
また最初にはかり取った乳酸溶液の質量 ws gと溶液の精確な濃度 P mass%(乳酸溶液の瓶に表記してある)から、
元の試薬の乳酸の総乳酸量の質量比100 wTLA/(P ws)を求めよ。
- 3-1-1(4)で乳酸溶液を中和するに要した水酸化ナトリウム溶液の滴下量をVX mLとする。
乳酸のカルボキシ基 COOH の内、エステル結合を形成せず遊離の形で存在しているものの比率 rF は次式で与えられる:
\[
r_{\rm{F}} = \rm{
\frac{V_1 ~V_X}{V_1 V_T - 10.00 ~V_2}
}~~~(4.3)
\]
この式が成立することを示し、元の試薬の総乳酸中のカルボキシ基の何%が縮合してエステル結合を形成しているかを求めよ。
また元の試薬中に、縮合していない乳酸は、総乳酸量の最大何mol%、最小何mol%存在すると考えられるか評価せよ。
<廃棄物処理>
指示薬の入っている溶液は指針Bに従って処理し、その他は指針Aに従って処理する。調製した0.2 mol/L塩酸は「4-3-1アルカリ度」で使用するので廃棄しないこと。
乳酸の分析のはなし
ちょっと歯ごたえのある課題として、
乳酸の分析の課題を最初に用意しています。
上記テキストにもあるように、乳酸は縮合して種々のオリゴマーを作るのですが、
実は、市販試薬の乳酸中では、オリゴマーと言っても無水乳酸(ラクチル乳酸とも呼ばれます)までと思ってよいのです。
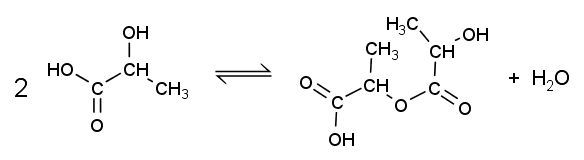
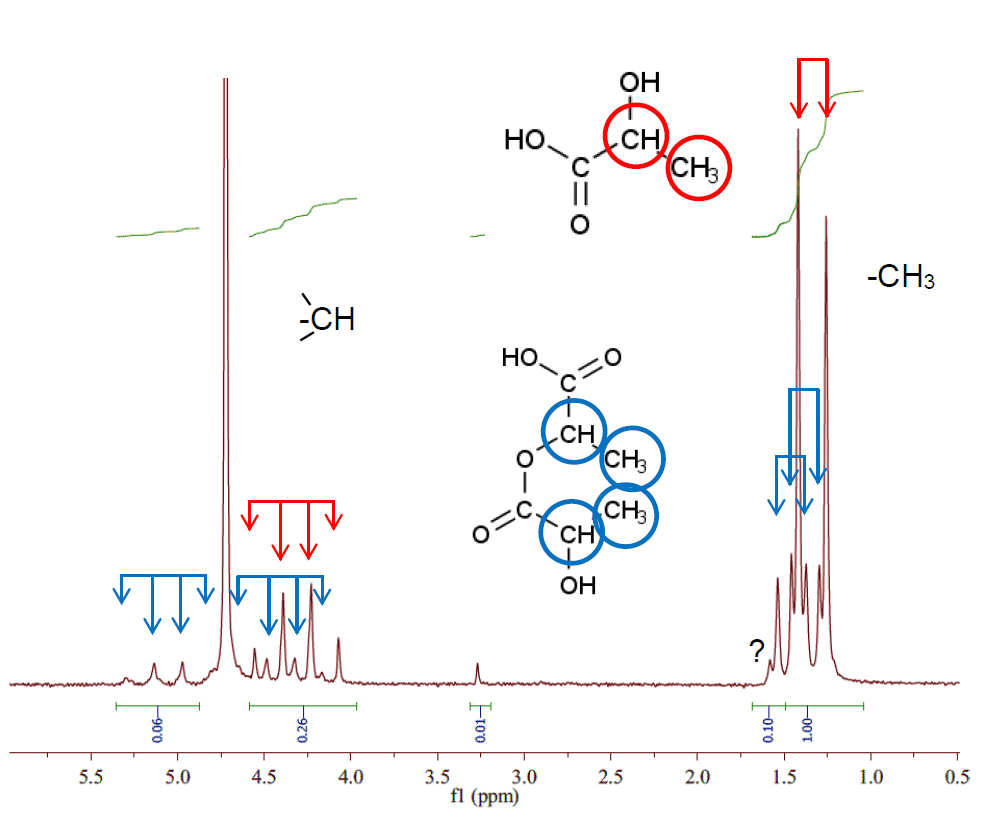
図 A には実際に H-nmr を取ってみた結果を示しました
(7年ほど前、ご厚意で Spinsolve のdemo 機を貸していただいたときに取ったものです)。
若干三量体なりがあるかもしれませんが、ほぼ乳酸モノマーと無水乳酸で
nmr スペクトルが説明できます。
|
|
|
|
図 A. 乳酸の H-nmr。
43 MHz の装置(Spinsolve)を使用。
ほぼ乳酸モノマーと二量体(無水乳酸)の混合物として、
スペクトルは解釈できる(J = 7 Hz)。
? を付けたピークは三量体等に由来すると思われる。
|
|
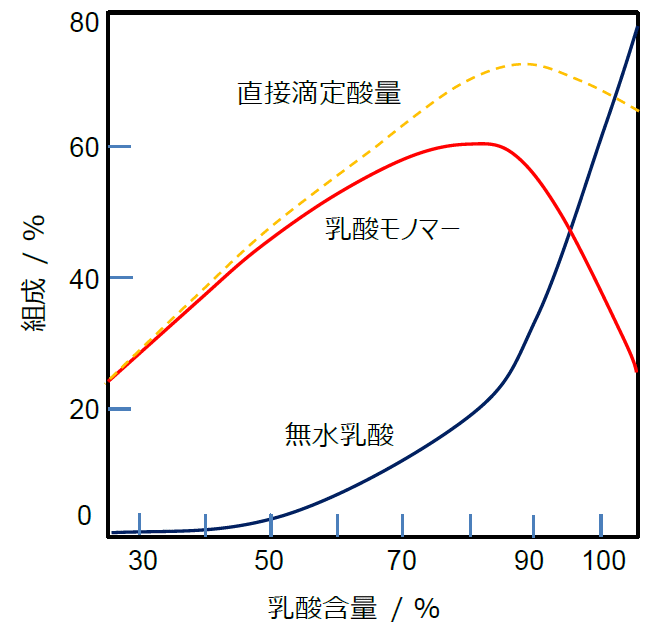
図 B. 室温での乳酸中のモノマーと二量体(無水乳酸)の平衡組成の乳酸含量(水分を除いた含量)依存性。
質量分率で表示してあり、無水乳酸(MW 162.14)は乳酸(MW 90.08)の質量に換算してある。
実験ではベンゼンやトルエンを入れ共沸を利用して水分を取り除いていて、脱水縮合が進んだ結果、
乳酸含量が 100 %以上にもなっている。
(P. D. Watson, Ind. Eng. Chem. 32, 399 (1940) 所載の図から作成)
|
このことは古くから研究されていて、
乳酸の含量が増加(含水量が減少)するにつれ、平衡が無水乳酸側に移動していきます。
図 B には今回の実験と同様の手法で、平衡状態での組成を調べた研究結果を示します
(P. D. Watson, Ind. Eng. Chem. 32, 399 (1940) )。
図 B で「直接滴定酸量 directly titratable acidity」とされているのは、
今回の実験で言う遊離酸量、オリゴマーの加水分解などせず、
そのままアルカリで滴定してえた乳酸量ということです。
平衡状態では乳酸含量 90 %ぐらいだと4割くらいが無水乳酸になっていて、
そのため酸の含量としては、(0.6 + 0.4/2) × 0.9 = 0.7、70 %という数字になっているわけです。
なお室温ではこの平衡に至るには、数週間ぐらいかかるようです。
実際にぼくが、市販の乳酸の50 %希釈液を調製して、調製当日に分析した結果と、3日後の分析結果を下表に示します。
3日目の結果で元の試薬中の総乳酸量は変化していませんが、
遊離酸比 rF(これに乳酸含量をかけたものが、図 Bの直接滴定酸量)が若干増えていることが分かります。
市販乳酸を50 %希釈後の分析値の変化
| 総乳酸 / % | 遊離酸比 / % |
| 希釈当日 | 91.0 | 78.6 |
| 3日後 | 90.9 | 79.9 |
実験の手法
乳酸 CH3CH(OH)COOH をカルボキシ基の H と水酸基の OH に注目して HLOH と略記します。
すると、オリゴマーの生成は次のように線状オリゴマー(含モノマー)と環状オリゴマーの場合に整理できます:
線状オリゴマー:
n HLOH → HLnOH + (n - 1) H2O
環状オリゴマー(ラクチド等):
n HLOH → Ln + n H2O
線状オリゴマーはカルボキシ基を持ち、酸としてふるまいますが(「遊離酸」)、
環状オリゴマー(あったとして少量ですが)の方はそのままでは中性物質です。
ただしいずれも過剰の水酸化物イオンと加熱処理すれば加水分解(広義には酸塩基反応)され、
乳酸塩を与えます。
ですから直接水酸化ナトリウム溶液で滴定すると線状オリゴマーが定量にかかり、
水酸化ナトリウムを過剰に加え加水分解をして、
水酸化ナトリウムの過剰量を塩酸なりで滴定すれば、総乳酸量が求められることになります。

|

|

|
|
使用するナカライテスク製の乳酸。
隠れて見えないが総乳酸量は JIS 規格通り
85.0 ~ 92.0 %と記されています。
|
こんな感じで、
希釈した試料が右のスポイトと一緒に化学天秤の横に用意されています。
たいてい実験当日の午前中に希釈、調製するので、
無水乳酸の加水分解はさほど進行していません。
|
直接滴定
実験ではまず 0.2 mol/L 水酸化ナトリウム溶液を用いて、フェノールフタレインを指示薬に直接中和滴定します。
これで遊離酸量、つまり線状オリゴマーの物質量をえることができます:
HLnOH + NaOH → NaLnOH + H2O
加水分解
滴定終点に達したのち、さらに一定量の水酸化ナトリウムを加えて水浴(湯浴)中で加熱、加水分解します。
加水分解が完全に進んだ状態では、次のような反応が進行します:
HLnOH + n NaOH → n NaLOH + H2O
Ln + n NaOH → n NaLOH
アルカリ性の溶液を30分(あるいはそれ以上)置いておくわけですから、
空気中の二酸化炭素をあまり吸わないように、ラップをしておく必要があります。
ビーカー内の空気には触れていると心配する人がいたりしますが、
外気とビーカー内の空気の入れ替えが頻繁に起きなければよいのです。
空気中の二酸化炭素濃度を 0.03 vol%程度とすれば、
100 mL の空気中の二酸化炭素は 1 × 10-6 mol 程度です。
今回の滴定では総量が 0.2 mol/L × 10 mL = 0.002 mol 程度で、
その1/1000、2 × 10-6 mol まで定量するわけですが、ちょっとそこまで届きません。
ただし外気が盛んに出入りする状態になって、1 L近い空気と接したりするとこれは問題です。
調製した水酸化ナトリウム溶液をアルカリ用試薬瓶に入れず、ビーカーに入れたままにしておいたりしても、
同様の問題があります。
加水分解にどれくらいの時間が必要かですが、
おそらく10分も加熱すれば十分です。
けれどもこの待ち時間の間に行うことにしている標定操作などがあるので、
JIS K8726 に合わせて 30 分にとっています。
なおこの加熱操作に時間をかけすぎると、
まれにフェノールフタレインの赤色が消えてしまうことがあります。
これはフェノールフタレインの退色反応と呼ばれるもので(pH が高すぎると水酸化物イオンの付加や分解反応が起きる)、
その時は滴定前に指示薬を追加します。

|
水浴(湯浴)には一人鍋用の電気鍋を使用しています。
ビーカーの中の液はフェノールフタレインの入ったアルカリ性溶液。
いわばイチゴジュースです。
4つ入るのでお湯があふれることがあり、入れる湯は少なめで。
なお白い発泡スチロールのビーズは、面倒なら入れなくてもいいですが、水の蒸発を防ぐために入れています。
取り出す時にビーカーに付いて、取ろうとしても「濡れ手に粟」状態になるので、
用意してあるザルに水道の水を使って洗い流すようにしてもらっています。
|
塩酸の標定

BPB 指示薬の色。
左から pH 1、pH 4.5、pH 4.0、pH 10。
pH 4.0 の灰青色となった時を滴定終点とする。
加水分解の間に、ビュレットに入れる溶液を 0.2 mol/L の塩酸に入れ替え、
0.1 mol/L の炭酸ナトリウム標準溶液を滴定し、
塩酸の標定を行います。
炭酸ナトリウムは前もって 200~250 °C ぐらいの真空乾燥器で数時間乾燥させておきます
(ここは流儀のあるところです)。
Na2CO3 + 2HCl → 2 NaCl + H2O + CO2
滴定指示薬にはメチルオレンジ(MO)、ブロモフェノールブルー(BPB)どちらでもよいということにしています。
メチルオレンジはたぶん高校でも出会うので、ぼくは BPB 押しです(JIS も BPB 押し)。
指示薬としてフェノールフタレインを使ったりすると、
所定の半量、CO32- + HCl → HCO3- で終わるので要注意。
この滴定では炭酸ガスが発生するので、
終点近くなったら軽く煮沸して炭酸ガスを追い出すというのが一般に行われます。
灰青色の溶液が、加熱していると色が戻って青くなるのは見ていて面白いところです。
この操作でだいたい 0.1~0.2 mL ぐらい滴定値が増えるようです。
なお初心の内は、操作の際に溶液をこぼしたり、
ビュレットから滴定液が滴り落ちていたりといったトラブルが起きがちなもの。
それで以前はこの操作をオプションにしたこともあるのですが、
そんなに手間でもないので現行では標準の手法に従っています。
逆滴定と乳酸量の決定
標定した塩酸を使って、まず水酸化ナトリウム溶液の滴定を行い、
水酸化ナトリウム溶液の濃度を決めます。
次いで水酸化ナトリウム溶液を加えて加熱して乳酸のオリゴマーを加水分解した後の溶液を、
同じ塩酸で滴定して、残存する過剰の水酸化ナトリウム量を定めます。
オリゴマーになったものも含めた総乳酸量は、
加水分解前に加えた水酸化ナトリウムの量から、この過剰の水酸化ナトリウム量を差し引けば求まります。
遊離酸量の決定操作が入っていて、少し見通しが悪いかもしれませんが、
ここまでの話を、後の方から順に(いささかくどく)整理していくと次のようになります。
そう難しい定量操作ではないですが、
整理してみると(くどくやったこともあって)結構いろんな量が登場していることが分かります。
ここで登場した物理量は全部で14 あります。
- 最終的に得たい未知の量:2
総乳酸の物質量 nTLAと遊離酸の物質量 nF
- 未知の濃度:3
cNa2CO3、cNaOH、cHCl
- あらかじめ分かっている量:3
MNa2CO3、VM、VP
- 実験で得る値:6
wNa2CO3、V0、V1、V2、
VT、VX
物理量が全部で 14 あって、その内 5 つが未知で、
残りはモル質量やメスフラスコの容積など既知の量が 3 つ、
実際に実験で測定する、炭酸ナトリウムの秤量値や、滴定値などが 6 つ。
ここで上に示した独立な関係式が未知の物理量の数 5 つあり、
お話が閉じていることが確認できるでしょう。
またテキストにある式なども容易に導けると思います。
こうした「化学計算問題」について、話を聞いている分にはフムフムと思うのですが、
結構できる学生さんでも(特に理論に強そうな人)、
いざ計算しようとするとこんぐらかって訳が分からなくなるということがよくあります。
それはこの変数の多さにあるといってよいでしょう。
これは推理小説などでもよくある話。
容疑者が3人を超えてくると、証拠や証言などももつれてきて、
ぼくはたいてい作者の意のままに乗せられていくことにしています。
講義などで聞く話は、あらかじめ「料理」が済んでいて、
せいぜい変数が 3 つか4つくらいに落とし込まれいることが多く、
頭がそれに慣れ切っていると、こうした問題に出会ったとき「目まい」が起きるようです。
今回の程度なら「算数」で押し切れる問題ではありますが、
一度は丹念に、登場する諸量や関係式を追跡してみることをお薦めします。
実際にわれわれの出会うものごと、
化学に止まらず、人間関係などもしかりですが、
こうした多変数の世界です。
こうやって足腰を鍛えておけば、
少々のことでもたじろぐことなく対処できるのではないでしょうか・・・
縮合度の評価
先にも述べたように、実質的には乳酸モノマーと二量化した無水乳酸の混合物と考えてよいのですが、
もっと一般的に、線状オリゴマー HLnOH と 環状オリゴマー Ln の混合物と考えた時、
直接滴定から得られる遊離酸量 AF と、逆滴定から得られる総乳酸量 AT から、
どのような情報が得られるか、整理してみましょう。
分子種 X の物質量を m(X) で表すことにします。
すると遊離酸量と総乳酸量は、
オリゴマーの物質量で次のように表されます:
AF = Σ m(HLnOH)
AT = Σ n [m(HLnOH) + m(Ln)]
ここで Σ は n についての和をとります。
さてここで縮合していないモノマーの物質量 m(HLOH) に注目すると、
AF と AT について、次の不等式が成立します:
AT ≥ - m(HLOH) + Σ 2 m(HLnOH) = - m(HLOH) + 2AF
また m(HLOH) は AF より小さいですから、
モノマーの量について整理すると、次の不等式を得ます:
2AF - AT ≤ m(HLOH) ≤ AF
総乳酸量 AT に占める、縮合していない乳酸の比率 rMは
2 rF - 1 ≤ rM ≤ rF
という条件で与えられます。
rF = 0.8 であれば、0.6 ≤ rM ≤ 0.8。
つまりオリゴマーが無水乳酸だけであれば rM = 0.6、
ラクチドなど環状オリゴマーだけなら rM = 0.8 というわけです。
最初にも触れたように、実際上はほとんど無水乳酸だけなのですが、
そうした知識をひとまず置いて一般化してみると、こういう結果が得られるというわけです。
乳酸の分析の課題のこと
市販の乳酸にかなりの量の無水乳酸(ラクチル乳酸)が存在し、
それを分析するのに逆滴定の手法が使用されていることを知ったのは、
2回生の実験の課題にポリ乳酸を入れたらどうかと検討していたころでした。
ポリ乳酸の課題は日の目を見なかったのですが、
実際に使用されている酸塩基滴定を用いる分析手法として強く印象に残りました。
それがそれから数年して2015年度に「容量分析の初歩」の課題を改定する際に、
生きることになったわけです。
2014年度まで容量分析の初歩の課題は、
教養の基礎化学実験を履修していない学生向けの簡易なコース(食酢の酸量の決定)と、
履修した学生向けのコース(セスキ炭酸ナトリウムの示差滴定。
指示薬の変色域を利用して炭酸 CO32-と炭酸水素 HCO3- の定量を行う)
を選択制で実施していました。
しかし基礎化学実験の履修/未履修と無関係に選択が行われているようで
(簡易なコースに偏る傾向はありましたが、それでも難しい方に挑戦してみようという学生は半分ぐらいいました)、
選択制にする意味はほとんどないようでした。
むしろ調製した溶液を使い果たすまで滴定するといった、安易に滴定を重ねる傾向が危惧されました
(N 回やると誤差は1/√N というのは、独立で同じ確率分布に従う場合 iid の話)。
そこで一回の滴定で結果を出すという、ちょっと緊張感のある、縮合重合という化学的にも興味ある課題を最初に持ってきた方がよいのではないかと考え、
乳酸の分析の課題を採用したわけです。
乳酸の分析の手法
ここで採用した手法は JIS K8726に規定されている分析法(JIS では総乳酸量のみ)を参考に、
学生実験向けに遊離酸量の実験を加えアレンジしたものです。
JIS では使用する水などの純度への規定が厳しいのは無論、
実験スケールが大きく、使用する酸・塩基の濃度も 1 Nです(JIS では硫酸を採用しています)。
これを90 %ぐらいの乳酸は少し粘度が高いので、扱いやすいように希釈して50 %で提供し、
硫酸は服に付いたりすると後が厄介なので塩酸に変え(なぜか薬学や農学系では硫酸が好まれるようです)、
酸・塩基濃度を 1/5 の 0.2 mol/L にしました。
また JIS で乳酸を 3.0 g(約 30 mmol)使用しているのを、50 % で 0.36 g(約 2 mmol)にしてあります。
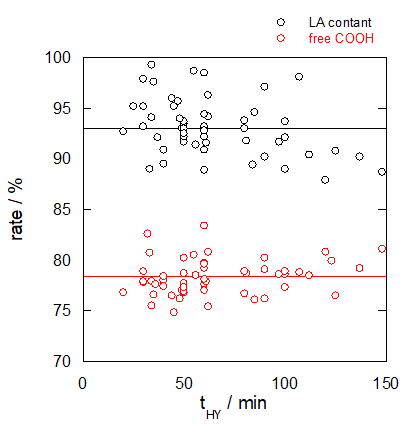
得られた総乳酸量 LA content と遊離酸比 free COOH の加水分解時間 t
HY 依存性(2015年度)。
JIS と大きく違うところは、遊離酸の定量操作を入れているところで、
このためビュレットに入れる溶液を途中で変更するという、
容量分析の原則からすると、いささか拙い操作になっています。
また乳酸に加える水酸化ナトリウム量を、ビュレットではかり取ることになっていて精度的に劣りますが、
直接滴定の操作を加えることで、逆滴定することの意義を明瞭にでき、教育的であると考えています。
このスケール変更で問題なのは、使用するアルカリの濃度を 0.2 mol/L と 1/5 にしたので、
加水分解が十分進むかどうかです。
実際に試してみたのですが加熱時間を2倍にしても結果は変わらず、
スケール変更に大きな問題はないものと判断しています。
また学生諸君の結果を、加熱時間に対してプロットしたものを示しますが(2015年度)、
えられた総乳酸量は加熱時間にほとんど依存せず、むしろ若干減るような傾向さえあるようでした
(もし時間が足りずに未反応の無水乳酸があるなら、加熱時間を延ばせば総乳酸量は増えるはず)。
この後の年度の実施結果でも、
加熱時間と総乳酸量の間には相関は認められていません。
実験結果と今後の課題
この5年の学生諸君の実験結果をまとめてみると、
表のようになります。
最初に取り組む実験とあってばらつきが大きく、
もっぱら中央値(メディアン)で眺めています。
各年度ごとの学生の出した総乳酸量と乳酸換算の遊離酸量の質量比(遊離酸量は、総乳酸量にテキストの遊離酸比 r
F をかけたもの)。
中央値は全学生のデータの中央値。
許容データは外れ値を除いたデータの割合(おおむね ±5 ポイント以上外れたものを外れ値とした)。
平均と標準偏差は外れ値を除いたものについてのもの。YY はぼくの実験値。
| 年度 | 中央値/% | 許容データ/% | (平均 ± 標準偏差)/% |
|---|
| 総乳酸 | 遊離酸 | 総乳酸 | 遊離酸 | 総乳酸 | 遊離酸 |
|---|
| 2015 | 93.0 | 72.0 | 83 | 86 | 93.1 ± 2.8 | 72.4 ± 2.0 |
| 2016 | 93.2 | 72.2 | 74 | 83 | 92.6 ± 2.5 | 72.4 ± 2.0 |
| 2017 | 92.5 | 73.0 | 80 | 80 | 92.8 ± 2.7 | 72.8 ± 2.2 |
| 2018 | 91.9 | 72.1 | 63 | 76 | 91.8 ± 2.8 | 71.8 ± 1.5 |
| 2019 | 93.8 | 72.5 | 62 | 78 | 94.0 ± 3.2 | 72.3 ± 2.0 |
| YY | 91.0 | 71.5 |
ぼくの実験結果では、使用した乳酸の総乳酸量は JIS 規格の85.0 ~ 92.0 % に収まっているのですが、
学生諸君のデータでは若干、総乳酸量が高めに出ていて、JIS 規格をはみ出すことになっています。
なぜ少し高めに出るのかはよく分かっていません。
塩酸の標定に問題があるかと、指示薬にメチルオレンジを使った人とブロモフェノールブルーを使った人で差があるか、
煮沸して二酸化炭素を追い出す操作の有無が影響するかなど、
いくつか可能性を探ってみたのですが、
いずれも特に結果との相関は認められませんでした。
この結果を見るとはっきりするのは、
2年前から、許容範囲を越える結果を出す学生が増加したことです。
加水分解操作を介さない遊離酸量の決定については、
目立った変化はないのですが、
ここ2年は加水分解・逆滴定を行う総乳酸量については、4割くらいが「落第点」という次第。
これは教養の基礎化学実験を履修しない学生が増えたのと軌を一にしています
(2017年までは基礎化学実験の履修者が8~9割いたのが、7割程度に減少)。
それでは基礎化学実験を履修していない学生が、
外れ値を出しているのか?
これも検討してみたのですが、
分割表を使った検討結果では相関は認められませんでした。
つまり基礎化学実験を履修していないから外れ値を出すというのではなく、
もっと根深い(そもそも基礎化学実験を履修しようとしない)ところに原因を見るべきなのでしょう。
「ちょっと歯ごたえのある課題」ということで設定したのですが、
いささか歯ごたえがありすぎるようで、
そろそろ考え直すべきところに来ているのかもしれません。
容量分析の初歩のページへ