
|

|
|
| 牛乳に塩酸(赤)を加えたものと、酢酸(青)を加えたもの。 酢酸を加えたものはすぐにカゼインの凝集が起きるが、 塩酸を加えたものでは凝集が認められない。 | 塩酸を加えた後、 水酸化カリウム溶液を加えて、pH を上げると凝集が起きる。 |
普通牛乳には100 gあたりおよそ110 mg程度のカルシウムが含まれている(日本食品標準成分表)とされている。 人間がカルシウムを摂取する上で牛乳が有効であるとされるのは、その含量の多さもさることながら、 その多くがカゼイン(酸性で凝析するタンパク質)と結合した状態で存在していて、 効率よく人体に吸収されるからである。 ここではキレート滴定法を用いて、カゼインを除いた牛乳(乳清。ホエー)中のカルシウムの定量を試み、カルシウムの溶存状態の一端に触れる。 同時に溶液中のコロイドの安定性についても検討する。
キレート滴定はキレート試薬を用いて金属イオンを定量する滴定法であり、錯滴定とも呼ばれる。 これは金属キレート化合物(金属多座配位子錯体)が安定であることを利用した滴定法である。 キレート試薬としてはEDTA(エチレンジアミン四酢酸)が最も広く用いられている。 牛乳にはマグネシウムも含まれており、pHを調節してマグネシウムを沈殿分離するなどして、 キレート滴定でマグネシウムとカルシウムを分離定量する手法もあるが、マグネシウム含量がカルシウムの1/10程度なので、 ここではカルシウムとマグネシウムの合量を、カルシウム量として扱うことにする。
牛乳に塩酸を加えてpHを下げ変性させた後、水酸化カリウムを加えてpHを上げてカゼインを凝析・分離した試料と、 酢酸を加えてカゼインを凝析・分離した試料とを用意する。 カゼインの等電点はpH 4.6程度で、pHが4.6程度になると凝析・分離が起きる。 なおここで凝析するカゼイン成分はいわゆるカッテージチーズと言われるものに相当する。
牛乳中にはカゼイン以外にもリン酸等が溶存し、カルシウムと錯体を形成している。 このため錯形成していないカルシウムとEDTAの反応が一端当量に達し、EBT指示薬が赤色から青色に変色しても、 錯体からのカルシウム溶出が起きる結果、徐々に赤色を呈するようになる(復色)。 このため精確な滴定値を得るのは困難である。ここではこの現象を確認し、おおまかな当量点を得る。 したがってホールピペットやビュレットを使用した精確な操作は必要ない。
(注1)Ca2+、Mg2+イオンが存在するとEBTとの錯形成により溶液は赤紫色を呈する。 EDTAとCa2+、Mg2+イオンとのキレートは無色で、 EBT -Ca2+、EBT -Mg2+錯体より安定である。資料編V-20 <金属指示薬>参照。。
試料溶液に過剰量のEDTAを加えてしばらく置き、種々の溶存状態のカルシウムとEDTAのキレート生成反応が完結した後、 過剰のEDTAの量を塩化亜鉛溶液で滴定することで、試料溶液中のカルシウム量を得る。 この滴定では、塩化亜鉛溶液の滴下とともに赤みが出現するところが滴定終点となることに注意する。
牛乳のカゼインの凝集は、カゼインの持つ電荷が中和されるpH(等電点)付近で起きる。 同様の現象は難溶性塩のコロイドでも見られ、塩化物イオンを硝酸銀溶液で滴定する沈殿滴定の終点判定にも利用されている(Fajans法)。 塩化銀の沈殿は塩化物イオンが過剰な状態では負に帯電し、銀イオンが過剰な状態では正に帯電することが知られている。 ここでは定性的なレベルで、塩化物イオンの溶液に硝酸銀溶液を滴下した時の塩化銀の沈殿の様相の変化と、 沈殿へのフルオレセインの吸着挙動の変化を調べる。
| 灰分 | g | 0.7 |
| 食塩相当量 | g | 0.1 |
| ナトリウム | mg | 41 |
| カリウム | mg | 150 |
| カルシウム | mg | 110 |
| マグネシウム | mg | 10 |
| リン | mg | 93 |
日本人に不足しがちなカルシウムを摂るには牛乳が一番というのはよく聞く話です。 ここではその牛乳中のカルシウムに注目してみました。 文科省の「食品データベース」にある、 日本食品標準成分表2015年版の「普通牛乳」の組成ではカルシウム含量は110 mg/100 gということになっています。 これに従うと、牛乳の密度をおよそ1.03 g cm-3として、カルシウム濃度は0.028 mol/L。 EDTA 0.01 mol/L溶液での滴定を想定すると、数倍に希釈すると適当な濃度になるようです。 またマグネシウムの含量はカルシウムの1 /10 程度。 河川や水道の水などのキレート滴定では pH を調節することでカルシウムとマグネシウムを分離して定量するというのが定番ですが (pH > 12 でマグネシウムが水酸化物として沈殿)、ここではあえて分離せず、カルシウム・マグネシウムの合量をカルシウムということで扱うことにしています。
上記テキストの分析操作に合わせていうと、 この牛乳の組成で問題になるのはリンの存在です。 実際にやってみてもらうことにしていますが、直接滴定すると、リン酸の塩の形で存在するカルシウムがだんだん溶け出してきて、 溶液が青くなり終点に達したと思っても、しばらくすると赤くなります。 これを防ぐために、メタスズ酸カリウムを加える手法もあるのですが(E.R. Ling, Analyst, 83, 179 (1958))、 廃液処理が面倒になるので、ここでは逆滴定を用いることにしています。 逆滴定には塩化亜鉛溶液ではなく、塩化カルシウムなどカルシウム塩の溶液を用いることが無論考えられるのですが、 終点がより明瞭だった塩化亜鉛溶液を採用することにしました (逆滴定でもリン酸の影響はあるようです。なおカルシウムとEDTA キレート生成定数は log K 10.7、亜鉛は log K 16.5 と亜鉛の方がはるかにキレートが安定)。
ここで分析の対象として想定しているのは、 通常飲む牛乳「成分無調整牛乳」で、 牛から搾乳した生乳を、ホモジナイズド処理(脂肪球を微細化してクリームが分離しないようにする)し、 殺菌したものが多数派です。 スーパーなどで見てみると、脂肪分を除いた「成分調整牛乳」、 あるいは脱脂粉乳やバターなどを加えた「加工乳」(いわゆる「特濃」など)、 などなどいろんな種類のものが並んでしますが、 いろいろ挑戦していただいて結構です。
この酸で凝固させたものはカード curd と呼ばれ(乳脂は大部分、カードと一緒に分離されるようです)、 カッテージチーズ(牛乳豆腐などとも呼ばれる)の原料です。 ここには牛乳のタンパク質の中でも、カゼインと呼ばれるものが含まれます (カゼインは脱脂乳を pH 4.6 にした時沈殿してくるタンパク質として定義されます)。 そしてカードを沈殿させ、残った清澄な溶液をホエイ(ホエー whey。乳清)と呼びます。
今回はホエイ中のカルシウム(とマグネシウム)について分析するわけですが、 カードにどれくらい残っているか気になります。 この点、酸処理することで、カゼインに含まれているカルシウムは大部分溶け出すことが知られています。 実際の研究例(今村・片岡・奥島, 日畜会報, 33, 344 (1962)。この研究では乳酸発酵させてカードを分離)を見てみると、 おおむねカードは元の牛乳から重さにして 2 ~ 3 %ぐらい取れ、 含まれているカルシウム含量は元の牛乳の 1 %程度。 多くのカルシウムは溶液中(ホエイ)に溶け出して、 牛乳中のカルシウム量を評価する上では、 大きな問題になりません。 実際ぼくの予備実験の結果では、おおむね牛乳パックの成分表示と一致した結果になりました (実験ではカルシウムとマグネシウムの合量なので、1割程度少なめということになりますが、 カードの洗浄の際のロスなど考えると、許容範囲でしょう)。
酸性にすると牛乳が固まるのは、 ヨーグルトでも見られるところです。 ヨーグルトでは乳酸発酵の結果 pH が下がり、カゼインが凝集します。 カゼインの等電点(電荷が釣り合って中性になる pH)は 4.6 付近にあり、 これより pH が高ければ負に、低ければ正に帯電して、 分散状態が安定になるためとして理解できます。 今回の実験でも塩酸を加えて、pH を 1 ぐらいまで大きく下げても凝集が起きないことから、 このことは確かめられるでしょう。

|

|
|
| 牛乳に塩酸(赤)を加えたものと、酢酸(青)を加えたもの。 酢酸を加えたものはすぐにカゼインの凝集が起きるが、 塩酸を加えたものでは凝集が認められない。 | 塩酸を加えた後、 水酸化カリウム溶液を加えて、pH を上げると凝集が起きる。 |
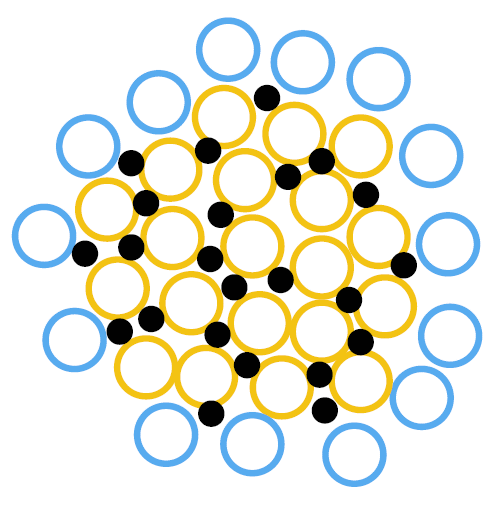 カゼインミセルの構造の概念図。
リン酸カルシウムの微結晶(黒丸)で橋掛けされた、αs-、β-カゼインを多く含むサブミセル(橙色の丸)が、
κ-カゼインで保護されたサブミセル(青い丸)に外側を取り囲まれて、安定化している。
カゼインミセルの構造の概念図。
リン酸カルシウムの微結晶(黒丸)で橋掛けされた、αs-、β-カゼインを多く含むサブミセル(橙色の丸)が、
κ-カゼインで保護されたサブミセル(青い丸)に外側を取り囲まれて、安定化している。
カゼインの分散状態の安定性については、 等電点でざっくり扱えるような問題以外にもカゼインの構造的な問題も深くかかわっています。 カゼインは何種類かのタンパク質でできているのですが、その中で κ-カゼインと呼ばれるものが、 分散状態を安定化させる上で重要な役割を担っていています( κ-カゼインは高濃度の塩化カルシウム溶液(0.4 M)でも沈殿しない)。 チーズを作る時には、もっぱら発酵させてチーズを固めるわけですが、 この発酵の際にκ-カゼインが分解され、カゼインが不安定化して凝固します (この時に使用される酵素は、主に牛の胃から得られるレンネット rennet (主要成分はキモシン)と呼ばれるもの)。
通常の状態ではカゼインには、カルシウムがリン酸と結合した形で多量に含まれています。 ほ乳類のミルクの研究によると、 種によってミルク中のカルシウム濃度は大きく異なり、 ウサギは牛の5倍 500 mg/100 g 超もあるようで、 一方ヒトは27 mg/ 100 g(「食品データベース」)と、牛乳の1/4しかありません。 この大きなカルシウム量の違いは、 それぞれの種の成長にともなうカルシウムの必要量と関わるわけですが、 それぞれミルク中のカゼイン量のちがいに対応していることが知られていて(カルシウムが多いほどカゼインも多い)、 カゼインと結合したカルシウムは効率よく体内に取り込まれます (健康食品と売られているCPP(カゼインホスホペプチド)はこのことに注目したもの)。 牛乳の中のカルシウムは、かなりの量がカゼインと結合して存在し (カゼイン中のセリンの水酸基がリン酸エスエルになっていて、 右図のようにリン酸カルシウムのクラスターと結合するイメージ。 αs-カゼインでは200個ぐらいの構成アミノ酸中、10個ぐらいがセリンリン酸になっている)、 このことでカゼインの集合体(ミセル)が形態を保っているようです。 ですからEDTA を加えてカルシウムをキレートにして除くと、 カゼインのミセルが崩れて凝集が起きるもののようです。
このようにカルシウムを多く含むカゼインですが、 今回のように酸を用いてカードを作った場合には、 先にも触れたように、カゼインに含まれるカルシウムは大部分溶出してきます。 これは pH が下がって、リン酸カルシウムが溶けるためと考えられます。 実験では酢酸の場合、塩酸の場合についてやってもらうことにしていますが、 どちらでもえられるカルシウム量は大差ないでしょう。 一方、発酵させてκ-カゼインを分解して作ったカード(これを加工してチーズにする)には、 カルシウムが多量に含まれます (酸で凝集させるカテージチーズではカルシウム含量が 55 mg/100 gに対し、ゴーダチーズでは680 mg/100 g。 ハードタイプのエメンタールチーズ(チーズフォンデュに使われる)に至っては 1200 mg/100 gということになっています)。
新年度のテキストも出来上がった3月半ば、新型コロナ COVID-19の問題で急遽、実験の実施方法の検討、課題内容の見直しが始まりました。 取り合えず実施開始を5月の連休明けにすることになり(その後、通年化し9月実施へ)、方針がだいたい決まったのは4月の初旬。 収容人数を半分にしたり、2人組の実験(従来の化学実験ではほぼ9割の課題が2人組の実験)を単独実験にしたりせよというわけです。 従来の実施課題を間引いて行うことも考えられたのですが、 容量分析の「環境水の分析」関連の課題は、分割して実施するのは無理があり、急遽、 キレート滴定を中心とする、沈殿滴定も視野に入れたコンパクトな課題を設計することにしました。
いろいろ考えたのですが、比較的身近で、学生諸君にも関心を持ってもらえそうな対象として、牛乳を取り上げることにしました。 たぶん多くの大学の初歩の分析化学実験、特に農学部あたりでは取り上げられていると思うのですが、 ぼくの目に止まったのは同仁化学の「身近なもののCa、Mgを調べてみよう」のページでした。 紹介されているカゼインの酸沈殿法は少し物足りないが、候補となりえると思われました。
同仁化学のページの手法を参考に、 取りあえずのインストラクションを作り、 担当の奥山さん、山本さんと一緒にやってみました。 すると EDTA を滴下して赤から青くなり、終点に達したと思ってしばらくすると、 すぐに復色して赤くなってしまうのです。 タンパク質が悪さしてるんだろうという程度でその場は終えたのですが、 昔見た上野景平「キレート滴定法」(南江堂)に、カルシウムの妨害物質にリン酸が挙げられていたことを薄く思い出し、 あわてて図書室から借り出して見てみると(改訂版1972)、 リン酸の妨害について詳述してありました。 また最後の10章 応用実例の項の最後に牛乳が取り上げられており、 同仁化学のページの手法は、 これに沿ったもののようです(上野景平さんは、同仁化学の創業者でもある)。
他に調べてみたところでは、 牛乳にそのまま緩衝溶液、あるいは水酸化カリウム溶液を加えて pH を調整し、 金属指示薬を加えて EDTA で滴定するという手法もありました (H.A. Ntailianas and R. McL. Whitney, J. Dairy Sci. 46, 1335 (1963))。 これは簡単で、実際、この手法で学生実験などを行っているところもあるようです。 けれども白濁する中での滴定はいささかやりずらいので(たぶんこのためにリン酸による復色が問題にならない)、 タンパク質などを酸で凝固させて取り除いた後、 清澄な溶液(ホエイ)についてカルシウム・マグネシウムのキレート滴定を行うという、 同仁化学のページの手法 に沿った形で実験を設計することにしました。
カゼインを凝集(カードの分離)させるところは、 R. Jennes, Anal. Chem. 25, 966 (1953) にほぼ従っています。 ただしカゼインの凝集を Jennes はメスフラスコ中で行い、 カゼインの沈殿も含めて 100 mL に定容するようにしているのですが、 これをビーカーで行い、 凝集したカゼインをキッチンペーパーで漉しとることにしました。 カゼインの容積の分、濃度が高め目に出るというのもありますが、 メスフラスコ中で操作した場合、フラスコが乳脂で水をはじくようになることを心配したからです。 またカゼインからのカルシウムの溶出の様子を確認するのに、 酢酸でのカゼインの分離も並行して行ってもらうようにしました。
なお時間の関係もあって、 pH を12 ぐらいに高く設定してカルシウムを、 pH 10 程度でカルシウムとマグネシウムの合量を求めるという標準的な手法を、 カルシウム・マグネシウムの合量のみに絞ることにしました。 ここはいささか悩んだところです。 pH を高くしてカルシウムのみに注目することも考えたのですが、 マグネシウム濃度が低いこともあって、 結局、高濃度の水酸化カリウム溶液の使用を避け、 カルシウムとマグネシウムの合量の決定で良しとすることにしました。
海外ではISOに滴定法を謳った規格がありました(ISO 12081”Milk — determination of calcium content — Titration method”)。 内容の詳細はともかく(本気でやるなら数千円で規格を購入する必要がある・・・)、 preview を見ると、 トリクロロ酢酸でタンパクを変性沈殿させ除去した後、カルシウムをシュウ酸カルシウムとして沈殿させ遠心分離。 過マンガン酸カリウムで滴定という手順を踏んでいます。 前処理は違いますが、 日本の公定法と同様、シュウ酸カルシウムとして沈殿分離させて、過マンガン酸滴定という流れです (食文化の違いを反映してか、日本のJISには対応する規格がありません)。