|
|
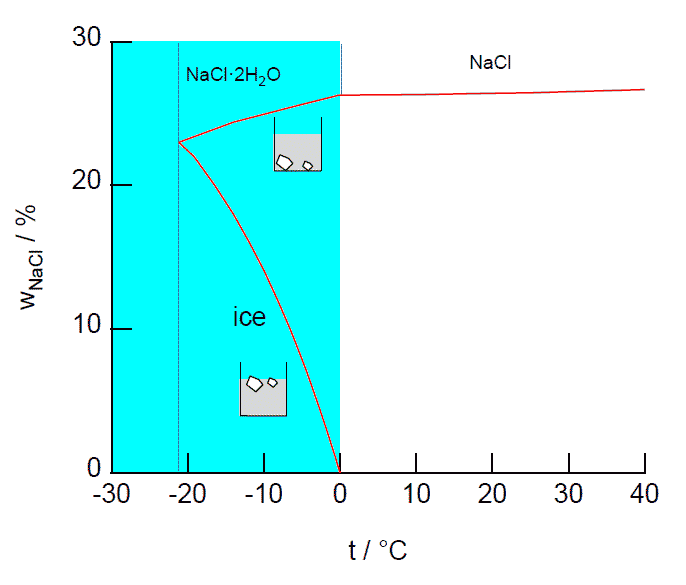
図1.
塩化ナトリウムと氷の溶解度曲線
|
この課題ではまず物質の融解・溶解挙動について扱います。 融解と溶解は共に固体が液体になる現象であり、 大学では両者を統一的に眺める視点から話がなされます。 けれども意外に、 そうした視点の重要性についての認識が不足しているように思われるので、 最初に融解・溶解についての、 大学までの話と、大学からの話の違いを紹介しておきましょう。
図1 には塩化ナトリウムの溶解度曲線を示しました (縦軸には塩化ナトリウムの質量分率 wNaCl を取っています)。 水に対する種々の物質の溶解度の温度依存性など、 小学校でも学ぶところです。 けれども高校までの段階では、0 °C 以上(100 °C 以下)の溶解度曲線しか登場せず、 図 1 の水色で示した 0 °C 以下の領域は直接出てきません。 大学ではこの 0 °C 以下の溶解度曲線も扱うようになります。
0 °C 以上の領域では、水と塩化ナトリウムは ”対等” の関係ではなく、 水は溶け込まれる立場、 塩化ナトリウムは溶け込む立場でした。 けれども 0 °C 以下の領域では、 今度は水(固体の水なので以下「氷」とします)が溶解することを考えることになり、 「氷の溶解度曲線」が登場します (縦軸が塩化ナトリウムの質量分率 wNaCl なので、 温度を下げて wNaCl が増加することは、 氷の溶解度の減少に対応します)。 塩化ナトリウムを溶かす時は、 溶液の底に沈んだ塩化ナトリウムを溶かすわけですが、 氷を溶かす時には、 溶液に浮かんだ氷を溶かす格好です。 この氷の溶解について、 高校段階では溶解度ではなく、「凝固点降下」として登場します。 塩化ナトリウム溶液の凝固点は氷が析出してくる温度、 つまり氷が飽和する温度であり、 凝固点降下は、溶解度という立場から言うと、 温度低下にともなって氷の溶解度が減少することに相当しています。
ここで注意したいのは、 「塩が水に溶ける」と言いますが、 「塩が氷に溶ける」あるいは 「氷が塩に溶ける」というのも、 間違いとまでは言えないということです。 実際、道路が凍結した時、融雪剤として食塩を使うのは(塩化カルシウムの方が、融雪剤としては多いでしょうが)、 氷を塩に(で)溶(融)かしているわけです。 われわれは凍ったり融けたりする現象を見ると、 そこに至る「ものがたり」を期待しがちです。 けれども、結局のところ、溶液とどういう固体が共存しているかといった観点からは、 溶液ができるまでの過程でどんな状態を経るかは問題ではありません。 溶解度曲線や相図から見えるのは、そうした醒めた立場に立ったものになります。
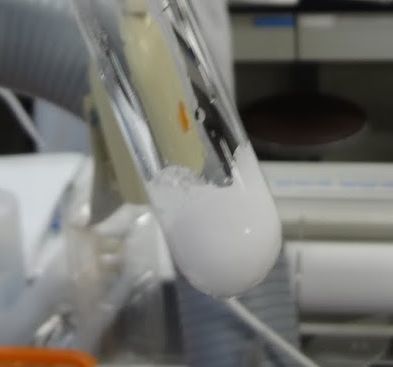
0 °C 以下の領域でもう一つ注目したいのは、 0 °C 付近(0.2 °C )で、 塩化ナトリウムが水和塩 NaCl·2H2O になることです (臭化ナトリウム NaBr は室温で水和塩 NaBr·2H2O が安定です (50.7 °C 以上で無水物になる))。 実際、飽和食塩水をフリーザーに入れて冷やすと、 室温で見ている無水塩と様子の違う、 図2 のようなシャリシャリした水和結晶が析出してきます。 この水和塩 NaCl·2H2O の溶解度曲線の勾配が、 0 °C 以上の無水塩の溶解度曲線の勾配より大きいことに注意します。 これは水和塩の生成が発熱的であるため(ルシャトリエの原理から温度を下げると水和塩になる)、 無水塩に比べて溶解の際の吸熱量が大きく、 温度依存性が大きくなるためです。
さて、氷の溶解度曲線と塩化ナトリウム(二水塩)の溶解度曲線は、 温度を下げていくと接近し、塩化ナトリウムの質量分率が 23 %、温度 -21 °C のところで交わります。 この温度以下では溶液が消失し、氷と塩化ナトリウム(二水塩)、 2種類の固体が共存する領域に入ります。 つまり -21 °C は、氷と塩化ナトリウム(二水塩)と溶液、 3相が共存する点で、共融点(共晶点)eutectic point (この場合は特に氷晶点 cryohydrate point とも)と呼ばれます。
塩と氷で作る寒剤は、 この共融挙動を利用しています。 固体の塩と氷が溶液抜きで共存できるのは -21 °C 以下ですから、 固体の塩と 0 °C の氷を混ぜると、 融けて溶液を作ります。 この時氷が(断熱的に)融けると大きな熱の吸収が起きて温度が下がり、 固体の塩と氷がまだ融けずに残っているなら、 固体の塩と氷と溶液が共存できる温度 -21 °C まで温度が下がり続けるわけです (寒剤を作る際、塩と氷の混合比を精確に共融組成にする必要はありません)。 なおやってみると、途中で塩の様子が変化してくるように感じられると思いますが、 これは二水塩ができてくるためです。
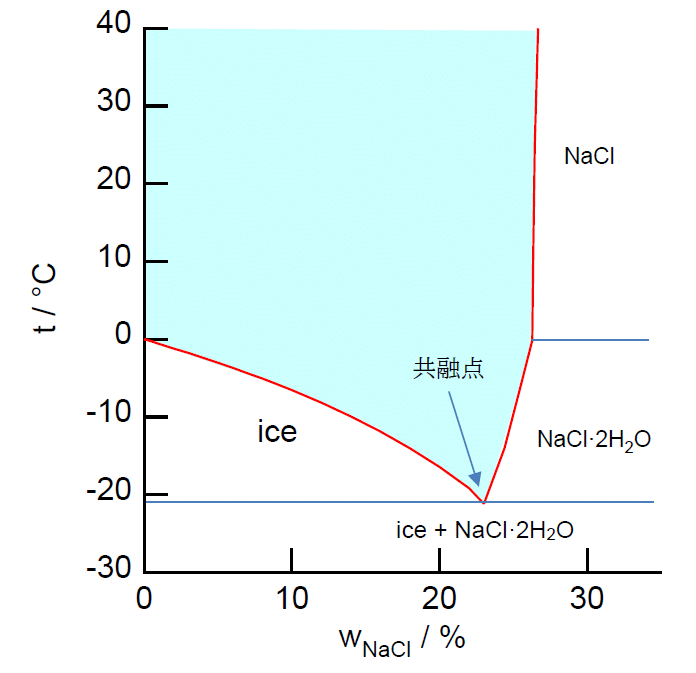
このように氷の溶解度曲線が加わってくると、 図3a のように横軸と縦軸を入れ替え、 横軸に組成(質量分率あるいはモル分率)、 縦軸に温度を取った方が見通しがよくなります。 温度の関数ではなく、組成の関数として事態を眺めようというわけです。 図の水色で示した領域は1相(溶液相)で存在できる領域、 それ以外は2相に分離する領域を示しています( wNaCl = 0、 wNaCl = 1 は、 それぞれ純粋な氷、塩化ナトリウムで1相ですが、組成の幅がほとんどありません)。 大学で勉強するちょっと専門的な本では、 おおむねこうした形式を採用していて、 相図(材料系では状態図)phase diagram と呼ばれます。
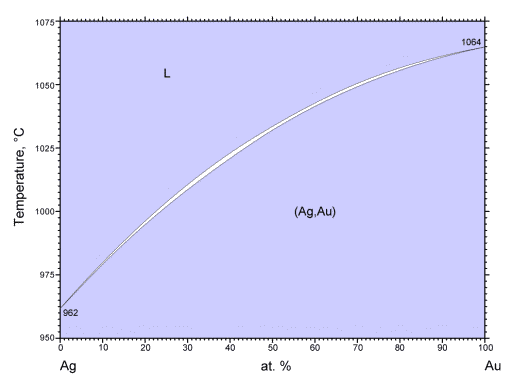
固体同士の溶解・融解の場合には、 この実験で扱うナフタレン-ビフェニル系のように、 たいていの場合共融現象が現れます。 これは固体同士がなかなか溶けあわない、 固溶体が形成されるケースがあまりないためです。 固体同士が融け合わないのは、 一般に固体では多数の分子が秩序だった構造(結晶)を作っているため、 そこに異なる分子を挿入すると、 多くの分子の関わる再秩序化が必要になることが多く、 大きなエネルギーが必要になるためとして理解されます。 ですから溶解現象で期待されるような任意の比での混合よりは、 塩化ナトリウムの水和結晶 NaCl·2H2O の場合のように、 異なる分子同士が組み合わさって、 まったく新しい秩序だった構造を形成することが多いのです。 ただしよく似通った分子同士の場合には固溶体を形成する場合があり、 図3b に示す金と銀の相図は、その数少ない例になります。 金と銀は固体でも交じり合って固溶体を作り、 銀の凝固点降下は現れませんし、 共融点も現れません。 こうした相図は、液体の混合物の蒸留の場合(気液平衡)によく見られるところです。
|
|
| 図3a. 塩化ナトリウム-水の相図(大学ではこちらが主流)。 水色で塗ったところは1相の領域。 | 図3b. 金と銀の相図(物材機構AtomWork (参照: 2021.11.1))。 全組成で固溶体を作る例。 白く細い三日月状の領域が2相の領域 |
|
| 図4. ナフタレン (a) とビフェニル (b) |
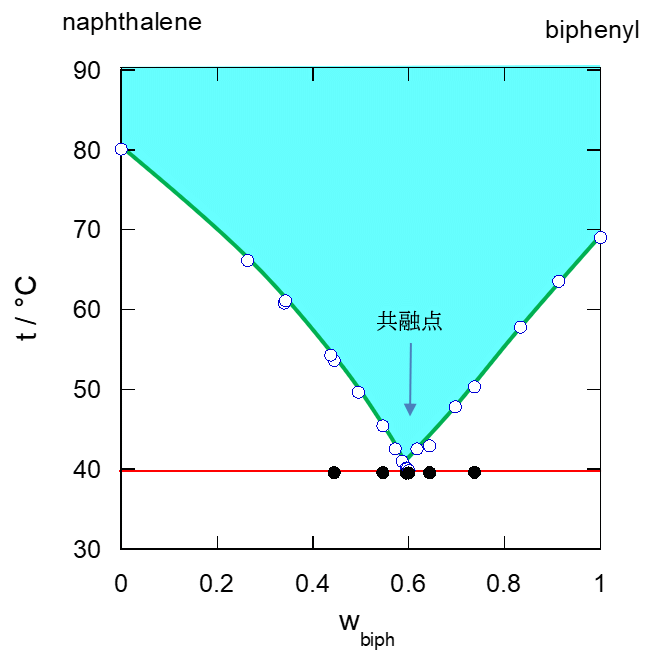
ナフタレンとビフェニルは固溶体を作らず、 液体状態では溶けあいます。 ですから先に見た、塩化ナトリウムと水のように、 共融挙動を示し、 図5a のような相図が得られることが知られています。 共融点は約 40 °Cでナフタレンの質量分率 40 %(モル分率 44 %)のところにあります。 ナフタレンの質量分率 40 %であれば、ちょっと温め(ぬるめ)の風呂の温度で完全に融けるわけです。
実験ではまずナフタレン(mp 80.2 °C)とビフェニル(mp 68.9 °C)を試験管に入れ、 温水に浸して融けるかどうかを見てもらいます。 50 °C ぐらいの、 お茶を淹れるには温めの湯をビーカーに汲んでもらって (実験室にあるガスの瞬間湯沸かし器(最近は見かけなくなりました)を使ってもらえばいいでしょう)、 観察してもらいます。 それぞれ単独では融けませんが、 試験管を取り出して、 ナフタレンとビフェニルを混ぜてもう一度浸けてもらうと、 図5b のようにドロドロと融けてきます。 けれども完全に透明な液体にはならないでしょう (湯温が高いと透明になることがあります)。
図5a の相図から、質量分率 50 % だと、約50 °C で固化が始まることが分かります。 最初ビーカーに汲んだ湯温が50 °C だとしても、 この頃には少し冷めて 45 °C ぐらいになっているでしょう。 45 °C では一部ナフタレンが析出し、 液相のナフタレンの組成は質量分率 45 %(wbipn = 0.55)ぐらいになります。 この時、析出するナフタレンはどれぐらいでしょうか? 「算数」の問題ですが、少し問題を一般化して、A と B の2成分系を考え、 A の質量分率 w1 の混合物を質量 m1 と、 質量分率 w2 の混合物を質量 m2 を混合して、 質量分率 w の混合物を m1 + m2 得たとしましょう。 この時、混合前後で含まれる A の質量は同じですから、次の関係が成り立ちます。
w1 m1 + w2 w2 = w (m1 + m2) (1)
m1/m2 = (w2 - w)/(w - w1) (2)
50 % の溶液から、100 % のナフタレンの固体と、45 % の溶液ができるので、 この (2) の関係式(「てこの法則」lever rule と呼ばれるものです)から、 (0.45 - 0.50)/(0.45 - 1.00) = 1/11 で、 ナフタレンの固体の質量は液体の 1/11 です。 ですから図5b のように9割方液体で、 そこに固体が少し入っているような状況になるわけです。 さらに温度を下げちょうど共融点に達した時には(液体中のナフタレンの質量分率 40 %)、 ナフタレンの固体の質量は液体の 1/6 になります。 共融点より温度を下げようとすると、今度はビフェニルの固体の析出が始まります。 ナフタレンとビフェニルの固体が同時に析出してくるわけですが、 ナフタレンの固体が析出する近傍では液体中のビフェニルの濃度が上がってビフェニルの固体、 ビフェニルの固体が析出する近傍では液体中のナフタレンの濃度が上がってナフタレンの固体の析出が促進されます。 この結果、ナフタレン、ビフェニルそれぞれの結晶からなる相が入り組んだ構造が生まれます。 ナフタレン-ビフェニル系でどうなっているかぼくは知らないのですが、 よく見られるのは、図5c に示すような層状構造です (こうした構造を共晶組織(共晶構造、共析組織などとも)と呼び、 材料科学ではよく研究されています)。
固体の混合物を分離、精製するのに、 再結晶法が利用されます。 けれどもナフタレンとビフェニルのような場合は、 少々溶媒を変えても溶解度が似かよっていて、 析出してくる固体が共晶組織を持つようになります。 図5d には今回のナフタレンとビフェニルの混合物をメタノールに溶かし、 冷却して固体が析出してきたところですが、 それぞれの結晶をここから分離することは、 実際的には不可能です。 この実験では、 ナフタレンがピクリン酸と安定な結晶を作ることを利用して、 それを分離してやろうというわけです。
|

|

|
|
| 図5a ナフタレン-ビフェニル系の相図。横軸はビフェニルの質量分率 wbipn。 (Lee らの実験結果から作成) | 図5b ナフタレンとビフェニルの固体の混合物の融解。 ビーカーに入れた湯に試験管を浸けています。 | 図5c 典型的な共晶組織。 それぞれの成分の結晶の薄い層からなるラメラ構造。 | 図5d メタノール溶液から析出したナフタレンとビフェニル混合物。 |
ピクリン酸は芳香族炭化水素と安定な結晶性の分子間化合物を作り、 伝統的にピクレート(ピクラート)picrate と呼ばれています (現在はナフタレン-ピクリン酸錯体などと呼ばれるようになっていますが、ここではピクレートで通します)。 同様の分子間化合物は、 トリニトロベンゼンなども作ることが知られており、 ナフタレンがカチオン、ピクリン酸がアニオンになっているわけではないので、 冷静に考えてみればピクレート(ピクリン酸塩)というのは不適切な名称です。 けれども実際にナフタレンとピクリン酸を混合して、 ピクレートが析出してくる様子を見たら、 なぜ ”ピクレート” と呼ばれたかが分かってもらえるでしょう。 かつて融点測定が物質同定の重要な手法であった時代には、 ピクレートにすることは物質を結晶化する重要な手法の一つでした。 以前の有機化学の実験書(~1970)には種々の物質の融点の表が付いていて、 アミンとピクリン酸の塩と同じように、 芳香族炭化水素のピクレートも掲載されていたものでした (実際のところ見た目にはそう変わりません)。
|
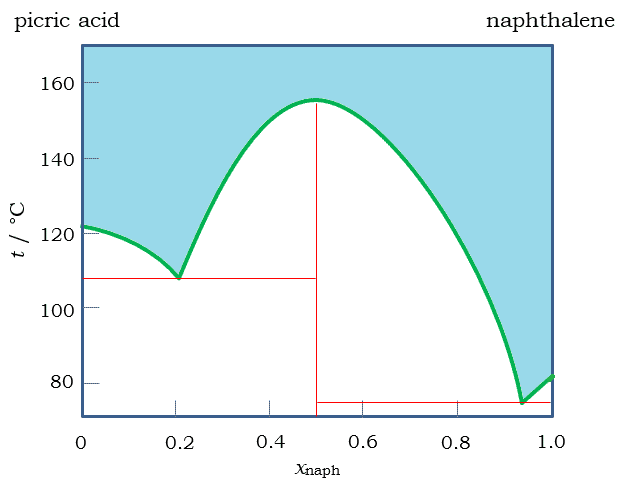
| 図7 ピクリン酸-ナフタレン系の相図。 横軸はナフタレンのモル分率 xnaph (Shukla らの論文から作成) |
今日的にはナフタレンのピクレートは、 電子供与性のナフタレンと電子吸引性のピクリン酸との、 電荷移動(CT)相互作用(あるいは電子供与受容(EDA)相互作用)の結果として整理されています。 ナフタレンとピクリン酸の電荷移動相互作用は10 kJ/mol 程度の大きさと考えられ、 水素結合より弱いものですが、 結晶の安定性には大きな役割を果たします。 図7 にはピクリン酸とナフタレンの相図を示します。 モル分率 0.5 (ナフタレンの質量分率 36 %)のところで、 1:1 の分子間化合物(ピクレート)が生成します。 ピクレートとナフタレンの共融組成は、ナフタレン過剰の領域では、 ナフタレンのモル分率が 0.94(質量分率 0.90)です。 ナフタレンのモル分率が 0.94 以下の液体では、 析出してくるのはピクレートか共融混合物というわけです。
ピクリン酸は芳香族炭化水素と電荷移動相互作用するというわけですが、 それがただちに安定な分子間化合物の結晶の生成につながるわけではありません。 たとえばたいていの芳香族炭化水素のピクレートは 1:1 の分子間化合物ですが、 1:2、2:1、2:3 といった組成のものなども知られています。 あるいはナフタレンより強い電荷移動相互作用をするアントラセンのピクレートの溶解度は大きく、 ナフタレンピクレートほど安定ではありません。 今回の実験で登場するビフェニルも、 ベンゼン環が2個あって電荷移動相互作用は弱くないはずですが、 安定なピクレートを作りません。 ナフタレンピクレートの結晶では、 ナフタレンとピクリン酸が交互に積み重なった構造を取ってはいるものの、 かなり乱れた結晶構造になっています (ピクリン酸はもっぱら分子内水素結合を作るようです)。 実際に結晶を作るにあたっては、 分子のパッキングや水素結合による安定化など、 種々の要素を考えないといけないのです。
ナフタレンがピクレートを作ることを利用して、 ナフタレンとビフェニルの混合物から、 それぞれの成分を単離する実験操作は、 原理的には分かりやすいものだと思います。 けれども実際にやってみると、 意外に骨が折れるでしょう。 何よりすべてがピクリン酸の色に染まって黄色くなっていきます。 ですから試験管等にラベルやマーカーを付けて、 取り違えが起きないようにすることが大切です。 またピクリン酸は染料として用いられ、 手に付いたりすると、 黄色がなかなか取れないので注意しましょう。 なお爆薬としても有名ですが(”下瀬火薬”)、 通常の取り扱いでは、それ自体は爆発するものではありません (ただし油断は禁物。 鉄の塩などは不安定とされる。 市販されている試薬は、安全のため水分を20 % 程度含んでいる)。
ピクリン酸のメタノール溶液にナフタレンとビフェニルの混合溶液を加えると、 ナフタレンピクレートの結晶が析出してきます (実験の指定の分量であれば、量論的にはナフタレン 1.2 mmol に対しピクリン酸を 1.7 mmol 加えることになっています)。 ナフタレンピクレートの結晶は針状で嵩高く、 往々にして溶液が結晶に取り込まれ、図9b のように固結します。 ここから結晶と溶液を分離するのですが、 吸引ろ過によるのがよいようです。 図9c のように先に紹介したミニろ過器を使えばよいのですが、 結晶が嵩高いので、容量の大きい(5 mL)ろ過器がよいでしょう。 結晶を取り出す時はスパチュラ等で攪拌し、 懸濁した状態にしてから漉過するのがスムーズです (ポリスポイトの先を切って懸濁液を吸い込み、ミニろ過器に移すのがお薦め)。
得られたピクレートは、 一度再結晶して精製してもらいます。 以前はこの再結晶操作を入れていなかったのですが、 付着した溶液の除去が十分でないためか、最終得られるナフタレンの純度が低くでる傾向にありました。 そこでピクレートの再結晶は比較的容易なので、 再結晶操作を入れることにしたのです。 これでかなり成績は向上しました。
なおナフタレンピクレートの結晶から、 ビフェニルの入った溶液を分取するのに、 以前、スポイトを使った手法を採用したこともあります。 この手法はスポイトの先端を試験管の底にあてがい、 スポイトの先と試験管の底面のすき間で漉過を行います。 ポンプなど使わず、ろ液を得るには簡単便利な方法なのですが、 ピクレートに付着した溶液の液切りが不十分になりがちで、 現在はあまりお薦めしていません。 無論、挑戦してみたい人はやってみてもらって構いません。

|
|

|

|

|
| 図9a 析出してきたナフタレンピクレート。 | 図9b 溶液を含んでが固結したナフタレンピクレート。 | 図9c ミニろ過器でナフタレンピクレートを分取し、 溶液を取る。 | 図9d ナフタレンピクレートをメタノールに加熱溶解し、再結晶で精製。 | 図9e ナフタレンピクレートの結晶(マイクロスコープによる)。 |
ピクレートとして芳香族炭化水素を分離するメリットは、 結晶になりやすいというのは無論、 アンモニア水等で中和することで、 ピクリン酸がアニオンとなって溶出し、容易にピクレートが分解、 水に不溶性の芳香族炭化水素を回収できることです。 ここでもアンモニア水(1 N = 1 mol/L。 5 mL は 5 mmol 相当でピクリン酸を中和するには十分) を用いて、ピクレートを分解し、 疎水性のナフタレンを回収します。 メタノールに溶けているビフェニル(溶液 A)の回収には、 水を加えるだけでもよいのですが、 溶存しているナフタレンピクレートを分解し、 ピクリン酸の吸着を防ぐために、 ピクレートと条件を揃えてアンモニア水を加える設定にしています。
それぞれ、溶液にアンモニア水を加えると、 微細なナフタレンあるいはビフェニルの結晶が析出し、 乳濁した黄色い溶液が得られます。 これら乳濁液を冷やして漉過し、ナフタレン、ビフェニルの結晶を得ることもできますが、 結晶が微細でしばしば目詰まりを起こします。 そこで一旦、湯浴中でそれぞれの融点以上に加熱して(図10b)微細な結晶を融かして融合させ、 結晶粒を大きくする操作を加えています。 図10b ではわかりやすいようにビーカーで加熱していますが、 電気鍋を使ってもらうのが簡単でしょう。 なおナフタレンの試験管か、ビフェニルの試験管か、 マーカーやラベルを付けて、 取り違えがないようにしましょう (図10b では、白いマーカーが付いているのが確かビフェニルのはず)。 ここの操作で注意すべきは、 湯浴の温度が上がり過ぎると、突沸が起きる危険があることです (メタノールが入っているので、水の量にもよりますが 90 °C ぐらいになれば沸騰する可能性がある)。 温度は 80 °C 程度にもなればよいので、あまりグラグラ煮るのはよくありません。
しばらく加熱したら、 冷やして結晶を析出させ、 結晶を漉過して分取します。 得られたナフタレン、ビフェニルそれぞれの量に余裕があるようなら、 再結晶してもらえばよいでしょう。 メタノールを少量加え、加熱して溶解した後、 水を滴下して溶解度を下げてから冷却して、 結晶を出すのがよいでしょう。 けれどもピクレートと違って、ナフタレン、ビフェニルは溶解度が大きく、 かなり苦戦することになるので、 自信がなければスキップするのが賢明かもしれません。

|

|
|

|

|
| 図10a アンモニア水を加えると乳濁する。 | 図10b 微結晶を融解し、液滴を融合させる。 すべてが黄色くなり、取り違えに注意! | 図10c 得られたナフタレン、ビフェニルを漉過して回収する。 | 図10d 最終分離されたナフタレン(上)とビフェニル(下)。 ビフェニルの方はピクリン酸の色が少し残っている。 | 図10e 分離・採取したナフタレン(上段)とビフェニル(下段)の結晶(マイクロスコープによる) |
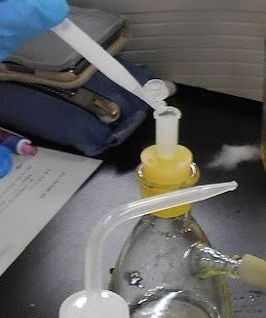
ナフタレンとビフェニルを、どの程度うまく分離できたかは、 高速液体クロマトグラフィー(HPLC = High Performance (Pressure) Liquid Chromatography)で調べます (ちなみに「クロマトグラフィー」というのは手法、 「クロマトグラフ」は装置、「クロマトグラム」は結果のチャート)。 ぼくが学生時分、HPLC はようやく普及し始めた頃で、 何かとトラブルの話を聞かされたものでした。 それが今では化学ではあって当然の装置になり、 ベンゼンの重水素置換体(アイソトポマー isotopomer)の分離ができるようなものまで登場するご時世になりました。 ここでは技術の詳細はともかく、 取りあえず触ってみてもらえばいいでしょう。 図 12a のように、試料溶液を注入しノブを回せば、 後は機械がやってくれます。 この時の注意点は、十分奥まで注射器(マイクロシリンジ)の針を押し込むこと。 中途半端にやると、サンプルループに試料溶液が入らないで、 空打ちになってしまうことがあります。
HPLC ではカラムに ”吸着剤” を詰めて試料を吸着させ、 そこに液体(溶離液 eluent)を流して、 どの程度液体を流したら試料が流れ出してくるかを調べます。 今回の装置では試料の検出に光吸収を用いています。 またテキストにあるように、 使っている ”吸着剤” は表面に油が付いている(オクタデシルシリル ODS 基)と思えばよく、 油に溶けやすい(疎水性の)ものほど、流れ出してくるのに時間がかかります (逆相クロマト)。 今回の場合ビフェニルの方がナフタレンより、 有機液体に溶けやすいので、ナフタレンの方が早く出てきます (予習チェックにもありますが、 logP値(水と1-オクタノール間の分配係数の常用対数)は大まかな予測を与えてくれます)。
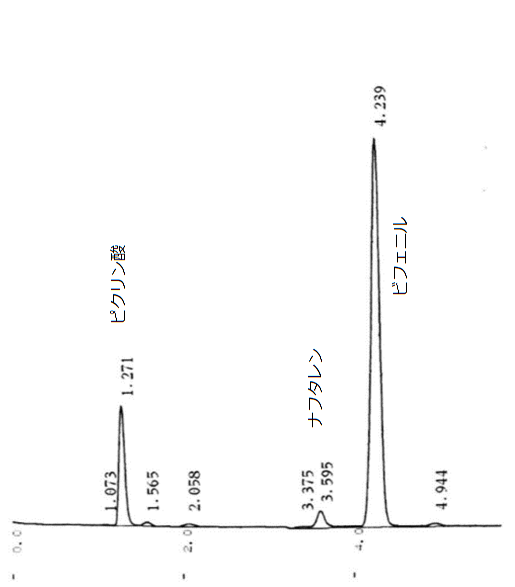
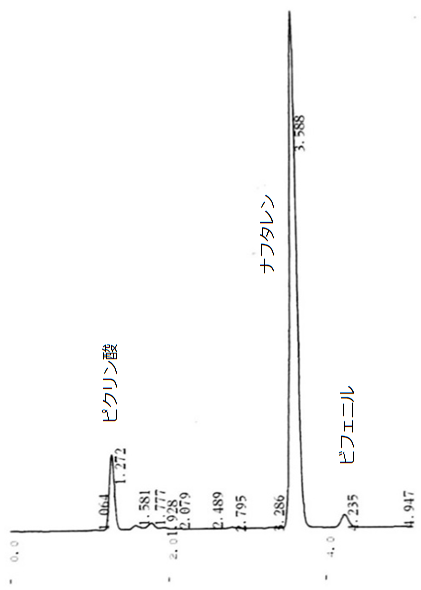
図12c と図12d に、それぞれビフェニル、ナフタレンの試料のクロマトグラムを示します。 溶離液はメタノールと水の混合液(メタノールの体積分率 90 %)で、 流速は 1.0 mL/min。 検出に用いているのは、260 nm の紫外部の吸収です。 横軸は時間で単位は分、縦軸は光吸収の度合(吸光度)になっています。 ビフェニルが 4 分 15 秒、ナフタレンが 3 分 35 秒ぐらいに出てきていて、 それぞれの分離は予定通りうまくいっていたようです。 ただし 1 分 15 秒ぐらいにピクリン酸と思われるピークが出ていて、 得られた結晶の洗浄等に問題を残したというところでしょうか。 でも初心者としては十分な成績です。
なお HPLC では(というか液体クロマトグラフィー一般で)、溶離液の選択が非常に重要です。 図 12d には溶離液に 100 % メタノールを使用して、 ナフタレンとビフェニルの混合物の分離を見たクロマトグラムを示しますが、 ビフェニルとナフタレンの分離はよくありません。 この実験を設計するにあたって、 金森さんに教えていただいて、 種々の比率のメタノール-水混合液で分離の様子をチェックしました。 水の比率を上げると、分離は良くなるのですが、 今度は出てくるまでの時間(保持時間)がどんどん長くなります。 たとえばメタノールの体積分率 80 % では、 流速 1.0 mL/min での保持時間がビフェニル 8 分 30 秒、ナフタレン 6 分 10 秒 で 2 分以上ちがうのですが (90 % メタノールの結果と比べて、相対的にも分離はよくなっています)、 結果が出るのに 10 分近く待ってもらうことになります。 専門的には 20 分ぐらいが普通なんですが、 学生実験ではさばく ”お客さん” が多いので、待ち時間は 5 分がいいところです。 というわけで 90 % メタノールを採用しています。

|
|
|

|
| 図12a HPLC への試料溶液の注入。 | 図12b 分離・回収したビフェニルのクロマトグラム | 図12c 分離・回収したナフタレンのクロマトグラム | 図12d 溶離液にメタノールを用いた場合のクロマトグラム (流速 0.70 mL/min)。 |