
|

|

|

|

|

|
| 図1a ベンガラの懸濁液。 | 図1b ろ過します。 | 図1c 初回のろ液。 | 図1d 再度ろ過したろ液。 | 図1e キッチンペーパーを2重にしてろ過したろ液。 | 図1f ろ過後の一層目と二層目のキッチンペーパー。 |
ろ過は、身近な分離操作ですが、なかなかに複雑な内実を持っています。 小学校ではろ過の際に、ろ紙は4つ折りにし、ロートに密着させるように教わります。 でもなぜそうしないといけないのでしょう。4つ折りにして密着させたら、液が流れにくくなってしまうではないですか? 何でもないことのようですが、意外にこうした疑問に答えてくれる記述は教科書に見当たりません。 この実験ではろ過に関わって、小学校の時に学ぶような事項も含め、実際に確認してもらうことにしています。
化学で出会うろ過には、大きく、ゆっくり時間をかけてろ過する場合と、速やかにろ過する場合とがあります。 ゆっくり時間をかけるのは、ろ液を必要とする場合が多く、速やかにろ過するのは、懸濁物・固形物を必要とする場合が多いようです。 あくまでも大まかな分類ですが、ゆっくりろ過するのは漢字では「濾す(こす)」、 速やかにろ過するのは「漉す(こす)」という文字を充てるのが適当でしょう(ろ過を「沪過」と書かれることもありますが、 「沪」は「濾」の異体字で現在中国では「滬」の簡体字として使用されています(滬は上海の呉淞江の下流)。 英語では filtration と straining という言葉が充てられます(オイルの配管にゴミを除くストレイナー strainer というパーツがあることをご存じの方も多いでしょう)。 ともに懸濁液から浮遊物・固形物を除く操作ですが、性格には大きな差があります。
ここではゆっくり時間をかけるろ過の場合を「濾過(ろか)」とし、 速やかにろ過する場合を、「漉過(ろっか。ろくか)」と呼ぶことにします。 (辞書(広辞苑)には「漉過」は「濾過」と同義となっていたりしますが、区別してこの用語を用いることにします。 カタカナを使って「漉過」を「ストレインろ過」と呼んでもいいかもしれませんが、 strainには「歪」という意味もあり、避けることにします)。 ペーパーフィルターを使ってコーヒーを淹れるのは濾過、 茹でたそうめんをザルで湯切りするのは漉過と思っていただければよいでしょう。
ゆっくり時間をかけるろ過の場合(以下「濾過」と表記します)、 おおまかに言って、かける圧力に比例して濾過される液の流速は増加します(ダルシーの法則)。 つまり摩擦力が流速に比例すると思えばよいのです。 けれどもこれはろ紙への沈殿物の付着が同程度の場合の話で、 化学実験で出会う濾過操作では、濾過するにしたがって沈殿物(専門的にはケーキ cake(工業的には「濾塊」や「濾滓」などとも)と呼ばれるようです)がろ紙に付着して、 濾過速度、透過する粒子サイズが大きく変化します。 こうした濾過操作を「ケーキ濾過 cake filtration」と呼びます。
ケーキ濾過がどういうものか、 以前、キッチンペーパー(ペーパータオル)を使って濾過する実験をしていたことがありました。 キッチンペーパーは、トイレットペーパーとちがい水に”溶けず”、 ティッシュペーパーなどのように芳香剤など含まないので、 入門化学実験では多用しています (何か溶け出してこないか3種類ほどキッチンペーパーを水に浸け、 電気伝導度などチェックしたことがありますが問題ありませんでした)。
ケーキ濾過の実験では、図1a のような水中に懸濁しているベンガラ(酸化鉄(III) Fe2O3の粉末を濾過します (現行の実験でもベンガラは使用しています。 他に研磨剤に使用する石英砂も用意していましたが、白色で目立たないのであまり評判がよくなかったです)。 1回の濾過では、図 1c に示すようにベンガラが漏れ出てきますが、 濾過を繰り返すと、図 1d に示すように清澄な溶液になります。 この繰り返しの際に、「同じろ紙を使う」のがポイントです。 ケーキろ過では、沈殿自体がろ過に働きます。ろ過を繰り返すことでより緻密なケーキ層(濾過層)が形成され、ベンガラの微小な粒子が効率的に取り除かれるのです。 実験してみると濾過するにつれ、濾過速度が遅くなり、 ケーキが形成されることで微小な粒子が捕捉されるようになるのが実感できます。
単純にろ紙(キッチンペーパー)を「5 μm以上の粒子を通さないフィルター」のように捉えていたのでは、 2度通したところで何の効果もないはずですが、 ケーキ濾過の効果で微細な粒子も捕捉されます。 つまりこのろ過の最初の段階では、取りあえず大きな粒子を捕捉する「漉過 straining」のような状態でケーキが形成され、 フィルターの目が細かくなって「濾過」に移行したというわけです。
では2度目も新しいろ紙を使って濾過する、 あるいはそもそもろ紙を2重にしたらどうでしょう? 単純にケーキ濾過の効果だけ考えると何に効果もなさそうです。 図1e には実際にキッチンペーパーを2重に重ねて得た濾液を示します。 ケーキのできたキッチンペーパーを利用した図 1d のようにはいきません。 しかし1度の濾過よりベンガラの粒子は除かれています。 実際、図1f に見るように2重に重ねた2枚目のキッチンペーパーにも、 ベンガラが付着しています。 これは流れていく途中で、粒子が紙の繊維に「絡め取られる」効果が働くため、 あるサイズ以上の懸濁物を篩で除去するというより、すき間の多い(あるいは多孔性の)物体を通過する間に、 いわば“確率論的”に懸濁物が除かれていくという描像になります。 こうしたろ過のメカニズムは、深層ろ過 depth filtration(「深度ろ過」とも)と呼ばれます。 深層濾過は身近なところでいうと、浄水場で砂の層を通して原水中の懸濁物を取り除く「ろ過池」で大規模に利用されています。

|

|

|

|

|

|
| 図1a ベンガラの懸濁液。 | 図1b ろ過します。 | 図1c 初回のろ液。 | 図1d 再度ろ過したろ液。 | 図1e キッチンペーパーを2重にしてろ過したろ液。 | 図1f ろ過後の一層目と二層目のキッチンペーパー。 |
この実験はケーキ濾過でろ液がより清澄になっていくことを実感しやすいのですが、 キッチンペーパーの種類によっては、かなりろ過を繰り返さないとうまくいかないことがあります。 またそもそも余り学生さんの興味を引かないので、 現在はテキストから外しています。 けれども、こうしたろ過に関わる知見は化学実験を遂行する上で、 また家庭での料理から大規模な生産現場、廃棄物処理にいたるまで極めて重要です。 できれば自分たちでいろいろ試してみてもらいたいところです。
通常のろ紙には、ツルツルした面とザラザラした面があります。 これはコピー用紙なども同様で、 紙を梳く際に、パルプを梳きとる網と接する側の面は、表面の細かいパルプの繊維が流されてザラザラになり、 網と接しない側の面は細かいパルプの繊維が残ってツルツルになるのです (ろ過する際、ザラザラした面をろ液側にすると、 細かい繊維が出てきてろ液に混入すると思っている人がいたりしますが、 むしろ細かい繊維をあらかじめ洗い流してあるわけです)。 ろ過の際には、 ツルツルした面をろ過する液の方に向けるのが原則です。 ツルツルした面の方が緻密で、ザラザラした面に比べて、ケーキ層の形成が起こりやすいので濾過に有利です。 また漉過で沈殿を分取することを考えると、 ツルツルした面の方が、ろ紙に入り込む沈殿の量が少なく、沈殿を分け取るのに有利です。
小学校でも習うように、通常、化学の分析化学の実験などでは、 濾過の際、(1) ろ紙は4つ折りにし、(2) ロートに密着させるようにします。 高校段階まででは、あまり注意されることがないようですが、 このような操作が有効なのは、溶液が水溶液で、ろ紙の直径がおよそ15 cmぐらいまでの場合です。 この「教科書的」な濾過操作の写真を図2a に示します (スピルリナパウダーの懸濁液を濾過して、フィコシアニンの溶液を得ているところ)。
ここで一番のポイントは、ロートの足(脚)がろ液で満たされていることです。 ケーキろ過では、ろ紙上の沈殿物の層にかかる圧力差(圧力勾配)に比例して流速が大きくなる考えられます(ダルシーの法則)。 濾過する際にろ紙の作る円錐になみなみと液を満たした方が、ろ液は速く出てきます。 これはろ紙上の沈殿物の層にかかる圧力が、水位の分だけ大きくなるためです。 ロートの足に水がたまっておれば、圧力勾配はさらに大きく拡大します。 ロートの足の長さが 5 cmぐらいだとしても、ろ紙上の沈殿の厚みが 0.5 mm程度だとすると、 10 cm の長さのカラムに1 atm程度(1 mH2O。水柱にして10 m)の圧力をかけたことに相当します。
さてロートの足に液を保持するには、上方から空気が入ってこないように、 ろ紙がロートに密着していて、 すき間が 0.1 mm 程度ぐらいになっている必要があります (0.1 mmぐらいあれば流量は十分確保でき、 このすき間の大きさは表面張力の大きさで決まってきます)。 ここで問題になるのは、4つ折りにした時に、ひだができることです。 そこでひだを伝って空気が入ってこないように、図2b のようにろ紙を少し切り欠いて、 空気の侵入経路を遮断するのも、一般によく行われる技法です。 またロートがよく水に濡れることも重要です。 水をはじくロートは困りもので、 クレンザーなどで前もって足の部分も含め、洗浄を確実に行っておく必要があります。
あまりロートの足の長さに注目されることがないようですが、 通常のロートの足は図 3a のように、 およそ口径と同じ程度の長さになっています、 けれども、上方からの空気の侵入を防げるならば、 濾過の効率を考えるとロートの足は長い方がいいわけです。 実際に図 3b に示すような足長のロートは JIS にも規定があり(JIS R3503。「長脚漏斗」)、 市販もされています(いささかお高い。JIS では口径によらず足の長さは 150 mm になっている)。 また図 3c のように、通常のロートの足にゴム管でガラス管をつないで延ばすことも行われたりします。 このように足を長くする以外にも、図 3d に示すようにロートの足をループ状にして、 足に入り込んだ泡をトラップするような仕掛けを施す工夫もあります (ぼくも一度見たことがあります)。 ただし足が長かったり、複雑な形状をしていると洗浄しにくく、 また破損しやすいので、ちょっと考えものです。
さてロートの足に液を保持することの効用、 保持するための技法を並べてきたのですが、 ロートの足に液を保持するには、 溶液の表面張力が十分大きくないといけません。 実際にやってみると、たいていの有機溶媒では表面張力が小さすぎて、ロートの足に液を保持することは困難で、 この手法は有機溶媒ではうまくいきません (多くの有機溶媒の表面張力は 30 mN/m 以下で、水の表面張力 70 mN/m の半分にもならない)。 あるいは処理する溶液量が多くなり、 ろ紙、ロートのサイズが大きくなると、 ロートの足に水柱を保持するのは困難になります。
ロートの足に液を保持できないとなれば、 そもそもろ紙をロートに密着させる必要はなく、 こうした局面で登場するのが図2d に示すひだ折りろ紙です。 実際、有機溶媒を多用する有機化学の実験では、ろ紙は4つ折りにせず、ひだ折りろ紙として使用するのが一般です。 4つ折りのろ紙では、 図1f にも見るように、 ろ紙の面の半分しか利用できませんが、 ひだ折りろ紙だと全面を利用できるようになります。 ただしロートの足の ”吸引力” が利用できず、 ろ紙内の液面が低下するとそれに比例して沈殿層にかかる圧力差が低下し、 溶液を補給して液面の高さを維持していないと、濾過速度は急速に低下していきます。 もっとも多くの有機溶媒は水より粘度が低く、 水溶液に比べると加圧の必要性は大きくありません。
このひだ折りろ紙の折り方には、 いろいろ流儀がありますが、 ぼくはひだを1つ1つ、折って開く操作を繰り返し、 図2d のように、16 の山と谷を作るタイプを好みます。 もっと効率的な折り方を推奨する(あるいは 8 つの山と谷で済ます)向きもありますが、 ぼくはこの折り紙の作業は、 昔の職人さんが煙草を一服する時間を大事にしたように、 実験中の余裕のひと時として大事にしたいと思っています。
| 図4 ロートの足をビーカーの器壁に付けるのは、 主として液滴生成にともなう抵抗を減らし、 濾過速度を上げるため |
なお図2a もそうですが、 小学校の教科書などでも濾過の際、 図4のようにロートの足の先を器壁に付けておくように指示されています。 これは濾液が飛び散らないための配慮でもありますが、 液滴が生成する際の表面張力による影響を打ち消すのが主目的といってよいでしょう。 先端の液滴の半径を r、表面張力を γ とすると 2 γ /r 程度、水柱を押し上げる圧力が働きます。 水の表面張力は 70 mN/m 程度なので、 入門化学実験で使っている口径 45 mm 程度のロートだと、 ロートの足の直径は 7 mm 程度で、この圧力は 50 Pa、5 mmH2O 程度です。 ロートの足の長さの1割程度でそう大きいものではありませんが、こうした抵抗は小さいにこしたことはありません。 また小型のロートほど影響は大きくなります。
もっと積極的に加圧する手法として、 減圧ポンプを利用した吸引ろ過(漉過でも使うので「ろ過」にしておきます)の手法があります。 もっとも単純には図5a のように、 4つ折りにしたろ紙をロートに嵌めて吸引瓶に差し込み、 吸引瓶を減圧すればよいわけです。 重力式のろ過では、せいぜい 1/100 気圧程度(10 cmH2O ~ 1 kPa程度)ですから、 10 kPa 程度まで減圧すれば、大気圧約 100 kPa との圧力差は90 kPa。 ろ過速度は 100 倍ぐらいになる勘定です (さらに水の蒸気圧の 2 kPa ぐらいまで減圧すると1割程度増えますが、 大勢に影響はありません。むしろ溶媒の突沸が心配)。

|

|

|

|

|
| 図5a 単純な吸引ろ過。 4つ折りろ紙をロートに密着させ、 吸引瓶に取りつけて吸引する。 | 図5b 底が抜けないように、 カッターシャツ用のボタンを入れた例 | 図5c 4つ折りろ紙を支えるための白金製のコーン。 液を流すための小さい穴が開いている | 図5d 白金コーンをロートにセットし、 4つ折りろ紙を入れたところ | 図5e 石橋先生の2重ロート。 内側の円錐面の底の方に、 小さい穴が開けてある。 |
ただあまり大きな圧力をかけると、ろ紙が破れて穴が開いてしまいます。 JIS P3801「ろ紙(化学分析用)」にはろ紙が濡れた状態での強度(湿潤破裂強さ)が規定されていますが、 1000 mm2 のろ紙(直径36 mm相当)に圧力をかけた時、 ろ紙の種類によっても違いますが、およそ水柱15 cmに耐えられることを求めています。 円形のろ紙を考えると、破断する圧力は直径に反比例すると考えられるので、 ロートの足が直径 4 mmぐらいのガラス管だと、 およそ10倍、水柱1.5 mぐらいまでは耐えられるでしょうが、それ以上は難しい。 実際、図5a のようにしてそのまま吸引ろ過すると、底が抜けることがしばしばです。
もし4つ折りろ紙で吸引ろ過をやりたいなら、 ロートにろ紙が破れないよう、 支えるものを入れておくのが実践的でしょう。 見栄えはよくないですが、図5b にはシャツのボタンをはめた例を示しました。 実際上はこれで十分です。 かつては、図5c のような白金製の円錐(コーン)をロートに充てがうといったことも行われました。 昔の遺品があるので、興味のある人は使ってもらって構いません。 また以前は3回生の実験で、当化学教室の石橋雅義先生の創案になるという「二重ロート」が使用されていました。 ただいささか嵩張るのが難で、入門化学実験では使用しません。
吸引ろ過は濾過速度を大きくする上で効果的なのですが、 吸引ポンプなどが必要となり、 また濾液が飛び散りやすいので、 今回の実験課題のように、 重力式濾過で適当な時間内に作業が完了するなら、 重力式濾過の方がいいでしょう。 また沈殿の種類によっては、 あまり圧力をかけるとケーキが緻密になって抵抗が大きくなり、 濾過速度がかえって落ちる場合がある(水酸化鉄など)ので要注意です。
なお吸引ポンプには ULVAC のダイアフラム型真空ポンプ DAP-6D を使用しています。 この DAP-6D は小型で便利なのですが、 耐薬品性はほとんどありません (何より安価!耐薬品性のテフロン製のダイアフラムポンプのお値段はこの 10倍ぐらいします)。 図6b に示すのは、動かなくなって内部を調べてみたケースで、 酸性の溶液を吸い込ませ放置していたと思われます。 できれば蒸気も吸い込みたくないところですが、 ともかく溶液を吸い込まないように、 中間に安全瓶を介するよう注意を促しています。 安全瓶は健康ドリンクの空き瓶(C1000 の瓶は透明なので好都合)に、 ペットボトルの蓋をあてがって自作しています。 ペットボトルの蓋にドリルで 6 mm の穴をあけ、 ポリエチ管を取りつけただけのものですが (Φ6 のポリエチ管の先端を少し斜めに切ってねじ込むだけ。 空気漏れの心配はありません)、 十分使用に耐えます。

|

|

|
| 図6a 吸引ポンプに使用している ULVAC の DAP-6D | 図6b 酸にもアルカリにも、有機溶媒にも弱い。 | 図6c 吸引ろ過の時には、 安全瓶を忘れずに。 安全瓶はパンツのゴムひもで括りつけるのがよいようです |
化学実験では析出してきた結晶などを分取する局面で、もっぱら漉過 straining が登場し、 しばしば吸引ろ過が行われます。 また硫酸ナトリウムや硫酸マグネシウムなどの乾燥剤を溶液から除く際にも、漉過が行われます。
この実験では濾過して不溶物を除き、 冷却して純粋な結晶を得るという、 小学校でも出てきそうな課題に挑戦してもらいます。 用意してあるのは図 7a のような、 ベンガラ(酸化鉄(III) Fe2O3)とホウ酸 H3BO3 の質量比で 1:1 の混合物です。 これを 0.5 g 取って、水 5 mL 加えて加熱しホウ酸を溶解させ、 不溶物であるベンガラを濾過して除き、 ろ液を氷冷、ホウ酸の結晶を得るというわけです。

|

|

|

|

|
| 図7a ベンガラ(Fe2O3)とホウ酸の混合物 | 図7b 水を加え振り混ぜながら、 ヒートガンで沸騰するぐらいまで加熱 | 図7c 濾過。 ろ液は少し黄色くなる | 図7d 氷水を入れた発泡スチロール容器中で、 ろ液を氷冷する | 図7e ホウ酸の結晶が出てくる |
イオウの課題の時のように引火性のものを扱うわけではないので、 加熱にはバーナーを使ってもいいですが、 図7b のようにヒートガンを使ってもらうのが簡便でしょう。 加熱してホウ酸が溶解したようなら、 熱いまま、ろ紙を使って濾過してもらいます。 この時、ベンガラが漏れ出てくるようなら、 先に紹介したケーキ濾過の実験同様、 再度、濾過操作をくりかえせばよいのです (入門化学実験でもっぱら使用しているろ紙は、JIS規格では第1種に分類される、 目の粗いろ過速度の大きいものなので、 ベンガラの細かい粒子の混入が起きることがあります)。 ろ液はホウ酸が含まれていることもあって、 若干鉄が溶けだして、図7c のように黄色くなるでしょう。
図 8 にホウ酸の溶解度曲線を示します。 溶解度は30 °C で質量分率 6.3 % です。 今回の実験で処方箋通りに調製しておれば、ホウ酸の濃度は質量分率 5 %程度ですから、 溶液が少し温かい程度になっておれば、 ホウ酸の析出は起きないので、 冷めないうちにと、あまり焦って操作する必要はありません (これが未知物質だと気を使うところ)。
得られたろ液は、氷冷してもらいます。 入門化学実験で使っている氷浴の容器は、 電源装置の梱包材に使われていた発泡スチロール製です。 サイズ的にも収まりがよく、 ここでは試験管立てごと冷却していますが、 実は元の電源装置のノブ(?)を収める穴があって、 これが試験管を立てるのにちょうどよいサイズで重宝しています。 この氷浴に氷水を入れ、しばらく置くと、 図7e のようにホウ酸の結晶が析出してきます。
今回のホウ酸結晶の分取のように、 化学実験では析出してきた結晶(おおむね 0.1 mmより大きい結晶粒の集合)を分取・分離する操作がしばしば登場します。 分取するといっても、微小な結晶粒まで完璧に分離する必要はなく、99 %も分取できれば大丈夫です (1/1000の精度を目指すような定量分析実験では、漉過は推奨できません)。 こうした目的には、通常のろ紙などのように、数 μm オーダーの懸濁物をターゲットにした濾材を使用するまでもなく、 豆腐を作る時に木綿布が使われるように、布や脱脂綿などでも十分です。 ただ結晶を分取する上で、濾材の混入を防ぐため、 毛羽だったりする材料は敬遠したいところですし、 また表面積も小さくしたいところです。
結晶の分取では漉過は無論、その後の過程、 漉過して分取した結晶から付着した溶液を除き、 濾材から結晶を取るという段階が重要になります。 典型的には、0.1~1 mmぐらいの大きさの結晶粒からなる泥状の沈殿を分取したとして、 結晶の性状にもよりますが、体積比でおよそ30~50 %の溶液を含んでいると考えてよいのです。 そのまま放置しておいても、この結晶粒の間に存在する溶液は、表面張力の影響もあって容易に分離しません。 つまり「泥」のままです。 そうした局面で登場するのが先にも触れた吸引ろ過です。 吸引ろ過することで、 採取した結晶の「泥」に空気を流し込み、 溶液を吹き飛ばして除くことができます。 結晶の性状にもよりますが、おおむね溶液の量は数 % ぐらいまで減ります。

|

|

|

|

|
| 図9a 「ミニろ過装置」。 エッペンの底に 2 mm ぐらいの穴を開けたもの | 図9b 底の穴をふさぐ程度に、脱脂綿を少し敷いて使用する | 図9c 吸引瓶に付けたゴム栓の穴にミニろ過装置を差し込んで漉過する | 図9d ミニろ過装置でホウ酸結晶を分取し、取り外したところ。 | 図9e 底の穴にステンレスの針金を差し込んで、 円錐状のホウ酸結晶の塊を取り出す |
通常の化学実験でおおむね数 g ぐらい以上の結晶の分取では、 ブフナーロートが活躍します (正確にはビュヒナーロートBüchner funnel。化学(特に有機化学)ではヌッチェ(Nutsche ドイツ語)と呼ぶことも多い)。 入門化学実験では、 扱う結晶の量がせいぜい 1 g といったレベルなので、 図9a に示すような生化の実験で使うマイクロチューブ(”エッペン”)を加工した、 「ミニろ過装置」を使っています。 この「ミニろ過装置」は、捨ててあるマイクロチューブを拾ってきて、 底に 2 mm のドリルで穴をあけて作っています。 新品を使うより、遠心をかけて廃棄されたマイクロチューブの方が、 底が平らになっていて加工しやすいです。 入門化学実験ではもっぱら 1.5 mL のマイクロチューブを使っていますが、 量が多い時には 5 mL のマイクロチューブも用意しています。
「ミニろ過装置」で結晶を分取する際には、 脱脂綿を少し取って、「ミニろ過装置」の底の穴をふさぐように入れ(図9b)、 6 mm ぐらいの穴を開けたゴム栓に「ミニろ過装置」を差し込み、 吸引瓶にゴム栓をはめてセット完了です(図9c)。 ここに結晶の析出した溶液を入れて吸引ろ過するわけですが、 基本、懸濁液にして入れるのがいいでしょう。 容器から直接流し込んでもいいのですが、 ぼくはポリスポイトで吐出・吸引を繰り返し、 結晶の懸濁液、粥のような状態にして、 ポンプで吸引しながら、 スポイトで「ミニろ過装置」に流し込むのをお薦めします。 結晶が少し大きくてスポイトの先が詰まるようなら、 スポイトの先をハサミで切って、先端の穴を大きくします。 このあたりは自分でいろいろ考えて試みて欲しいところです。
容器の器壁に付いて残った結晶は、 ろ液を使ってもう一度懸濁液にして、 「ミニろ過器」に注ぎ込めばよいでしょう。 ろ液は飽和溶液になっているので、 結晶が溶解して収量が減る心配はあまりありません。 溶液が吸引されなくなったら、 しばらく吸引を続けて空気を流し、 付着している溶液を除きます。
「ミニろ過器」に漉しとられた結晶は、 「ミニろ過器」をゴム栓からはずし、 ろ紙の上に逆さにおいて、底の穴からステンレス線(直径 1 mm ぐらいの針金が便利)で押し出せばよいでしょう (図9e)。 コーン状になって結晶は得られます。 ここから綿を取り除き、 ろ紙上に広げて空気乾燥させればでき上がりというわけです。
なお入門化学実験でも以前は、 図10 のように目皿 mesh disk を用いて、 結晶を分取する手法も行っていました。 今では有機化学の実験室などでは、 もっぱら桐山ロートが使われていて、 目皿を使って結晶を分取している研究室はまずないでしょうが、 以前は広く行われていた手法です。 ただ入門化学実験のスケールは、 この目皿を使う手法を使うには少し小さすぎ、 またろ紙をロートに密着させるところで失敗することが多く、 現行のミニろ過器を使う手法に転換しました。

|

|

|

|
| 図10a 左は市販のセラミックの目皿、 右はプラスチックの目皿(ワイシャツのボタン) | 図10b ロートに目皿をセットします | 図10c 目皿にろ紙を乗せてロートと密着させた後、 硫酸銅の結晶を漉過したところ | 図10d 目皿を用いて分取した硫酸銅結晶。 |
溶液から結晶を析出させる(晶析)には、 溶液を過飽和状態にして析出させます。 この過飽和の度合、過飽和度を表現するのには、 さまざまな流儀(飽和濃度との差を取るか、比を取るか。 濃度をモル濃度で表すか、モル分率、質量分率で表すか。etc etc)がありますが、 要は飽和濃度との差です。
結晶ができる過程は、まず結晶の種となる微結晶(結晶核)ができ(核化)、 それが成長していくという2段階で考えることができます。 この最初の結晶の種は、過飽和度が大きいほどできやすく、 そのできやすさは過飽和度に対して、急激に変化します。 一方、結晶の種が成長する速度の、過飽和度に対する依存性はそれほど大きくありません。 ですから、過飽和度が大きいと、結晶粒がたくさんできて、 結晶粒のサイズは小さくなります。 結晶を分離し付着した溶媒等を除く立場からいうと、 結晶は大きい方がよく、 過飽和度を小さく保って結晶を析出させた方が有利です。 なお、往々にして最初の結晶核の生成がなかなか起きない場合があり、 こうした場合には、ガラス棒などに付いた溶液を蒸発・濃縮させる、 容器のビーカーや試験管の器壁をガラス棒でこする、などなど、 あの手この手で ”祈り出す” ことになります。
溶液を過飽和にするには、 温度を変えたり(冷却晶析)、濃縮したり(蒸発晶析)、 不溶性の溶媒を加えたり(貧溶媒晶析)といったいろんな手法がありますが、 実験室的には温度差による溶解度の変化を利用するのが普通です。 これは通常の溶液では、 濃度に比べて、温度の方が均一になりやすいためです (物質の拡散係数が 10-9 m2/s 程度である一方、 温度拡散係数(熱拡散率)は 10-7 m2/s 程度で、100倍ぐらい大きい)。 たとえば食塩水にアルコールを加えると、 アルコールと水の境界面付近で急激な溶解度の減少、 過飽和度の急激な増加が起き、 結晶核が大量に発生して、食塩の微結晶が生成するのを確認できます。 同様のことは、入門化学実験のピクレートの課題で、 メタノール溶液にアンモニア水を加えて、ナフタレンやビフェニルを析出させるときにも経験することになるでしょう。
なお冷却して析出させるときでも、 冷却速度が遅いにこしたことはありません。 今回はそもそもの溶液中のホウ酸の過飽和度が大きくないのですぐに氷冷しますが、 よく実験室的に用いられるのは、室温付近まで放置して空冷して結晶を析出させ、 その後、氷水に浸けて氷冷するという、2段構えの冷却法です。
結晶化に関わって、入門化学実験ではちょっと欲張って、 いわゆる均一沈殿法(precipitation from homogeneous solution。PFHSと略称される)も盛り込んでいます。 水酸化アルミニウムの沈殿というと、糊状のものを想像する人が多いでしょうが、サラサラの水酸化アルミニウムを見てもらおうというわけです。
水酸化アルミニウムはpH 4~9ぐらいの領域で沈殿してきます。 尿素は温度を上げると加水分解して、アンモニアとシアン酸アンモニウムを生じます (有名なヴェーラー Wöhler の尿素合成の逆反応。 シアン酸は酸性領域では急速に加水分解してアンモニアと二酸化炭素になる:HNCO + H2O + H+ → NH4+ + CO2)。
(NH2)2CO + 2H2O → NH3 + NH4NCO
加水分解は室温付近ではほとんど起きませんが、70 °C 付近ではあらわになってきます (といっても半減期は 10 日程度で非常にゆっくりした分解。90 °C では約1日。) この尿素の分解反応を利用することで、 アンモニア水を加えて沈殿させるより、より粒の大きく、熟成した沈殿をえることができます。 温度を低めに設定した方がきれいに沈殿が得られるのですが、 時間がかかるので、沸騰水中で処理することにしています。

|

|

|
|
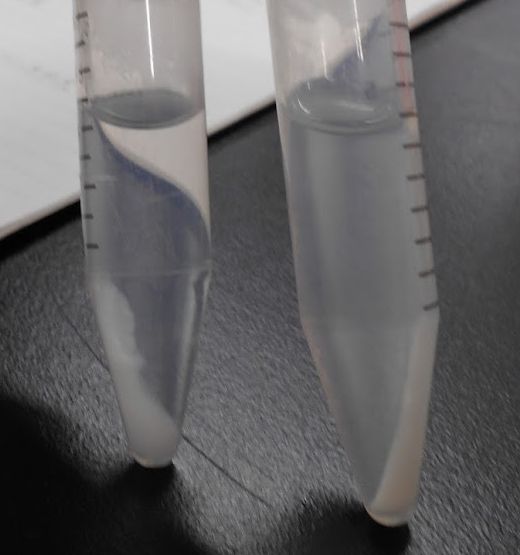
| 図11a ちょっと長丁場の加熱なので、 湯浴の水の蒸発を防ぐためビーズを浮かべています。 ここでは分かりやすいように試験管を使ったケース | 図11b 加熱20 分後。 左がアンモニア水を加えたもの、右が均一沈殿法 | 図11c 加熱1 時間後。 左がアンモニア水を加えたもの、右が均一沈殿法 | 図11d 遠心管を用い、遠心をかけた後。 左がアンモニア水を加えたもの、右が均一沈殿法 |
アンモニア水を注いで急速に生成させると水酸化アルミニウムが半透明のゲル状になり、 均一沈殿法では白色のサラサラした沈殿になることが確認してもらえると思います (沸騰水だと分解速度が速いので、一部ゲル状になってしまうのは残念)。 アンモニア水を注いで作った沈殿を、しばらく加熱して熟成させるという操作を経験した人もいるでしょう。 そうやって熟成させた沈殿は、 生成直後に比べればまとまっていて、はっきり視認できるようにはなりますが、 やはりゲル状で、均一沈殿法のように、 サラサラした沈殿はできません。 最初にどのように沈殿を調製するか、 過飽和度をどのように上げていくかが、 決定的に重要な因子になることを認識していただければよいでしょう。
なお沈殿の様子を観察するには、透明度の高いガラスの試験管がよいのですが、 えられた水酸化アルミニウムを分離、確認するのに遠心分離が便利なので遠心管を採用しています。 湯浴中の加熱などでも、遠沈管は蓋ができるので反応容器として便利です。