|
| 図1. セルロース分子。 左側が非還元末端側、右側が還元末端側。 |
この課題は「身近な化学」に接近する試みで、 衣食住の「衣」にこだわってみました。 けれども衣料材料自体が綿、麻、羊毛、ポリエステル、など多様ですし、 染色に使用する染料、工程も極めて多彩。 さらにその評価も主観的なものになりがちで(「彩度」「質感」「風合い」etc)、 すんなり型にはまってくれません。 ここでは主に木綿を対象に、 繊維の製法に関わる銅アンモニアレーヨンの実験、 染色の技法として、建て染め、媒染に触れるように構成しています。
セルロースが β-グルコースが 1→4 結合してできる高分子であることはよく知られています (グリコシド結合の表記法として、 IUPAC ではいくつかの方法を示していて、 1→4 とアルデヒド基から矢印を書くのは「拡張型」になるみたいです)。 綿のセルロースではおよそ5000 から 8000 個ぐらい、 木材のセルロースではおよそ1000 から 4000 個ぐらいのグルコース分子からなっているようです。 そして図1 に示すように、セルロース分子は 1→4 のエーテル結合(グリコシド結合)とともに、 C3 位についたOH基が隣のセルロース分子のピラノース環の O 原子と水素結合を作ります。 隣り合うグルコース分子はグリコシド結合の周りで自由に回転できず、 セルロース分子中のグルコースのピラノース環は同じ平面上に乗っていて、 セルロース分子は全体として剛直なテープ状になっていると見ることができます。
セルロースの結晶には、I 型と II 型があります (他にもいくつかの多形が存在することが知られています)。 天然に存在するのは I 型と呼ばれるものがもっぱらで、 セルロース分子が向きを揃えて平行に配向しています (I 型には綿や麻、木材パルプで見られる単斜晶系の Iβ 型の他に、 藻類などで見られる三斜晶系の Iα 型があることも知られています)。 一方これを溶解させて再び結晶化させたもの(再生セルロース)では、 向きの異なるセルロース分子が互い違いに、反平行に配向した単斜晶系の II 型が見られます。 綿製品でシルケット加工(マーセル化。アルカリ処理)したものを見ることがありますが、 セルロースにアルカリを作用させても同様に II 型のセルロースができます。 けれども逆に II 型のものを I 型に戻すことはできず、 天然に生物から得られるセルロースは、熱力学的には不安定な構造になっているようです。 なお実際の綿や木材パルプのセルロースには、結晶質でない部分も多く、 そうした部分はアルカリ溶液に容易に溶解します。 そこで特に製紙業界では、 アルカリに溶解しないセルロースを、α-セルロースと呼んでいます。
セルロースは通常使用される溶媒には溶けませんが、 いくつかセルロースを溶かすものも知られています。 ここで扱う銅アンミン錯体を含む、シュバイツァー試薬はその代表的なものです
シュバイツァー試薬の調製法としては、 一旦、硫酸銅溶液をアンモニア水あるいは水酸化ナトリウムで中和、 生成した水酸化銅を沈殿・分離してからアンモニア水に溶解するというのが標準的ですが、 ここでは操作が簡単なので水酸化銅の分離の手順を省略する手法に従っています。 この実験の手法では、2.0 mmol の硫酸銅にアンモニアを 75 mmol、水酸化ナトリウムを 4.0 mmol 加えることになっていて、 量論的には水酸化銅をアンモニアに溶解する形です。 それならもっと簡単にして、 硫酸銅にアンモニア水を大過剰加えた溶液でもいいのではないでしょうか? そこで水酸化ナトリウムを加えない、あるいは量を減らして予備実験してみたのですが、 セルロースが思うように溶けてくれません。 水酸化ナトリウムを加え、十分 pH を下げることが重要なようです。 また一度水酸化銅を分離してからアンモニア水に溶解する手法が推奨されているというのも、 硫酸ナトリウムの塩析等の効果に配慮してのことなのかもしれません。 参考書などによくセルロースに銅錯体が配位する様子などが書いてあったりするのですが、 こうした pH の要件などは地味だけれども、重要なポイントになります。
なおシュバイツァー試薬は、 銅のアンミン錯体の二チオン酸(H2S2O6。unterschwefelsäure)塩の研究の中で偶然発見されたようで、 報文(時に1857 年)には次のようにあります:
研究の実際の対象(二チオン酸塩)をさらに検討する前に、 私の注意はすべて、その液体(シュバイツァー試薬)の非常に興味深い特徴に吸いつけられました。 それは優れた能力を持っているのです。常温で植物繊維を溶解するという! (Bevor ich aber nun den eigentlichen Gegenstand meiner Untersuchung weiter verfolgen konnte, wurde meine ganze Aufmerksamkeit durch eine höchst interessante Eigenschaft jener Flüssigkeit in Anspruch genommen. Dieselbe besitzt nämlich in ausgezeichnetem Grade das Vermögen, bei gewöhnlicher Temperatur Pflanzenfaser aufzulösen.)銅アンミン錯体の溶液自体は古く 17 世紀には知られ、eau celéste(天空の水?)と呼ばれていたそうです (J. W. Mellor, "A Comprehensive Treatise on Inorganic and Theoretical Chemisry," Vol. 3, P. 153, Longmans 1928)。 それをアルカリ性にすることで、 セルロースが溶けてしまうというのは、驚きだったでしょうね。
セルロースをシュバイツァー試薬に溶かして、 それを硫酸の中に押し出せば、 銅アンミン錯体はアンモニアがアンモニウムイオンになって分解し、 セルロースが再び析出してきます。 先にも触れたように、 ここで析出してくるのは II 型のセルロースで、 天然物と結晶形がちがうのですが、 どうちがうのか、ちょっと見には分かりません。 結晶形より、元のセルロース溶液の濃度などの方が、 できてくる再生セルロースの様態には重要で、 濃度が低いとドロドロの状態になります。 実際にも、このセルロース溶液から、 どのようなセルロースの繊維を生み出すのかが、 とても大事なステップで、紡糸原料として通用するものにするには、いろんなノウハウがあるようです。
注射器から硫酸中に押し出すのはいいのですが、 ただ押し出すだけです、青いカエルの卵のようなものになります (工業的には「青糸」と呼ばれるようです)。 そして表面から青い色が抜けて行き、 時間が経つにつれ、最後は白くもろい藻屑のようなものとなります。 このセルロース溶液をどのように処理するかで、 紡糸原料(キュプラ)にもなり、あるいはセロハンフィルムにもなったりするわけですが、 こういう肝心なところの話は、 気軽に教えてもらえるものではないようです。
なお硫酸中に押し出すと、表面が固まり、内部は溶液のままという状態が実現するわけですが、 こういうところから、人工透析に用いられる最初の中空糸膜が生まれたそうです。 旭化成におられた先輩に、苦労したという話を聞いたことがありますが、 その詳しいところは極秘事項のようでした。
さまざまな染料があるのですが、 ここではたまたま実験室の薬品棚にあった、塩基性染料(カチオン染料)、 酸性染料(アニオン染料)、 建染染料として分類されるものを用意してあります。 ここで選んだ色素は、布の染料というに止まらず、 細胞を染色して観察するのに使用されるものなどもあります。 クリスタルバイオレットはグラム染色法 Gram staining で使用される代表的な色素ですし (強く染まるものが「グラム陽性」と呼ばれる)、 メチレンブルーは細胞核の染色によく用いられます。 またローズベンガルは、食紅(しょくべに)として紅ショウガなどに使用されます。
表中、アントラレッド B (ANTHRA RED B)は、昔、Pfaltz & Bauer から購入された品なのですが、 現在すでに取り扱いがなく、 PubChem で検索をかけたベストマッチがこの化合物でした。 実はただのチオインジゴである可能性も高いです。 最近たまたま読んだ、牧鋭夫「染料」岩波 1930(岩波講座「物理学及び化学」の一冊)によると、 チオインジゴは当初「チオインジゴ B」という名称で呼ばれ(フリードレンダー 1906年)、 表に挙げた化合物はヘリンドン・レッド 3B(Helindonrot 3B)と呼ばれていたようです。 ここは分子構造の詳細には拘泥せず、PubChem のベストマッチに従っています。
染料の合成は 19 世紀から20 世紀初頭にかけ、草創期の有機合成化学の重要なテーマでした。 1856年にウィリアム・パーキン W. Perkin がアニリンを酸化して紫色の染料モーブ mauve を合成したのは、 発明発見物語でおなじみかもしれません (ちなみにパーキンが用いたアニリンは、トルイジンを多量に含み、 モーブは数種類の色素の混合物だったとのことです)。 このパーキンのモーブの発見に続き、次々と多くの合成染料が生み出されました (今回使用するクリスタルバイオレットが登場するのは1861年、合成アリザリンは1868 年)。 こうした染料の分子構造について、 最初に系統的な整理を行ったのはウィット Wittで (1876 年)、 クロモフォア(chromophore。発色団)と呼ぶ原子団(ニトロ基 -NO2、アゾ基 -N=N-、カルボニル基 >C=O など)によって、 色原体(chromogen)となり、 色原体にさらに塩を作る官能基(salzbildenden Gruppe。 スルフォン基 -SO3H アミノ基 -NH2 など) が付加されることで、染料となるというモデルを考えました。 ウィットの挙げている例でいうと、 カルボニル基 C=O がクロモフォア(発色団)で、 それがアントラセンに付加して色原体であるアントラキノンとなり、 それに水酸基が付加されることで、アリザリンという染料になるというわけです。 このアイデアはその後さらに展開され(「塩を作る官能基」は、色調の変化に着目する形で助色団(auxochrome)と呼ばれるようになる。 また今では「色原体」に相当するものが「発色団」とされることも多い)、 今も生きています。
染料というと色合いに注目が集まりがちですが、 衣服として考えると、色落ちしない、色褪せしないというのも大事な特性です(堅牢さ。fastness)。 たとえば夏、露草(ツユクサ)の咲いている中を歩くと、 衣服が青く染まりますが、洗えば落ちるし、すぐに褪せてしまいます。 万葉集の歌(1339)にも「月草に衣色どり摺らめども うつろふ色と言ふが苦しさ」というのがありますが (月草は露草の古名。「うつろふ」の枕詞にもなる)、 昔から苦労のあるところです(逆に色褪せやすいことを利用して、西陣織では露草の汁を下書きに使っている(た)そうです。 ちなみに「花色(縹色)」というのは露草の色から来ているらしい)。
露草の青はアントシアニン (露草のアントシアニンは結晶が単離され、コンメリニン commelininと呼ばれます)に由来しますが、 アントシアニン分子は容易に酸化、加水分解等されて、まさに花の色は褪せやすい。 でも分子が安定で、酸化分解や光分解を起こさないとしても、絵の具のように簡単に布から洗い流されるようでは、 「堅牢」とは言えません。 今では昔話になりましたが、反応性染料などが普及していなかった頃は、 赤いシャツと白い下着を一緒に洗濯機にかけたら、 下着がピンクに染まるということがよくありました。 この堅牢さに ”化学” が深くかかわる事例として、 実験では建て染めと媒染を取り上げます。
建て染めでは、不溶性の染料を一旦還元して溶解し(染浴を建てる)、 布に浸みこませた後、 酸化して不溶性に戻します。 この代表は、藍染でしょう。 藍染では、不溶性のインジゴを一旦還元して、 水溶性のロイコインジゴにして綿に吸わせ、 それを酸化して不溶性のインジゴに戻し、 綿に定着させます。 同様の染料にチオインジゴがあります。
この還元・酸化をどのように行うのかには、 いろんな手法があります。 伝統的な藍染では、 嫌気的な発酵を利用して還元した後、 空気酸化を行っていたようです。 ここではハイドロサルファイト(ハイドロサルファイトナトリウム Na2S2O4。 亜ジチオン酸ナトリウム、次亜硫酸ナトリウム。”業界” では「ハイドロ」とも)を用いた還元を行い、 空気酸化で定着させるという手法を用いています。 反応式からも明らかに、pH の高い、アルカリ性の条件でインジゴ・チオインジゴの還元は進むので、 ハイドロサルファイトが有効です (S2O42- + 4OH- → 2SO32- + 2H2O + 2e-)。 還元されるとインジゴはロイコインジゴになり、黄色い溶液になります (ロイコインジゴのアルカリ溶液は黄色ですが、酸性にして酸型にすると無色になるそうです)。
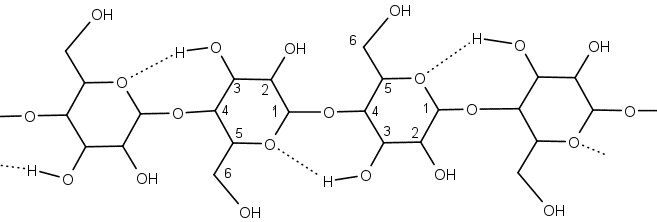
実際に染め浴を作ると、インジゴもチオインジゴも、溶液は黄色っぽいのですが、 図4a のように、元の染料の色の「あく」ができます。 これはたいてい酸化されてできたものなので、 実験では無視して作業を進めます。 この染め浴に布を浸して取り出し、 水洗いすると、どんどん色づいていきます。 染物をやったことのある学生さんなどは、 ここで絞り染めをやったりしますが、 好きにやってもらうようにしています。 最近、そうした学生が少なくなったのは寂しいですが・・・。

|

|
|

|

|
| 図4a. 染め浴。左:インジゴ、右:アントラレッド B | 図4b. アントラレッド B の染め浴に浸し、取り出して洗浄直後 | 図4c. 約10 分後。色づいてきて、ところどころ、赤い染みがでる。 | 図4d. 1時間後。エンジ色に染まる。 | 図4e. 絞り染めの作品例。 |
染め浴の調製に何を使うか、またそれぞれの成分の濃度はいかほどか、 温度はどれぐらいがよいか等は重要な問題ですが、 このあたり染色家の腕の見せ所のようです。 単に「酸化還元反応」と見て、 学生実験で行う分には、還元剤としては、ハイドロサルファイト以外に、 グルコースも有効です 図5 には、ハイドロサルファイトの代わりにグルコースを用いた実験例を示します。 少し還元に時間がかかるようでしたが、 インジゴ、アントラレッド B ともに問題なく建て染めはできました。 ハイドロサルファイトのように臭わないので、 グルコースを用いるようにした方がいいのかもしれません。 なお還元条件としてどちらの還元剤でも塩基性にしないといけないのですが、pH 13 ぐらいは必要なようで、 取り扱いの容易な炭酸ナトリウム(せいぜいpH 11~12)では不十分で、 水酸化ナトリウムを使う必要があります。 また酸化に関わっては、 むらが出ないように過酸化水素などを利用する手法もあるようですが、 空気酸化の方が、何か不可思議な空気があって興味深いです。
なおここでは取り上げない話題ですが、 実際に染め上げた布地の ”風合い” などに関わっては、 酸化され不溶化した染料を、 ”うまく” 布に定着させるのもポイントです。 自然素材にこだわって藍染に挑戦する染色家などは、 こうした点などにも着目して、 酸化還元手法、添加物などの調整など工夫して、 染色に取り組んでおられるもののようです。
媒染に挑戦する前に、 布地と染料の ”相性” を見てもらうことにしています。 その典型として、 実験ではアクリルと純毛の違いを取り上げています。
図6b には、ピクリン酸で、 アクリルと羊毛の染まり具合の違いを比較した例を示します。 ピクリン酸の溶液に浸した後、 水洗いしてみると差は歴然。 他のクリスタルバイオレットやメチルオレンジなどでも、 はっきり差が出ます。
羊毛はタンパク質でできています。 ピクレートの実験の時に経験するかもしれませんが、 ピクリン酸は手に付くと黄色く染まって、 なかなか取れません。 羊毛もピクリン酸で黄色に染まって、 洗っても色落ちしません。 一方、アクリル毛糸の方は、 簡単に色落ちしてしまいます。 ピクリン酸以外、クリスタルバイオレットやメチルオレンジを使っても同様の結果が得られます。
羊毛(タンパク質の主成分はケラチン keratin と呼ばれる)でなく、同じくタンパク質でできている絹(主成分はフィブロイン fibroin)なども 染まりやすいことが確認できます。 図6d は、100 均で見つけた、 麻と絹の混紡のボディタオルをメチルオレンジで染めた例です。 麻の部分は染まりにくく、 絹の部分は染まりやすいことが分かります。
羊毛や絹などタンパク質でできた繊維が染まりやすいのは、 アミド結合 -CO-NH- でできているためとして説明されます。 極性の基があるので、静電的な相互作用で結合するというわけです。 同様に合成繊維でも、同様にアミド結合からなるナイロンなど(ポリアミド繊維)も染まりやすく、 この説明を裏付けています。 特にアニオン性の染料(酸性染料)が有利なようで、 ピクリン酸などは実際にも羊毛の染色に用いられているようです。
実験に当たっての注意点は、 毛糸をよく水、染色液になじませることでしょうか。 羊毛などは、乾いた状態では水をはじく性質があります (表面にクチクラ(cuticula。キューティクル cuticle)層がある)。 以前は染色液の温度の指定をしていなかったので、 形だけ染色液に浸して毛糸が濡れないまま、「染まらない」で済ます学生も出たりしました。 このこと自体は、「濡れ」の問題として興味深いのですが、 今回のテーマとは外れるので、 染色液を加温し、 よく濡れる状態で比較する設定にしました。 また加温することで、アクリルが少しは染まることも見てもらえるようにしています。
媒染は、 そのままでは染まりにくい綿や麻などの布に、 水酸化アルミニウムなどを吸着させ、 さらにそこに染料が結合することで染色する技法ということができます。 媒染には、水酸化アルミニウムなどの無機物ばかりではなく、 タンニンなども利用されます。 染料と金属イオンあるいはタンニン等が、 配位結合などすることで、 染料の色が変化し、 それがまたこの技法の奥行きを広げているといっていいでしょう。
ここでは、 媒染によって鮮やかな色の変化が現れる、 アリザリンを題材に取っています。 以前(2016年度まで)は、 クリスタルバイオレットなどを使用していましたが、 色の変化などが明瞭ではなく、 古典的なアリザリンに取材することにしました。 アリザリンは水に溶けないので、 炭酸ナトリウムを加えて、塩基性にして溶かしています。 アリザリンの 0.2 mass% の溶液を使用しているのですが、 炭酸ナトリウムも 0.2 mass% 加えることにしています (橙色の粉末が、赤紫色の溶液になります。 アリザリンを溶かすにはこれぐらい量の炭酸ナトリウムが必要でした)。
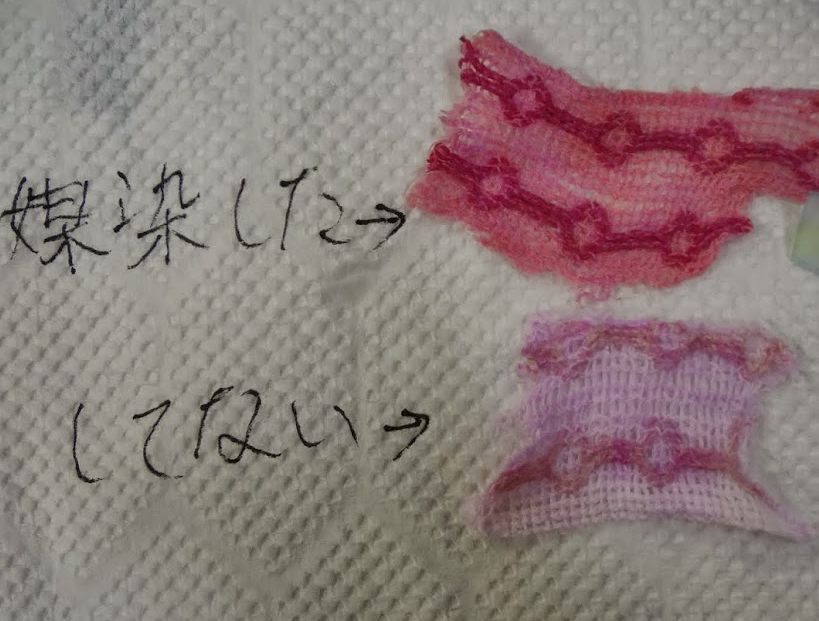
ミョウバンの溶液中で、 木綿の布 (「シーツウェス」(シーツの中古生地)として市販されているものから、 綿製のものを選んで提供するようにしています。 シーツウェスは、台拭きや埃除けとしても便利に使えるので重宝しています。 無論、自分で媒染したいハンカチ等あれば、 持ち込み可ということにしています。 ) の切れ端をしばらく煮て媒染処理するわけですが、 ミョウバンの場合には見た目、元の布と変わりません (硫酸鉄(II) (緑磐)で媒染処理したものは、 薄く黄色く色が付きます)。 しばらく濯いで、 ミョウバンなど洗い流したつもりになっていても、 それが、アリザリンの溶液に浸けると、 図7a のようにはっきり茜(あかね)色になるので、 結構、劇的です。 また媒染剤を変えて、 硫酸鉄(II) にすると、 紫色になります。
媒染によって、 色落ちがどうなるかについては、 洗濯機にかけるなど考えてはみたのですが、 学生実験の時間内でお手軽に試す方法に思い至りませんでした。 そこで、希酸による変色を調べることで、 堅牢さの比較検討をすることにしています。 媒染すると、 色味の変化が小さくなりまります。 なお用いているのは、 在庫にあるリンゴ酸ですが、 酢酸等でも問題はありません。 実験の使用しているのは、 リンゴ酸 0.1 mass%(0.007 mol/L)で、 pH 3 ぐらいですが、 リンゴ酸の濃度さらに高く 1 mass%ぐらいだと、 媒染した布でも橙色になります。
実験では自由度を大きくとり、 アリザリン以外の染料、あるいは媒染剤などでも、 いろいろ試してみてよいことにしています。 いろんな色の変化が出て、興味深いものがあります。 またいわゆる後媒染(一度染料で染めた後、ミョウバンなどで処理する)などに挑戦するのもアリです。 最近はそうした学生をほとんど見受けませんが・・・

|

|
|
| 図7a. アリザリンの媒染。 硫酸鉄(II)(左)、ミョウバン(中央)、無媒染(右) | 図7b. 媒染した布をリンゴ酸溶液に浸す。 硫酸鉄(II)(左)、ミョウバン(中央)、無媒染(右) | 図7c. ローズベンガルでの媒染(硫酸鉄(II) を使用)。 図6d で使用している、麻絹混紡のタオル。 |
ミョウバンを用いた媒染では、 綿に付着したアルミニウムの水酸化物が、 アリザリンと結合することで、 水に洗い流されない安定な染色が実現しました。 それなら、別に綿がなくとも、 水酸化アルミニウムとアリザリンだけでも、 結合して不溶性の物質になるはずです。 実際、 図8a のようにミョウバンの溶液とアリザリンの溶液を混ぜると赤くなり、 この時、レーザー光など照射してみると、 懸濁物が現れていることがわかります。 またこのことは、 媒染した際にした染色液を後から調べてみると、 沈殿が生じていることからも確かめられます。
こうした有色の沈殿物は、レーキ(lake。古くはラックカイガラ虫から作られたことに由来するという)と呼ばれ、 絵の具の原料として用いられています (アリザリンのレーキは、赤絵具として市販されています。「アリザリンレーキ」)。 アルミニウムの定性分析でおなじみのアルミノン試験でも、 同様にレーキが生成しています。 ここでは確認の意味も込めて、 図8c のようにアルミノンレーキの生成反応も見てもらうことにしています (滴瓶には、点眼薬用のプラスチック容器を流用しています。 安価で使い勝手が良いです)。 アルミニウムの定性に使用されるだけあって、 アリザリンよりアルミノン溶液の方が色が薄く、 発色がより明瞭です。
なおアルミノン溶液の濃度は、通常の酸塩基指示薬同様 0.1 % で調製しています (JIS K8001「試薬試験方法通則」でも 0.1 %を規定しています)。 ですから学生実験で必要量は、年 0.1 g もないぐらい。 Organic Synthesis のスケール通りに合成して、20 g ぐらいできたので、 「100 年分はある」と自慢しているところです・・・
なお紅(くれない。 古く大陸から輸入されてきたもので、語源的には「呉(くれ)の藍(あい)」から来たらしい)は、 紅花(ベニバナ)の花弁から得られる染料で、 配糖体の形のままで利用されているようです。 主成分のカルタミン carthamin の研究は古くから行われ、 日本の女性理学博士第2号の黒田チカの研究 (1930)は有名です。 ただしこの黒田の得たカルタミンは、 最初の酸処理の段階で分解したもので、 その後の研究でカルタミンはその二量化した構造を持っていることが明らかにされています。 なお黒田のムラサキの色素、シコニンの構造決定の研究 (1918)も有名です (原報は縦書き。 シコニン Shikonin は紫根にちなんで、黒田の命名するところ。 ナフトキノン骨格を持ち、その後の研究で、 黒田の与えた構造に一部誤りがあり、 古くからヨーロッパ方面で使われていたムラサキの色素、 アルカニン Alkannin の光学異性体であることが明らかとなる。)。 当時、黒田の与えた構造に誤りがあったとはいえ、 今日的な nmr 等の手法を持たない時代、 元素分析と定性化学的な手法、紫外可視スペクトルなどからカルタミンの構造に迫った 黒田の研究に、 ぼくなどは感銘を受けます。