ホウ砂(Na2B4O7·10H2O)水溶液などを用いて電極反応の諸相に触れ、 銀のチオ硫酸錯体水溶液を用いて金属の還元・めっきの一端に触れる。 ホウ砂水溶液については、プラチナとチタン電極について、電圧と流れる電流の関係を調べ、電極反応の特性を考える。

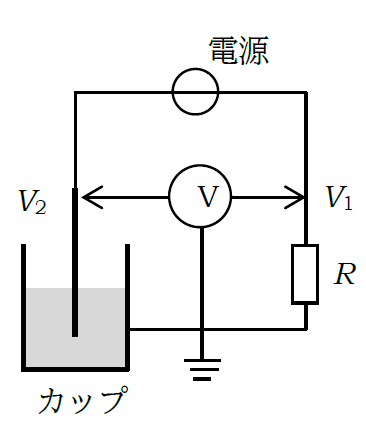
電極を付けたステンレスカップに電解質溶液を入れ、プラチナ、チタン(あるいはアルミニウム)の線材を対極として、 右図のような回路を構成して電気分解する。回路中、抵抗 R には用意してある細めのステンレス線を数十 cm程度切り取って使用する(数Ω。抵抗値はマルチメータで測る)。 電源AD-8723Dの電圧を変化させるごとに、マルチメータで電位 V1、V2 を測定する。 電気分解の電圧はV2、電流は -V1/Rで得ることができる (AD-8723Dも電流値を表示するが精度が低いので採用しない。V1は 1 mV 程度、V2は0.1 V程度の精度があればよい)。
使用に先立って直流安定化電源(AD-8723D。出力範囲0~30 V、0~1.5 A)の電流制限値を次の手順で設定する (さもないと過大な電流が流れて思わぬトラブルを起こす危険がある)。
日本では電位の高低で「陽極・陰極」あるいは「正極・負極」と呼ぶことが多いが、 電極で起きる化学変化に注目すると、電気分解を行う時と、電池として機能している時とで、電極の呼称が変わってしまう。 このため電気化学では電流に注目して、電流が流れ込む(電子が流出する)電極をアノード anode、 電流が流れ出す(電子が流入する)電極をカソード cathode と呼ぶことが多い。 アノードでは酸化反応が、カソードでは還元反応が起きる。
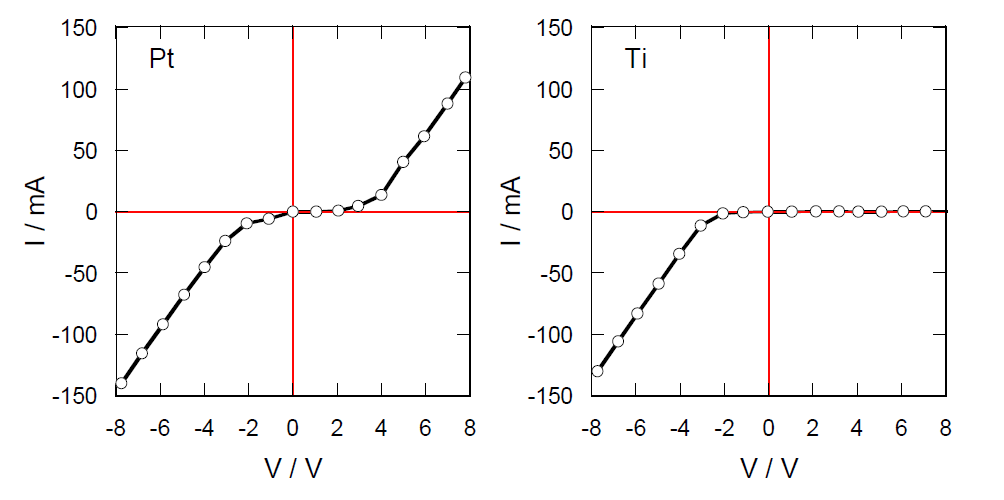
電極の単位面積当たりの電流(電流密度)を j とし、何もしない状態で生じる電圧をE0(平衡での電極電位)とすると、 外部から加える電圧 E と E0 の差(過電圧 overpotential)が電気分解を引き起こす。 今回のプラチナ・チタンを用いた電気分解の実験では流れる電流は、 電極表面積の小さい(電流密度の大きい)プラチナ線・チタン線の表面における電子の授受の反応速度であると考えられ、 典型的には下図のような電極の特性を反映した挙動が認められるであろう。 チタン(あるいはアルミニウム)をアノードとした場合には、表面に絶縁体の酸化被膜ができるため電気はほとんど流れない。 プラチナの場合はアノードでも電流が流れるが、カソードの場合に比べると少し電流が流れにくい傾向が見受けられる。
|
図3C1. プラチナおよびチタン電極に対する典型的な電圧-電流曲線。 |
当初、電気化学については、”教科書” の流れのとおり、 まず電池や電極電位に関する平衡論的な課題を経た後、 電気分解に関する課題につなげる形で構成することを考えていました。 けれども実際に学生が実験する上で、支持電解質の必要性などをスキップして、 最初に酸化還元電位の実験を持ってくるのは、 ただわけもなく手を動かすだけの実験になりそうでした。 そこで小中学校からなじみのある電気分解から入って、 酸化還元電位に向かう方向での構成としました。 酸化還元電位の実験には、物質合成の要素もある、古典的なキンヒドロンの実験を用意しました。
さて電気分解の実験ですが、 マルチメーターなどは提供しますが、 できるだけ簡便に、学生個人でも入手、作成可能なものを考えました。 電気分解の容器もガラスのビーカーから、最終、百円ショップで入手できるステンレス製の計量カップに落ち着きました。 また少し手を伸ばせば、いろんなことができることを体感してもらう意味で、 簡単な電気(電子)工作も組み込もうとも企画しました。 けれどもなかなか学生諸君に受け入れてもらえるものが見出せない中、今の形になっています。 特に最初の部分、「何でもやってみよう」的な形で、 酸水素混合気を作ったり、 高マンガンステンレスのアノード酸化をやったり、 メッキをしてみたりする部分などは、 もっと学生諸君の創意工夫に期待したいのですが、 当方の創意工夫に欠けるところが大きいようです。
例によって話が長くなるので、この課題の詳細については、 下記サイトを参照ください。