電気分解の実験では、まずは電源が問題です。 当初は電気(電子)回路の工作も兼ねて、3 端子の出力可変レギュレーターで、 出力可変電源を作ってもらっていました。 大本の電源には、通販サイトでたまたま見つけた、 お安い電源アダプター(12 V 700 mA。30 個で 5千円しなかったと記憶します)を使用しました。 当日に簡単なプリントを配布、解説をしてから、工作に臨む形で、 ハンドごて片手に、わいわいがやがや、やってもらっていました (実際の工作ではパスコンは省略。パーツの数は 3 個以内を心がけていました)。
こうした電気工作になると張り切る学生もいて、 最初の2年ほどはよかったのですが、学生の反応が急に悪くなりました。 電源回路作りで実験時間を使い切るグループが出たり、 アンケートでも(ばらつきが大きいですが)難度が高すぎるという声が強いようでした。 そこで座学でそもそもの電気回路の基礎を固めておいてもらう必要があり、 実習科目単独ではカバーできないと判断し、 2011 年度の後期から、市販の直流安定化電源(A&D の AD-8723D。 他の実験の使用も視野に、出力範囲0~30 V、0~1.5 A と、いささかオーバースペック。 ただしお値段 1 万円と、われわれオールドタイマーには驚きの低価格) を導入しました。
塩水が電気を通すことは、小学生でも知っているし、 電池や電気分解の話も高校までには学んでいます。 ところが意外に、3回生の実験でも扱いますが、 電解質溶液の電気抵抗と電気分解の関係については、 あいまいなままであることが多いようです。 この実験課題では、電気分解の際の電圧と電流の関係を調べてもらうわけですが、 大まかに言えば図 2 のように、電気分解の起きる電圧 Vd(分解電圧。普通 1 ~ 3 V 程度)まであまり電流は流れず、 それ以上になると急激に電流が流れるようになります。
図 2 の挙動では、電圧と電流の間には比例関係が成り立たず、塩水は ”非オーム抵抗” として振舞うことになります。 一方で化学の教科書には電解質溶液の電気伝導度が扱われ、 オームの法則が成り立つことを前提に話が進みます。 非オーム抵抗なのにオームの法則が成り立つというのはおかしな話ですが、 これは図 3 のように、オームの法則に従う導電体(金属と電解質溶液)が、 電気分解の起きる非オーム抵抗を示す境界領域と”直列接続” されているためです。 この境界領域は典型的には 1 nm 程度の厚みを持ち、 電荷のキャリヤー carrier(電荷担体)の電子からイオンへの乗り換えが起きます。 この乗り換えは化学の言葉で言えば酸化還元反応であり、 いわばオームの法則の支配する「オームの世界」「物理の世界」の間を、 電荷は「化学の世界」を通して ”転生” するわけです。
この「化学の世界」と「オームの世界」を実験的に観測するには、 直流ではなく、高周波数の交流(といってもせいぜい数 kHz で十分)で、抵抗(インピーダンス)をはかってみればよいのです。 (例によっていい加減な話になりますが)電荷移動の反応が起きるまもなく電位の変動が起き、 ちょうどコンデンサーを交流が流れるように、 電極近傍の「化学の世界」を電流が通過し、 オームの法則が成立するようになります。 なお電解質溶液について、通常の電場の強さではオームの法則が成り立ちますが、 1 cm あたり100 万ボルトを超えるような強電場の下では、 オームの法則が破れることが知られています(ウィーン効果)。
なお、よく「塩水は電気を通す」と言われますが、 電解質溶液の電気抵抗は、断面積 1 cm2 で長さ 10 cm ぐらいの太い鉛筆状の筒に、 1 mass% の食塩水を詰めたとすると約 0.5 kΩ です(電気伝導率 20 mS/cm ぐらい)。 濃度におよそ反比例して電気抵抗は小さくなりますが、 金属に比較するとケタ違いに抵抗は大きいのです (電熱器に使用されるニクロム線でも 10-5 Ω(電気伝導率 10 kS/cm ぐらい)、 銅ならこの数十分の 1)。 純水の電気抵抗はこれまたケタ違いに大きくて 0.1 GΩ (電気伝導率 0.1 μS/cm 程度)で、 「塩水は電気を通す」というのは間違いではありませんが、「どれくらい」電気を通しやすいかについては、醒めた目が必要です。 今回の実験ではステンレスの容器を用いますが、 電解質溶液の電気抵抗に対し、ステンレスの電気抵抗は無視できます。
アノード anode やカソード cathode、そもそもの電極 electrode という言葉は、 19 世紀前半のファラデーの研究にさかのぼります。 そもそも天球の運行が念頭にあって、東(正)から西(負)に電流が流れると地磁気の向きの磁場を与えるところから、 アノード( [Greek: ano] upwards, and [Greek: -odos] a way; the way which the sun rises)、 カソード [Greek: kata] downwards, and [Greek: -odos] a way; the way which the sun sets)と呼んだようです。 なおファラデーは「電解質 electrolyte」を、電気分解するとその成分を与えるものとしています(たとえば水は水素と酸素になるので「電解質」。 同様に塩化水素は水素と塩素になるので電解質ですが、硫酸は電解質でないことになっていました)。 今日のように、電離してイオンになるものを電解質と呼ぶのは、19 世紀も後半のようです、
電気分解の速度は、電流の大きさと考えることができます(直流を考えます)。 電気分解は表面で起きているわけですが、 その速さは単位面積当たりの速さ、 電流密度(単位面積当たりの電流)i で評価されることになります。 ところでアノードとカソードそれぞれに流れる電流は同じでも、 表面積に応じて電流密度は異なります。 今回の実験のボルタンメトリーでは、ステンレスカップと白金線・チタン線という電極の組み合わせになるわけですが、 表面積は 1000 倍近く異なるので、 白金線・チタン線の電極の電流密度はステンレスカップ側の 1000 倍近く大きくなり、 観察される電流の電圧依存性は、白金線・チタン線の電極の特性と見てもまず問題ないでしょう。 以下では、2つある電極の中の一方だけに注目して議論することにします。
さて外部から電圧をかけていない状態で、アノードの電位がカソードの電位より Ve( ≥ 0 としておきます)低いとします。 つまり起電力 Ve の電池になっているので、このままでは電流は逆流してしまいます。 電気分解するにはアノードに電圧 V をかけ、V - Ve ≥ 0 となるようにして、 逆流を阻止しないといけません。 この電気分解に必要な電圧 η = V - Ve を過電圧と呼びます。 電極で起きる反応が単純な酸化還元反応である場合には、過電圧 η と電流密度 i の間には次の関係式が成り立つことが知られています (バトラー - フォルマー Butler - Volmer の式)。
\begin{equation} i = i_0 \left[ \exp \left( \frac{k_\mrm{a} F \eta}{RT} \right) - \exp \left( -\frac{k_\mrm{c} F \eta}{RT} \right) \right] \label{eq:bveq} \end{equation}
ここで F はファラデー定数、R は気体定数、T は熱力学温度で、 i0、 ka、kc (> 0)は、 それぞれ電極反応を特徴づける量になります。 図 4 には式 \eqref{eq:bveq} に基づいて、過電圧とともに電流密度の値がどのように変化するかを示しました (T = 300 K、ka = 0.6、kc = 0.4 としています)。 およそ ±0.3 V 程度の範囲で、電流密度が急激に変動していることが分かります。
バトラー - フォルマーの式 \eqref{eq:bveq} は、 いわば「行きの反応速度」と「帰りの反応速度」の和として、反応速度(電流密度)を記述したことに相当しています。 ですから両者の比は平衡定数と関係づけられ、 ka + kc = 1 となることが期待されます (ここでは「単純な酸化還元反応」として、1電子が関与するものを想定しています)。 なお i0 は、交換電流密度と呼ばれ、溶液中の酸化物、還元物の濃度に依存することになります。 詳しい議論は賢い先生に聞きましょう!
式 \eqref{eq:bveq} は、 たとえば Fe3+ + e- ⇄ Fe2+ のように、 電極で単一の酸化還元反応が起き、物質の輸送が速やかに行われるとした場合の話ですが、 多くの場合、電極表面では複雑な化学反応が起き、さらに物質の供給・搬出が滞ることもしばしばです。 たとえば今回の実験では、水の分解を見るわけですが、 カソード側では 2H2O + 2e- → H2 + 2OH- という反応が起きるわけですが、 この逆の過程 H2 + 2OH- → 2H2O + 2e- がアノード側で起きることは、水素と水酸化物イオンを十分供給されなければ期待できません。 ですから実際には、式 \eqref{eq:bveq} のカッコ内第2項目の寄与に相当するものが見られます (この結果はターフェル Tafel の式として知られています)。 同様にアノード側では、酸素発生が起きますが、その逆はみられません。
水を電気分解して、酸水素爆鳴気を作るというのは、 中学・高校向けの化学実験の定番で、みんな知っていると思っていたら、 意外にやったことのない学生が多く、 2018 年度から最初に設定してみることにしました (酸水素爆鳴気は、単に爆鳴気とも呼ばれます。 「酸水素爆鳴気」は、塩素と水素の混合気体(塩素爆鳴気)などと区別するため、 英語の "Oxyhydrogen"(酸水素)とドイツ語の "Knallgas"(爆鳴気)を融合させた言葉のようです)。
テキストには「電解容器」と厳めしく書いてありますが、 実体は図 5a-b のように、30 mL のポリエチレン瓶(瑞穂化成製)に、ステンレス線を2本刺し込んだものです。 ポリエチレン瓶は実験の際に塩酸などを入れて提供しているものをリサイクルして使用しています。 ステンレス線(電極)には、後の 3-2 の電気分解の実験にも使う、 ちょっと太めの直径 0.9 mm のステンレス針金(番手は #20)をペンチで切って使います。 針金は少し斜めに切って、尖らせておくと刺し込みがスムーズです (とはいえ、刺し込みには結構力が必要で、図 5b の百円ショップで売っている簡易なペンチを使うのが無難)。 刺し込みはググっと、一度に決めるのがよく、何度も刺したり抜いたりすると、液漏れが起きます。
使用するポリエチレン瓶は、はめ込み式の内蓋が付いているので、 これに 2 mm の穴を開けて(ドライバードリルで簡単に開けられます。センタードリルを使うのがお薦め)、 直径 2 mm のポリエチレンチューブを取りつけます。 ポリエチレンチューブの先端も、ステンレス電極と同じく、 斜めに切っておいた方が差し込みが簡単です。 このポリエチレン瓶は不透明で、 中の電解の様子が見えないのが欠点で、 図 5c-d のように、弁当に使うソース入れの使用も検討しました。 電解の際の気体の発生が目視できるのはいいのですが、 発生させた酸水素爆鳴気が爆発した時、 蓋が締め込み式なので危険かと思い、はめ込み式の蓋の方を採用しています。
電気分解に使用するのは、ホウ砂の飽和溶液です。 後のボルタンメトリーのホウ砂を使ったのは奥山さんのアイデアで、 安価で入手も容易で、溶解度も高からず低からず、pH も 9 程度でジャブジャブ使えます (溶解度は無水物 Na2B4O7 として室温で 3 mass% 程度、 ホウ砂は水 100 g に 6 g 程度溶けます)。 最初のホウ砂球の実験でも使うので、試薬の準備の手間も省けます。
この実験では、プクプクと酸水素爆鳴気の泡を発生させるのですが、 毎分 0.5 mL も発生させればよく、 クイズにもありますが、電流は 40 mA 程度、 電圧は 6 V ぐらいで十分です。 またホウ砂の溶液は、「電解容器」に目いっぱい入れ、 ポリエチ管は深く差し込まないようにします。 こうすることで、中の空気が爆鳴気に置換されるまでの時間を減らし、 また火を引き込んで電解容器内で爆発が起きても、影響を小さく抑えることができます。
講義実験などでは、爆鳴気のシャボン玉を浮かばせて爆発させるといった派手な演出もありますが、 実験室で各グループがてんでにやるとなると、とんでもない話。 シャボン液(百円ショップで調達)の上に浮かんだ泡を、チャッカマンで点火するという、大学生を小ばかにしたような実験にしていますが、 その爆裂音は「爆鳴気」の名に恥じません。 規模が小さいので、衝撃波でものが破損するといったことはまずありませんが、 破裂音に驚いてものをひっくり返したりするのが心配です。 くどく思えても、あらかじめ注意して、 心構えしておいてもらいます。
なお破裂させる時には、電解を一端中止して、 ポリエチ管をシャボン液から出した後、シャボン液上の泡に火を近づけるのが無難です。 ポリエチ管から爆鳴気が出ている状態で、泡に火を付けると、 火を引き込んで、電解容器内で爆発が起きることがあります。 爆発が起きても少量で、先にも触れたように、差し込み式の蓋なので、 爆裂音とともに蓋がポンと勢いよく飛び出すだけですが、虚を突かれて慌てふためくと事故の元です。 けれども、内径 1 mm の細いポリエチ管内を、爆鳴気の爆発(爆轟)が伝って電解容器内まで到達するといったことは、 こうしたところで経験しておいた方がよいのかもしれません。
水の標準生成ギブズエネルギー ΔfG⦵ は -237.1 kJ/mol とされていて、水素・酸素の分圧なども加味すれば、常温で水の電気分解に最低必要な電圧は 1.2 V ぐらいです。 ここでは過電圧を 5 V 程度かけることになっています。
この実験課題は、実験での思わぬ発見が端緒となりました。 入門化学実験の草創期には図 7a のように、ビーカーにホウ砂溶液を入れ、 厚さ 0.1 mm のステンレスの巻物を幅 2 cm ぐらいの短冊に切って作成した "参照電極" と針金の電極を、 断熱ボードやコンパネの板の切れ端などに画鋲とクリップで留めて電解セルを構成していました。 先にも触れたように、電源は自作の可変電源です。 奥山さんお好みの手作り感満載で、個人的には好感が持てたのですが、 何かの拍子に電極が外れたり、電極同士がショートしたりといったトラブル続出。 そこで 2012年度の後期から、図 7b のように、 ガラスのビーカーに代えて、百円ショップで売っているステンレス製の計量カップを利用することにしました。
このステンレスの計量カップが曲者でした。 実験のセットアップが容易になり、参照電極として使用するボルタンメトリーなどもおよそ期待通りだったのですが、 2年目になって、当時行われていた硫酸銅溶液の電気分解で、思わぬことが起きました。 当方の予定通り、図 7c のようにカソードのステンレス線に銅樹ができるのはよいのですが、 たまたま面白がって電解を続けていたグループがあり、溶液の銅の青色が薄くなっていくのと入れ替わりに、色が赤くなっていくのです。 最初の年は何か変なことをやったのだろうという程度で見ていたのですが、 その翌年も同じことが起き、この時はぼくも加わって実験してみて、図 7d のようにはっきり赤くなることが確認できました。
ホウ砂溶液の電解では赤くならないので戸惑ったのですが、 硫酸ナトリウム溶液では赤くなり、他の実験で使った色素などが混入したのでないようです。 そこで吸収スペクトルを取ってみると、 図 8 のように過マンガン酸と同様に 510 nm 付近にトサカ状の構造が出ていました。 不溶性の物質による濁りが若干あり、500 nm より低波長側で光散乱の効果が顕著になりますが、 比較してみるとトサカ状の吸収ピークの位置も一致していて、 過マンガン酸が生成していることが分かりました (この図はベースラインなど乱れていますが、個人的に思い出深いものです)。
問題はマンガンがどこから出てくるかでした。 当時のぼくには、ステンレスはクロムとニッケルを含む合金鋼で、 磁石に付かない SUS 304 などのオーステナイト系と、磁石に付く SUS 430 などのフェライト・マルテンサイト系がある程度の知識しかなく、頭を抱えたものでした。 そうした時、電解酸化で赤色になることを利用するマンガンチェッカーというのがあることを教えられ、 高マンガンステンレス鋼が、SUS 304 等の安価な代替材料として盛んに使われていることを知りました。 JIS にもオーステナイト系に SUS 201、SUS 202 という鋼種が規定されています(JIS G4303「ステンレス鋼棒」など。 ただし JIS の圧延鋼板の規格などからは外されていて、加工性に問題があるのかもしれません。 実際、使用している計量カップは、数年経つと形がゆがんだり、割れたりしています。百円なので気になりませんが・・・)。
高マンガンステンレスからアノード酸化で過マンガン酸が生成するというシナリオで、 溶液が赤くなるということははっきりしたのですが、 その反応機構は(少し調べてみたのですが)よく分かっていません。 ただ熱力学的には問題はありません。 アノード酸化で過マンガン酸イオンができる反応は、 総体としては次のように書けます。
Mn + 4H2O → MnO4- + 8H+ + 7e-
マンガンの合金化による活量の変化を無視すると、この反応の標準還元電位は 0.74 V で、水のアノード酸化
2H2O → O2 + 4H+ + 4e-
の標準還元電位 1.23 V より低く、アノードから酸素が発生するような電圧を加えておれば、 起きても不思議ではありません。 けれども「起きていい」と「起きる」は別です。 実験的には、硫酸ナトリウムなど、硫酸塩溶液の電解では過マンガン酸の生成が見られますが、 炭酸塩、ホウ砂溶液などでは、 過マンガン酸の生成が見られません。 pH が高いとマンガンの低級酸化物生成が優先されるのかもしれませんが、詳しい事情は今のところ不明です。
ともあれ簡単に実験できる興味深い反応なので 2016 年度から、正式に課題の中に組み込むことにしました。 最初は硫酸銅溶液の電気分解のオマケの扱いでしたが、2018 年度後期から、 硫酸銅溶液の電気分解の中止にともない、独立の課題となり、 硫酸ナトリウム溶液の電気分解と吸収スペクトルの測定のセットで行いました。 さらに 2019 年度の後期からは、懸濁物(鉄などの水酸化物かと思われます)の量を逓減するため、硫酸水素カリウム KHSO4 (実際に提供するのは、試薬の在庫にあった二硫酸カリウム K2S2O7)溶液を使用しています。 硫酸水素カリウム溶液は、次の銀メッキの実験で銅板の洗浄にも使用できるので、一石二鳥というところです。
アノード(陽極)から静電的な引力に逆らってアニオン MnO4- が出てくるのは、 不思議に思われるかもしれません。 同様に次の銀メッキで、銅板をカソード(陰極)にすると、アニオンは電気的に反発して接近できないので、 Ag(S2O3)23- の還元反応は起きないように思えます。 このようにアノードからアニオンが出てきたり、カソードにアニオンが接近したりできるのは、 相方のカチオンが周りにいてくれるお陰と思ってもらえればいいでしょう。 電極近傍のイオンに対する電場の効果は、距離とともに指数関数的に急激に減衰すると考えてよく、 一般に電解質濃度が高いほど減衰は大きくなります。

|
| 図 10. 沈殿滴定の実験廃液から回収した塩化銀。 少し光分解して灰色になっている。 |
メッキの実験は、中学高校ぐらいまでの化学実験の定番でしょう。 入門化学実験の初期から、硫酸銅溶液の電気分解の課題を行っていましたが、 あまりメッキという観点はありませんでした。 けれども硫酸銅溶液の電気分解の課題の重心を、金属銅の生成から過マンガン酸の生成に移す機会に、 2017 年度の後期から、メッキを取り上げることになりました。
メッキ(鍍金)と言ってもいろんな種類があります。 基本、化学メッキと電解メッキを並列させるプランで、 3回生実験の沈殿滴定の廃液から回収した塩化銀(図 10)がたくさんあるので、 これを利用して銅板の銀メッキを行ってもらいます。 この課題では、一応化学メッキ(無電解メッキ)と電解メッキをやる形になっていますが、 本格的(?)な銀の化学メッキは、糖の実験の銀鏡反応を待つことになります。 なお当初は銅メッキのつもりでプリント基板に使われる、銅メッキを考えていたのですが、 ホルマリンの使用に難がありました。 ホスフィン酸 H3PO2 の在庫があることを幸い、 ニッケルについて、いわゆるカニゼン KANIGEN® メッキと電解メッキも検討しましたが、 時間的に無理があり、結局、銀メッキに落ち着きました。

|

|
| 図 11a. 銀のメッキ浴に銅板を浸すところ。 回収塩化銀が少し分解しているので、浅黒い感じのメッキ浴になる。 | 図 11b. 右から 0 V、1 V、2 V でメッキした結果。 2 V かけると、硫化銀 Ag2S と思われる、黒色粉末が生成してくる。 |
銀メッキで工業的に利用されているのは、銀のシアン錯体 Ag(CN)2- のようですが、 ここでは学生実験でも安全に取り扱えるように、銀のチオ硫酸錯体 Ag(S2O3)23- を利用して、 銅板に銀メッキします。 銀のチオ硫酸錯体は、塩化銀をチオ硫酸ナトリウム溶液に溶かすことで得ます。 元が図 10 のようなあまり美しくない塩化銀なので、 図 11a のようにいささか浅黒い溶液になりますが、メッキ浴として使用する分には問題ありません。
ここでの設定では、塩化銀 AgCl が全量溶けたとすると銀濃度は 0.14 mol/L、チオ硫酸ナトリウムは 0.32 mol/L で、 銀の全量がチオ硫酸錯体になったとして、少し過剰(0.04 mol/L)にチオ硫酸ナトリウムが入っています。 データブックを見ると塩化銀の溶解度積は pKsp = 9.8 ぐらい、 銀のチオ硫酸錯体の生成定数 β2 = [Ag(S2O3)23-]/[Ag+][S2O32-]2 は log β2 = 13.5 ぐらいということになっていて、 塩化銀の固体が存在すれば log [Ag(S2O3)23-][Cl-] = 3.7 + 2 log [S2O32-] という関係が成り立ちます。 遊離のチオ硫酸イオンの濃度が 0.01 mol/L あれば、 塩化銀を溶かして 0.7 mol/L の銀のチオ硫酸錯体溶液を作ることができる計算で、 (乱暴な計算ですが)実験の設定で少しかき混ぜれば、塩化銀は溶けてくれます。
実験ではまず、表面が少し鈍い色をした銅板(厚さ 0.2 mm。以前、実験で使用されていた銅板の使いまわし)を工作用ハサミで短冊形に切り、 硫酸水素カリウム溶液に浸して金属光沢が現れた後、水洗いしてメッキする素材とします。 最初は特に何の指示もせず、やりたいようにやりなさいという形でしたが、 銅板表面の状態(酸化されたり手の油が付いたり)によって、結果に大きなばらつきが出ました。 サンドペーパーなどの使用も考えられますが、 今回の場合、酸の溶液で処理してから作業するのが "化学的" で簡便・確実なようです。
この銅板をそのまま電圧をかけずにメッキ浴に浸してもらうだけで、 数分すると金属銀が析出して銀色になります(無電解メッキ(置換メッキ))。 また銅板をカソードにして直ちに 1 V 程度の電圧をかけると、速やかに銀色になり、時間とともに銀が厚くメッキされていきます。 でもかける電圧をさらに上げると、銀メッキはされるのですが、黒い粉状のものができてきて、さらには硫化水素の臭いがするようになります。 ステンレスたわしなどでメッキの剥がれやすさをチェックしてもらうと、 たぶん電気を通さない方が、銀は剥がれにくいでしょう。
この実験は、ただ作業するだけなら何ということのない実験ですが、 少し考えると大変奥行きがあります。 そもそもの、無電解で銀の還元が起きるかどうかも問題です。 銀のチオ硫酸錯体の生成定数 β2 = [Ag(S2O3)23-]/[Ag+][S2O32-]2 は log β2 = 13.5 から考えると、チオ硫酸イオンの濃度が 0.04 mol/L とすると、 遊離の銀イオン濃度は log [Ag+] = -11.5 ぐらいです。 銀の還元反応 Ag+ + e- ⇌ Ag の還元電位は E / V = 0.80 + 0.06 log [Ag+] = 0.11 となり、銅の還元反応 Cu2+ + 2e- ⇌ Cu の標準還元電位 0.34 V よりも 0.2 V 低くなり、 ちょっと銀の還元が起きそうにありません。 ここには銅のチオ硫酸イオンとの錯体形成を加味して考える必要があります。 銅も安定なチオ硫酸錯体を作るので(log β2 = 12.3)、 銅の還元電位がほぼ 0 V ぐらいまで下がり、銀の還元が可能となるのです (銅のチオ硫酸錯体が安定なことは、キレート滴定のマスキングにも利用されています)。 余談ですが、鉄にスズメッキしたブリキについて、スズの方が鉄よりイオン化傾向が低いので、 傷が付いたりすると防食の効果が損なわれる(いわゆる犠牲防食が働かない)とよくいわれます。 ブリキのおもちゃが赤錆びるような場合はそれでよいのですが、 缶詰などで食品に使用する場合は単純ではなく、 スズのクエン酸等との錯体が安定なため、 犠牲防食の効果は十分あるようです。
また電気分解でメッキした時、今回の場合のように、 電圧をかけすぎるとメッキの密着性があまりよくない、 硫化物が生成する、などといったことが起きたりするのも、 注意しておかないといけない点です。 特にメッキの密着性は実用的に非常に重要で、 事前に表面を清浄にするのは無論、 ストライクメッキ(下地メッキ)、 メッキ浴の組成や電解条件の調整など、 さまざまな技法が展開されています。 なおメッキの密着性の評価法については、JIS に規定はありますが(JIS H8504「めっきの密着性試験方法」)、 そもそものメッキの種類がさまざまで、これという決定版はないようです。
なお、ここでは銅板へのメッキを行っていますが、 興味があれば、黄銅や鉄の針金のメッキなども試みて欲しいところです。 黄銅は銅板同様に銀メッキができるでしょうが、 鉄の針金はどうでしょう。 あるいは亜鉛やマグネシウムリボンなどでやってみるのも面白いかもしれません (無電解だと黒い粉ができてくるでしょう)。 やってみる学生がいないことは残念ですが・・・

|

|

|
| 図 12a. 0.1 mol/L 硝酸銀溶液に銅線を浸して作った銀樹(20 分経った時点)。 | 図 12b. 銀樹を取り除いた銅線。メッキはできていない。 | 図 12c. 銀のチオ硫酸錯体溶液に浸して銀メッキした銅線。 |
以前(20 世紀?)は銀塩写真の現像過程の定着に関わって、 銀が安定なチオ硫酸錯体を作ることはよく知られた現象で、 現像廃液の処理などもよく話題になっていました。 この課題の銀の化学メッキ(置換メッキ)は、ぼくが高校のころだったか、 銀樹を作ろうと思って、銀のチオ硫酸錯体溶液に銅線を浸したら、 なぜかきれいに銀メッキができてしまったことに想をえています。
試験管に硝酸銀の溶液を入れ、銅線を浸すと、図 12a のように、銀樹が成長していきます。 そして30分ほどして軽くゆすって銀樹を落とし、元の銅線を見ると、 銀メッキはできていません (図 12b。このケースでは局所電池ができて、図 12b では銅線の根本と先の方は溶解して、含まれる鉛(?)のためか黒ずんでいます。 図 12a では液面近くと底の方の溶液が青くなり、 銅の溶解が起きる一方、中間付近では銀の析出が多くカソードのようにふるまっています)。
銀のチオ硫酸錯体の溶液で銅線を浸すと、銀樹はできず、 図 12c のように銅線の表面は銀で覆われメッキできました (銀のチオ硫酸錯体濃度は今回の実験課題と同じ)。 径 0.5 mm の銅線を長くとって(265 cm)、重さの変化を調べたところ、増加量は 5 分で 13 mg、20 分で 14 mg で、 5 分もすればほぼ銀の析出は止まっているようです。 この重さの変化からメッキされた銀の厚みを推定すると、およそ 1 μm です。 ふつう、メッキというと 10 μm ぐらいはあるでしょうから、随分薄いメッキになっています。 そもそも均一に銀メッキされたら、銅の溶出は起きなくなるわけですから、 なぜ 1 μm ぐらいまでメッキ層が成長するのか不思議な話です。 このあたりはメッキの奥深いところなのでしょうね・・・
電気分解における電圧-電流の関係は、 電極近傍におけるさまざまな化学反応や物質輸送を反映するもので、 ボルタンメトリー voltammetry と呼ばれ、分析化学の分野などでは古くから研究され、 種々の精緻な実験技法が開拓されてきています。 それだけに初心者には近づきがたい印象が強いのですが、 ここではともかくどんな現象が観察されるものなのか、 白金とチタンの電極について ”体当たり” で調べてもらうことを期待しています。
測定回路は、実験テキストにもある図 13a の通りです。 電圧 V1 をかけた時に電極に流れる電流 I は、抵抗 R を流れる電流に等しく、 オームの法則から I = - V1/R になるというわけです。 よくあるボルタンメトリーでは、せいぜい ±3 V の実験ですが、 ここでは大胆に素人臭く ±8 V に設定してやってもらいます。 流す電流は最大 100 mA ぐらいなので (直流安定化電源 AD-8723D の表示する電流値は ±0.01 A 程度の精度しかないので、電流値の測定には不適です)、 使用するマルチメーター U1251A の 500 mV レンジではかることを想定して、 抵抗 R は数 Ω 程度。 ペルチエ素子の実験の時にも使ってもらった、 直径 0.3 mmぐらいの細いステンレス線(#30。およそ 10 Ω/m)を 20 ~ 30 cm 程度切って使います (白金電極と取り違えないように要チェック! ホウ砂球の話でも触れましたが、分からなくなったらバーナーの火であぶるのが確実)。 図 13b には実際の測定の様子を紹介しますが、 こうした「ともかくやってみよう」的なノリが、 入門化学実験の大事にしたい空気です。
実際に電圧をかけて電流をはかってみると (かける電圧 V2 の値は ±0.1 V 程度の精度でよく、 電源 AD-8723D の表示する電圧 V0 を読んでもらえばよいでしょう。 V2 = V0 - V1 ≈ V0)、 最初電流が多めに流れた後、少しずつ減っていき、 だいたい一定値に落ち着く(電圧 |V1| が大きくなった後、一定値に落ち着く)という挙動が見られます。 この落ち着いた電流値(- V1/R)を電圧 V = V2 に対しプロットすると、 テキストの解説にも紹介していますが、 図 14 のような結果が得られます。 チタンをアノードにした場合には、ほとんど電流が流れません。
まず白金電極の場合に注目してみると、十分電圧が大きい場合(V < -3 V, V > +4 V)、 電圧に対しほぼ直線的に電流が大きくなります。 これは電極での電子の受け渡しが十分早く起きるようになり、 電極までの電荷(イオン)の移動が電流の大きさを決めている、 つまりオームの法則が働いていると見なせます。 実際、図 14 の白金電極では、アノードの場合(V > 0)でもカソードの場合(V < 0)でも、 十分電圧が大きい場合の勾配から想定される電気抵抗は、 およそ 120 Ω で同じです。 この中間の領域(-3 V > V < +4 V)では、 水と電極との間の電子の受け渡し、いわば「化学」が事態を決めていると見なせるわけですが、 カソードの場合、水素を発生する場合の方が電子の受け渡しがスムーズです。 水の電解に最低必要な電圧は 1.2 V ぐらいですが、 水素発生の場合には、ほとんど過電圧を必要としていません。 水素発生に必要な過電圧は、水素過電圧と呼ばれますが、 白金は水素過電圧の小さい金属の代表格です (同族のパラジウム Pd も水素過電圧は小さく、奥山さんのお気に入りの元素だったりします)。 一方、アノードの場合、酸素を発生する場合には、0.5 V くらい過電圧が必要で、 水素発生の場合の 2H2O + 2e- → H2 + 2OH- に比べて酸素発生の場合には 2H2O → O2 + 4H+ + 4e- のように、反応式からも多数の電子の関与が想定され、いろいろ複雑なプロセスを経ていることが想像できます。
チタン電極ではアノードだと図 14 の電圧範囲では電流がほとんど流れていませんが、 カソードの場合、十分電圧が大きい場合(V < -4 V)、の電気抵抗は、 およそ 70 Ω です。 チタン線が白金線より太く、浸している長さがほぼ同じなので、 表面積が 5/3 倍程度であることを考えると、妥当な値になっています (ただしこれは、最初チタンをカソードにして実験した場合で、 アノードにして電圧-電流曲線をはかった後、カソードにしてはかると、 電流は流れますがその値は小さくなります)。 また水素過電圧が 0.5 V くらいになっているのも注意しておいてよいでしょう。 チタンは水素と仲が良く、水素化物 TiH2 は試薬として市販されているぐらいですが、 過電圧が高いのは面白いところです。
さてチタンがアノードの場合に電流が流れないのは、 表面に緻密な酸化物でできた電気を通さない絶縁層ができるためです。 図 15 に電解前、電解後のチタン電極の表面のマイクロスコープの写真を示しました。 電解後には金色になっていて、独特の風合いが出ています (こういうチタンの特質を生かした素材に TranTixxii®(トランティクシー)などがあります)。 同様の現象はアルミニウムでも見られ、 アルミ線も用意してあるので挑戦してみて欲しいところです (こうしたアルミニウムの酸化被膜の生成を利用したものに(アルミ)電解コンデンサーがあります。 また防食用に利用したものをアルマイト(元は理研の商標)と呼びます)。 最近、挑戦してみようという学生がいないのは寂しいですが・・・

|
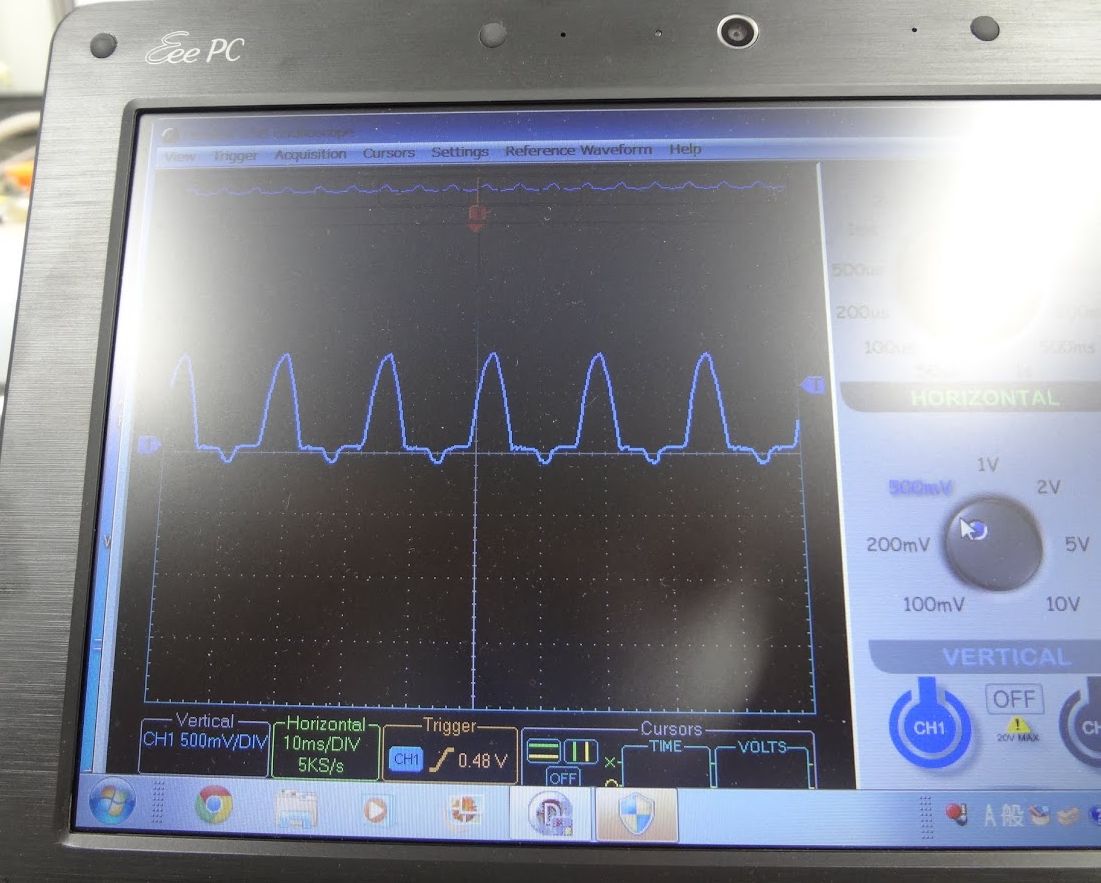
|
図 16a. 簡易オッシロスコープ(Parallax 社製)。PC に接続して使用します。 | 図 16b. アルミ電極の整流効果。 トランスで降圧した 60 Hz 交流を使用。 図 13a の回路の V1 をモニターしているので、 カソード側の電流の電位が + に出ます。 |
図 14 のチタン電極の結果を見ると、 交流から直流を得る、整流器として機能できることが分かります (20 世紀初頭には化学整流器 chemical rectifier(電解整流器とも)と呼ばれ、実際に使用されていたらしい)。 ダイオードで整流する話はみんなよく知っているので興味を持ってもらえるかと、 教育用の簡易なオッシロスコープ(図 16a。Parallax 社が出していたもの。今は廃番?)が入手できたので、 2013 年度には整流した波形観察を課題に加えました。 やってみると図 16b のように、たしかに半波整流の波形が得られのですが、 アノード電流も少し現れ、降伏電圧のような挙動も見られます。 また事前に直流でどれぐらい電解したかなどで、電圧と電流の位相のずれを含む、 複雑な波形が現れたりもしました(特にチタン電極)。 こうなると奥山さんなどは熱が入ります。
といったところで、「化学で整流する」というのは確かに興味深いのですが、それだけでは物足りないと、 2014 年度から簡易なファンクションジェネレーターを持ち出して、 ”サイクリックボルタンメトリーもどき” の実験に挑戦してもらえるようにしてみました。 図 17 にはチタン電極について、三角波を用いた場合のボルタモグラフの一例を示します。 直流のボルタンメトリーの際に、電圧を変えた時、電流値が落ち着くまでに時間がかかるわけですが、 これはその変化の様子を ”リアル” に眺めたことに相当しています。 電位が正の時に電流が流れないという挙動はいいのですが、 電位が負の時、電流が ”逆流” する挙動が見えています。 ここまで大きな ”逆流” はアルミニウム電極では見られず、 チタンの水素化物の生成・分解(電池としてみれば充電・放電)が絡んでいるようです。 また白金電極を用いた場合には、 吸着水素の飽和・放出を示唆する挙動が出ます。
さてファンクションジェネレーターで、周波数を変えてみたり、波形を変えてみたりすると、 いろいろ面白い現象が現れるのですが、 学生さんの側の反応はあまり芳しくありませんでした。 特に 2016 年度あたりから「物理をやりに来てるんじゃない」といった空気が増したように思います。 そこで 2018 年度からは、課題からオッシロスコープの使用を外し、 直流ボルタンメトリーだけに絞ることになりました。 こうした「化学」「物理」といった垣根を超えるような課題に挑戦するには、 教員の側の創造力・想像力とともに、 最初の電源回路でもそうでしたが、 学生諸君の意欲に期待するだけではなく、そもそもの課題全体のありようを考える必要があるようです。