
キンヒドロンとは p-ベンゾキノンとヒドロキノンが 1:1 のモル比で作る分子性結晶であり、 水素結合型電荷移動錯体の代表例として知られている。 またその酸化還元挙動を利用して、pHの測定にも用いられてきた。 ここではキンヒドロンを合成し、キンヒドロン溶液の酸化還元電位とpHの関係を調べる。
余裕があれば用意してある赤血塩 K3Fe(CN)6 溶液、黄血塩 K4Fe(CN)6 溶液を用いて(3)~(6)と同様の実験を行ってみよ。
キンヒドロンはベンゾキノンの還元によっても合成できる。 ベンゾキノン 0.2 g をはかり取って水 5 mL を加えて加熱溶解し、 10 mass%亜硫酸水素ナトリウム溶液 1 mL を加えると、同様にキンヒドロンを得ることができる。 あるいは強酸性で硫酸鉄(II)で還元してもよい。
酸化剤Oxを還元して Red にする反応 Ox + ne = Red を利用して電池を構成した時、
\[ E = E^{\circ} + \frac{RT}{nF} \ln \frac{[\rm{Ox}]}{[\rm{Red}]} \approx E^{\circ} + \frac{0.06~ \rm{V}}{n} \log \frac{[\rm{Ox}]}{[\rm{Red}]} \]
で表わされる電位が発生する(0.06 Vは室温付近での値)。ここで\(R\)は気体定数、\(T\) は熱力学温度、\(F\) はファラデー定数、[Ox]、[Red]はそれぞれ酸化剤、還元剤の濃度。 \(E^{\circ}\) は標準電位と呼ばれる反応を特徴づける電位で、通常、標準水素電極(2H+ + 2e = H2)が基準として採用される。 濃度を 10 倍変えると電位は 60 mV 程度変化する。 ORP(Oxidation Reduction Potential) 計は ORP 計の電極表面で起きる酸化還元反応に応じた電位を与えるわけだが、 溶液中に酸化剤と還元剤がある程度存在しないと、わずかの不純物の存在で電位は大きく変化し、安定な値を示さない。
なお酸化還元電位の実際の測定に当たっては、水素電極は取り扱いが厄介なので、電位のよく分かった安定した電極(参照電極)として、 広く銀-塩化銀電極が採用されている。 標準水素電極に対する電位はほぼ 0.20 Vで、今回使用するORP計にも採用されている模様。
酸化還元反応にともなってpHが変化する場合、電位も pH に影響を受ける。 キノン Q がヒドロキノン H2Q になる反応 Q + 2H+ + 2e = H2Q においては、次式が成立する。
\[ E = E^{\circ} + \frac{RT}{2F} \ln \frac{[\rm{Q}] [\rm{H^{+}}]^2}{[\rm{H_{2}Q}]} \]
キンヒドロンの溶液においては、ヒドロキノンの酸解離平衡が無視できるpH領域では、 [Q] = [H2Q] が成立するので、電極電位として次のような結果が期待される:
\[ E \approx E^{\circ} - 60~\rm{mV} ~\rm{pH} \]
この標準電極電位 \(E^{\circ}\) は室温で標準水素電極に対し 0.700 V とされている。 なお pH が高くなるとヒドロキノンの電離が起きて[Q] = [H2Q]の関係が成り立たなくなる (H2Q のpK1は 9.9、pK2は11.4)。
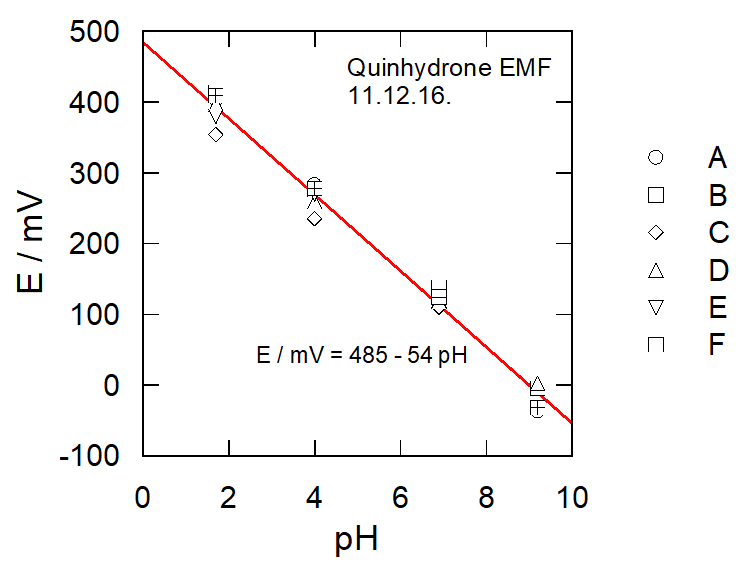
|
| 図4A1. 種々のpHにおけるキンヒドロンの酸化還元電位。A~Fの6グループによる測定値 |
このキンヒドロンに関する課題は大きく、酸化還元反応による物質合成と、 酸化還元電位の測定とからなっています。 ヒドロキノンの酸化(ベンゾキノンの還元)は速やかに進行し、 条件をうまく選べば、両者の分子間化合物であるキンヒドロンが生成します。 酸化還元反応が速やかに起きてくれること、 そしてキンヒドロンが測定に好都合な溶解度を持つことが、 この反応系を酸化還元電位、ネルンストの式の実験の対象として適切なものにしています (今では老人の昔ばなしになりましたが、かつてはキンヒドロン電極は pH の測定に用いられていました)。 さらにキンヒドロンが溶液中からキラキラと析出してくるのが、 いかにも「化学変化」らしくて興味をそそるのは、 学生実験としてポイントの高いところです。
ヒドロキノン hydroquinone は、”業界”では、もっぱらハイドロキノンと呼ばれ、 ぼくなどもよくハイドロキノンと呼びます。 昔懐かし銀塩写真の時代、メトール(metol。4-(N-メチルアミノ)フェノールの硫酸塩)などとともに、 現像液に用いられていました。 最近は美容方面で、「美白」などに用いられているようです。
この課題は電気分解の課題とセットで構想していたものでした。 まずは化学反応をともなう電流についてのイメージをつかんでもらってから、 酸化還元電位に関する課題に入ろうという段取りでした。 それが実験スタッフが変わり、日程も窮屈になる中、2016 年度から実施課題から外れることになりました。 化学の座学の中で大きく取り上げられる、 酸化還元電位とその pH 依存性について、 実際に体験する機会を提供できないのは残念ですが、やむを得ないところでした。
この課題については、下記サイトを参照ください。