
この課題ではキンヒドロンを題材に、 酸化還元反応と酸化還元電位(ORP。oxidation reduction potential)の測定を扱うことになります。 当初は自作の電極(銅/硫酸銅)を用いマルチメーターで ORP の測定を行っていましたが、 いろんな溶液を手軽に測ってもらおうと、教育環境改善経費の手当てを受けて、 2011 年度後期からお手軽な ORP メータ(HANNA HI-98120「高機能 ORP/°C テスター」)を導入しました 。

|
| 図 1. マイクロスコープで見たキンヒドロンの結晶。 |
キンヒドロンはヒドロキノンとベンゾキノンの 1:1 の分子間化合物で、 しばしば「海苔状」と称されますが、図 1 に示すような黒褐色の針状結晶で、 ヒドロキノンとベンゾキノンが水素結合で交互に連なった リボン状の分子鎖からなる結晶構造を持ちます。 結晶中でこの水素結合で結ばれたリボンは平行に積み重なる形でパッキングされ、 ヒドロキノンとベンゾキノンの間でいわゆる電荷移動(Charge Transfer あるいは 電子受容-供与 Electron-Donor-Acceptor)型の相互作用が起き、 それが結晶の独特の深い色合いを演出しているようです。 なお溶液中で 1:1 の安定な錯体の形で溶存しているわけではありません。
さてキンヒドロンは室温で水に 0.4 mass% 程度溶けるだけです。 一方ヒドロキノンは水にやや溶けやすく(7 mass%)、ベンゾキノンはやや溶けにくいものの 1.5 mass% ぐらい溶けます。 ですから溶液中でヒドロキノンを酸化してベンゾキノンにする、 あるいはベンゾキノンを亜硫酸水素ナトリウムなどで還元してヒドロキノンにすると、 仕込みの濃度によっては途中でキンヒドロンの結晶が析出してくることになります。
実験ではヒドロキノン 1.8 mmol に塩化鉄(III) FeCl3 2 mmol を加えて酸化します。 両者の溶液を混合した時点の濃度は、ヒドロキノン、塩化鉄(III) ともに 0.3 mol/L 程度です(図 2a)。 この溶液を加熱すると、褐色がかってきて色はどんどん濃くなり(図 2b)、 冷やすとキンヒドロンの結晶が析出してきます(図 2c)。 あとは析出してきたキンヒドロンを分取すればよいわけです。 草創期の入門化学実験では 30 mL のポリ細口瓶に穴をあけた手作り吸引瓶にロートを差し込み、 目皿(ボタン)を用いた吸引ろ過を行っていました(図 2d)。

|

|

|

|
| 図 2a. ヒドロキノンの溶液にに塩化鉄(III) 溶液を加えたところ。 | 図 2b. ヒートガンで軽くあぶる程度に加熱すると、 溶液は黒褐色になっていきます。 | 図 2c. 析出してきたキンヒドロンの結晶。 | 図 2d. 入門化学実験草創期の吸引ろ過装置。 手作り吸引瓶にロートを差し込み、 目皿を用いて吸引ろ過を行いました。 |
|
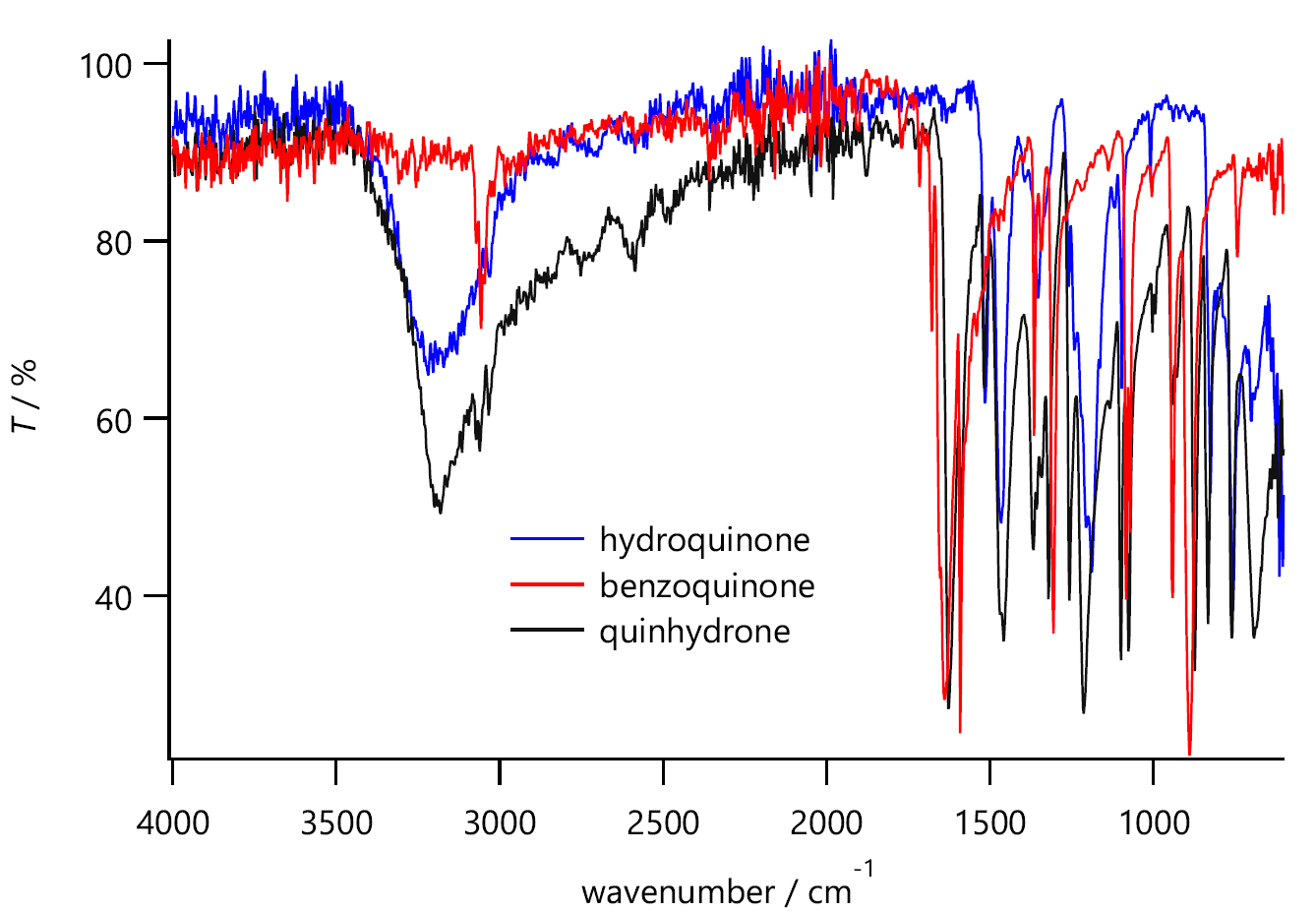
| 図 3. ヒドロキノン(青)、ベンゾキノン(赤)とキンヒドロン(黒)の赤外吸収スペクトル (ATR 法による測定。日本分光 FT/IR-410)。 |
当初は赤外吸収スペクトルを取るようにしていました。 図 3 に示すように、 キンヒドロンの赤外吸収スペクトルは、単純にヒドロキノン(青線)とベンゾキノン(赤線)を足して2で割ったようなものにはなりません。 キンヒドロンの結晶中では、分子鎖が C-OH…O=C という形の強い水素結合で結ばれており、 2200 ~ 3300 cm-1 ぐらいにかけて O-H 伸縮振動に関わる吸収が強く現れています。 また 1650 cm-1 付近のカルボニル基 C=O の吸収に注意すると、 キンヒドロンでは若干、ベンゾキノンより低波数側に出ます(このあたりは Gaussian を用いた電子状態計算からも予測されるところで、担当の今城さんの力の入る所でした)。 さらに C=O の吸収はベンゾキノンではおよそ2本に分かれていたのが、キンヒドロンでは1本になっています。 興味のある人は、赤外吸収スペクトルを取ってみることをお薦めします。
さてこのヒドロキノンの塩化鉄(III) による酸化によるキンヒドロンの合成ですが、 実験に即して反応系を少し「理想化」して具体的に考えてみましょう。 溶液の体積を V とし、キンヒドロンの析出や反応にともなう変化を無視します。 最初、溶液中にヒドロキノン H2Q のみが濃度 [H2Q]0 で存在し、 それが zV だけ酸化されてベンゾキノン Q になるものとします(キンヒドロンができなければベンゾキノン濃度 [Q] は z)。 反応が進み、ヒドロキノンとベンゾキノンの濃度の積 [H2Q] [Q] が ”溶解度積” Kq を上回るようになると、キンヒドロンが析出してきます。 キンヒドロンの溶解度(0.4 mass%)から、Kq はおよそ 3.5 × 10-4 mol2 L-2 です。
最初のヒドロキノンの濃度 [H2Q]0(式中では面倒なので c とします)が 2 Kq1/2 ∼ 0.04 mol/L(0.4 mass%)であれば、 キンヒドロンは生成しませんが、ヒドロキノンの初濃度がこれより高ければ、 キンヒドロンが析出してきます。 酸化反応が進行してヒドロキノン濃度が減少し z が増加するにしたがって
Kq = [H2Q] [Q] = z± (c - z±)
z± = (1/2) [c ± (c2 - 4 Kq)1/2)]
となる z± で、キンヒドロンの析出が始まり(z = z-)、 ヒドロキノン濃度が減少して析出したキンヒドロンが再び溶解する(z = z+)ことになります。 反応の進行がこの中間 z- < z < z+ にあれば、 生成するキンヒドロンの量 yV は次式を解くことで得られます。
Kq = (z - y) (c - z - y)
図 4a には、ヒドロキノンの初濃度 c = [H2Q]0 が 0.2 mol/L(実線)と 0.1 mol/L(点線)の場合について計算した、 それぞれの物質量の変化を示します。 反応が進行するにつれキンヒドロンの析出が起きるわけですが、 析出が起きるのは [H2Q]0 = 0.2 mol/L の時には z = 0.002 mol/L の時、 [H2Q]0 = 0.1 mol/L だと z = 0.004 mol/L の時で、グラフの上ではほとんど分かりません。 そしてキンヒドロンの量は z = [H2Q]0/2 の時に最大となり、 その後は酸化の進行とともに減少に転じます。 また当然ですが、キンヒドロンの量が最大となる時、 ヒドロキノンとベンゾキノンの濃度は等しく(Kq1/2 ∼ 0.02 mol/L)、ヒドロキノンの初濃度によらずに一定です。 なおベンゾキノン Q は 0.13 mol/L ぐらいまでしか溶けませんが、 ここではベンゾキノンの析出は無視して扱っています。
図 4a の物質量の変化にともなう、電位の変化も興味深いものがあります。 ベンゾキノン Q /ヒドロキノン H2Q の酸化還元反応
Q + 2 H+ + 2e- ⇌ H2Q
の還元電位 E は水素イオン濃度の寄与を無視すると(pH = 0 とします)、およそ次式で表されます:
E - E0 = (2F/RT) ln [Q][H+]2/[H2Q] ≈ (30 mV) log [Q]/[H2Q] (pH = 0 とする)
図 4b には、種々のヒドロキノンの初濃度について、 反応にともなう電位変化の計算値を示しました。 キンヒドロンの生成が極大となる付近で、 反応にともなう電位変化が大きくなり、 少々の電位変化でも、キンヒドロンの生成量に変化がないことが分かります。 またそれはヒドロキノンの初濃度が高いほど顕著です。 また酸化剤である鉄(III) を考えるとその ORP は反応の進行とともに減少していきます (Fe3+ の初濃度を [Fe3+]0 = [H2Q]0 = c とします)。
E - E0 = (F/RT) ln [Fe3+]/[Fe2+] ≈ (60 mV) log (c - 2z)/2z
図 4b にはこの Fe3+/Fe2+ の電位の変化の様子も示しました(図中、青い点線)。 両者の電位が等しくなるところで平衡に達するわけですが、 ヒドロキノンの初濃度を高くしておけば、当量点近傍での電位変化が大きいので、 少々ヒドロキノンと鉄(III) の量比が違っても、 高収率でキンヒドロンが得られることが分かります。 もっとも Fe3+/Fe2+ の標準還元電位はベンゾキノン/ヒドロキノンの標準還元電位より、 (0.07 + 0.06 × pH) V ほど高く、pH 1 程度であればこうしたことを考えなくとも Fe3+ による酸化は十分進行します。 逆に Fe2+ による強酸性でのベンゾキノンの還元の際には、こうした考察が大事になってきます。

|

|
| 図 Xa. キンヒドロンができたか、黒ずんだベンゾキノン。 | 図 Xb. 再結晶したベンゾキノン。復活! |
|
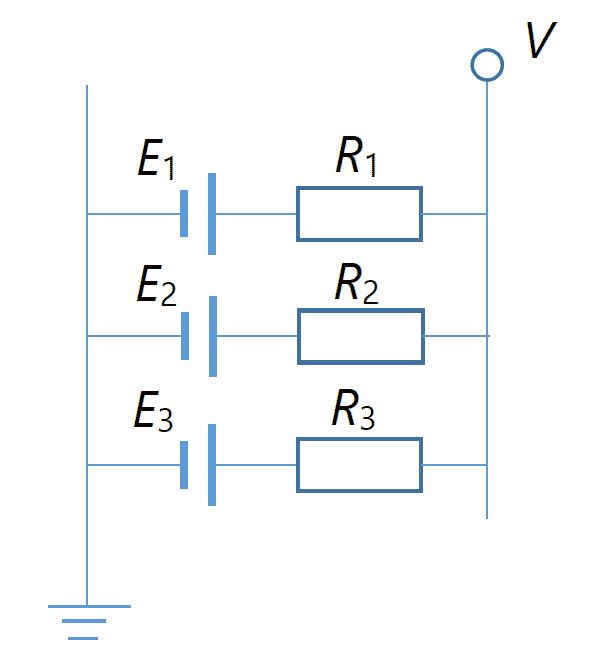
| 図 5. 複数の酸化還元反応が起きる場合の電極電位の電気回路によるイメージ図。 |
この実験ではイオン交換水や水道水などの酸化還元電位(ORP。oxidation redaction potential、redox potential)を測るなど、 ちょっと人を小ばかにしたような測定をやってもらいます。 こうした測定をやるについて、まず心しておいてもらいたいのは、 ORP の測定では極めて微弱な電流(典型的には nA 以下。理想的には 0)を問題にしているということです。 ファラデー定数は 105 C/mol 程度ですから、数分電流を流し続けても、 電極で生成する酸化/還元物は 10-12 mol 以下と考えてよく、とても目で見える量にはなりません。 ですから溶液中のわずかな成分、電極に付着したわずかの汚れなどが大きな影響を与えます。
さらにもう一つ見ておきたいのは、一般に多数の酸化還元反応が電極で起き得るということです。 塩化鉄(III) の溶液といっても、空気中の酸素が溶け込んでいて、酸素の還元反応が起きるかもしれません。 あるいは不純物としてマンガンなどが含まれていることもありえます。 そうした多数の酸化還元反応から生まれる電位 V を、 図 5 に示すような、それぞれ内部抵抗 Rk を持つ起電力 Ek の電池の並列回路だと考えてみましょう (同様の設定は熱電対線を並列につないで、熱接点を異なる温度にしても現れます。 クイズ参照)。 それぞれの電池を流れる電流を ik とし、話を具体的にするため電池は 3 コであるとします。 するとキルヒホッフの法則から、次の式が成り立ちます。
i1 + i2 + i3 =0
V = E1 + R1i1 = E2 + R2i2 = E3 + R3i3
この関係式から、抵抗の逆数であるコンダクタンス G = 1/R を使って、 観測される電位 V を表すと、次のようになります:
V = (G1E1 + G2E2 + G3E3)/(G1 + G2 + G3)
つまりコンダクタンスの大きい(起きやすい)酸化還元反応の起電力が、測定される電位 V に大きく反映されます。 また酸化還元反応を起こす物質の量が多ければ、いわば並列結合の電池の数が多いわけで、 コンダクタンスが大きくなって同様に測定される電位に大きく反映されます。 キンヒドロン電極では、ベンゾキノンとヒドロキノンの酸化還元反応が速やかに起き、 また両者の濃度が 20 mmol/L 程度あるので、 安定な電位が得られるわけです。

|
| 図 6. 簡易 ORP 計(HANNA HI-98120)を用いた、希薄溶液の ORP 測定。 黄血塩 K4[Fe(CN)6] の溶液を滴下するところ。 |
実験では市販の簡易 ORP 計(HANNA HI-98120)を使って、酸化還元電位 ORP を測ってもらいます。 この ORP 計は参照電極に Ag/AgCl 電極を使っていて、起電力は標準水素電極(SHE)に対し約 200 mV というところです。 また白金電極を使用しているようで、この白金電極表面での酸化還元反応を調べることになります。
まずビーカーにイオン交換水(DIW。deionized water)をとって測り、次に水道水(TP。tap water)、 そしてまたイオン交換水という順に測ってもらいます(図 5a)。 イオン交換水であれば、何も溶けていないと考えられるので、 ORP は不安定な値になりそうです。 実際かなりばらつき、少しかきまぜただけでも変化するのですが、最初は +100 ~ +400 mV ぐらいになることが多いです。 これは最初に電極表面に付着、吸着していたであろう微量物質の ORP ということになるでしょう。 次に水道水を測ると、やはりばらつきは大きいですが、塩素分が含まれているため、およそ 300 mV ほど電位が上がります。 そこで水道水を捨て、再びイオン交換水を測ると、ばらつきは大きいですが、最初に測った時より ORP が 100 ~ 200 mV ぐらい上がります。 同じイオン交換水を測っているのに、電位が変わるのはいささか奇妙です。 測定前にイオン交換水で洗浄してもらっているわけですが、 その程度では電極表面に吸着された水道水中の塩素分などの影響は除かれないようです。 同様に亜硫酸ナトリウムなどの溶液を測った後に測ると、水道水がマイナスの値を示すことも珍しくありません。 「おいしい水」を判定するのに ORP を持ち出す向きもありますが、 こうした事情をよく踏まえて判断する必要があります。
この ORP の測定値のばらつきは興味深いところです。 イオン交換水は「何もない」わけで、それに比べれば水道水には塩素分があり、安定した値を与えてくれてよさそうです。 それが安定しない原因は、その塩素濃度にあるようです。 水道水の塩素濃度は、せいぜい 10-5 mol/L(水道法で残留塩素濃度は 0.1 ~ 1 mg/L)で、 電極表面付近の濃度がなかなか平衡に達せず、ORP が安定しないのでしょう (分子拡散は濃度勾配に比例するので、希薄なほど時間がかかります)。 実験ではシャバシャバと ORP 計で振り混ぜ、1 分もしないうちに ORP の値を読み取っているわけですが、 もっと攪拌して長く待てば安定した値になるでしょう。
次いで実験では、1 mol/L の塩化鉄(III) FeCl3 溶液、0.5 mol/L の硫酸鉄(II) 溶液を、1 滴加えて ORP を測るという操作を行ってもらいます。 1 滴はおよそ 0.05 mL で、液量は 50 ~ 100 mL というところですから、鉄(III) Fe3+、鉄(II) Fe2+ の濃度は、 数 mmol/L のオーダーになります。 最初に FeCl3 溶液を 1 滴入れた段階で ORP は大きく上昇し +600 mV ぐらいになります。 単純に考えると Fe+2 が存在しないのだから(E0 + 0.06 V log [Fe+3][Fe+2])、 ORP はもっと大きな値になってよさそうですが、そもそもの FeCl3 溶液に鉄(II) が少しは含まれているのでしょう。 ここに硫酸鉄(II) FeSO4 溶液を滴下すると、ORP の値は安定し、およそ 500 mV になります。 そしてこの後、塩化鉄(III) FeCl3 と硫酸鉄(II) FeSO4 溶液の滴下について、 ORP の値はあまりばらつかず(グループ間の差は ±10 mV ぐらい)、[Fe3+] ≈ [Fe2+] では、およそ 480 mV ぐらいの落ち着いた挙動を示します。
Fe3+/Fe2+ の標準還元電位(標準水素電極 SHE に対する電位)は +771 mV(25 °C)とされています。 ここでえられた 480 mV という値は、Ag/AgCl 参照電極の電位が 200 mV として SHE に対して 680 mV で低すぎます。 これは鉄(III) Fe3+ の活量が、Fe(OH)2+ などが生成して、大きく減少しているためであると考えられます。 [Fe3+]/[Fe2+] ≈ 30 ぐらいになっているとすれば、90 mV の低下は説明できます。 水酸化鉄(III) の溶解度積を参照すると、pH が 3 程度なら [Fe3+] < 10-6 mol/L、 pH 2 なら[Fe3+] < 10-3 mol/L ぐらいです。 数 mmol/L 程度のオーダーの溶液で、 水酸化鉄(III) の沈殿ができるかできないかぐらいの状況と考えると [Fe3+]/[Fe2+] ≈ 30 というのは妥当なところでしょう。
図 7b には、赤血塩 K3[Fe(CN)6]、 黄血塩 K4[Fe(CN)6] のいずれも 0.1 mol/L の溶液について、 塩化鉄(III) - 硫酸鉄(II) と同様の実験をしてもらった結果を示します。 赤血塩と黄血塩がほぼ等量の緩衝性の高い領域で ORP はおよそ 170 mV ぐらい、標準水素電極(SHE)に対し 370 mV ということになります。 [Fe(CN)6]3-/[Fe(CN)6]4- の標準還元電位は +358 mV(25 °C)とされているので、 今度は 10 mV ほど高すぎます。 簡易 ORP 計の精度や濃度が低くて測定値が不安定な影響も考える必要がありますが、 関与する還元型のイオン [Fe(CN)6]4- の電荷が、酸化型のイオンの電荷 -3 より負で大きく、 活量の低下が大きいためとみることができます。 扱っているのが、1 滴垂らしただけの千倍希釈溶液で希薄な溶液と考えがちですが、特に電荷の大きなイオンを扱う場合、 十分濃い溶液として振舞うので注意が必要です。

|
| 図 8. pH 標準液で調製したキンヒドロンの溶液。 左から pH 1.7、4.0、6.9、9.2。pH が高いほど色は濃く、空気酸化のためか時間がたつにつれ色は濃くなっていきます。 |
|
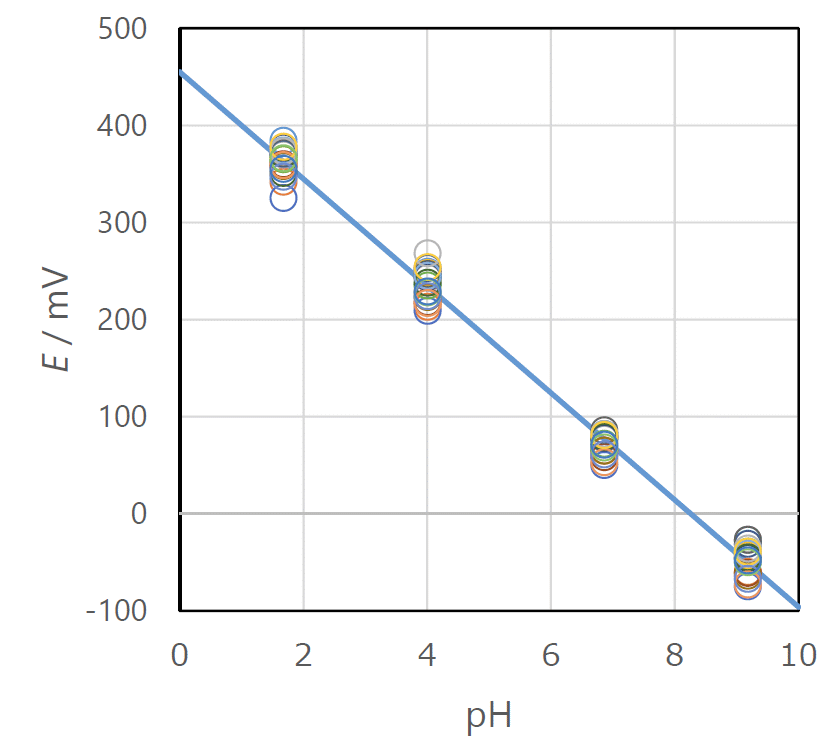
| 図 9. 種々の pH 標準液におけるキンヒドロンの ORP の測定結果。 2015 年度の 19 グループの結果を表示。 E / mV = 455 - 55 pH |
キンヒドロンの溶液の酸化還元電位は、古くから pH の測定に利用されてきました (キンヒドロン電極は土壌の pH の測定などに簡便に使用できるものとして見出され、 昔は考案者の名前を取ってビールマン Biilmann 電極とも呼ばれていたようです)。 ここではそれを逆に、酸化還元電位の pH 依存性を調べる形で実験します。
酸化還元電位 ORD の測定に使用するキンヒドロン溶液の調製は、 キンヒドロンの粉末をパラパラと測定溶液(pH 標準液)に入れて、振り混ぜればよいだけということにしています。 条件を一定にするには溶け残りがあるぐらいがよいのですが、あまりこだわらなくていいでしょう。 pH の標準液は年度初めに調製しストックしてあるので、手間がありません。 pH の高い標準液、特に pH 9.2 の標準液のキンヒドロン溶液は、置いておくと色が濃くなっていきます。 これはヒドロキノンが空気酸化を受けるためのようです。 ORP の測定への影響が心配されますが、目立った ORP への影響は見られません。
テキストの方には、簡易 ORP 計を用いた最初の年(2011 年度後期)の結果を紹介していますが、 図 9 に 2015 年度前後期の結果を紹介しておきましょう。 だいたい期待される ORP の挙動が得られていますが、少し定量的に検討すると問題があります。 まず ORP の pH に対する勾配が 55 mV ぐらいで(2011 年度は 54 mV)、ネルンスト式から期待される 59 mV(25 °C。20 °C とすると 58 mV)より 5 % 程度低めに出る傾向があります。 pH 9.2 の結果はキンヒドロン電極による pH 測定の限界(おおむね pH 8 ~ 9 とされます)を超えているのですが、 これを除外しても勾配はあまり変わりません。 原因がよくわかっていませんが、ORP 計の液間電位差に問題があるのかもしれません。
また 2015 年度については ORP の値が 20 mV ほど低めです(pH = 4.01 の値が 260 mV 位になって欲しいところが、240 mV ぐらい。2011 年度は 270 mV ぐらい)。 これは ORP 計の参照電極の電位が増大している(Ag/AgCl 電極の KCl 濃度が下がっている)ためだと思われます。 簡易 ORP 計なので、このあたりは不問に付してよいでしょう。

|
|
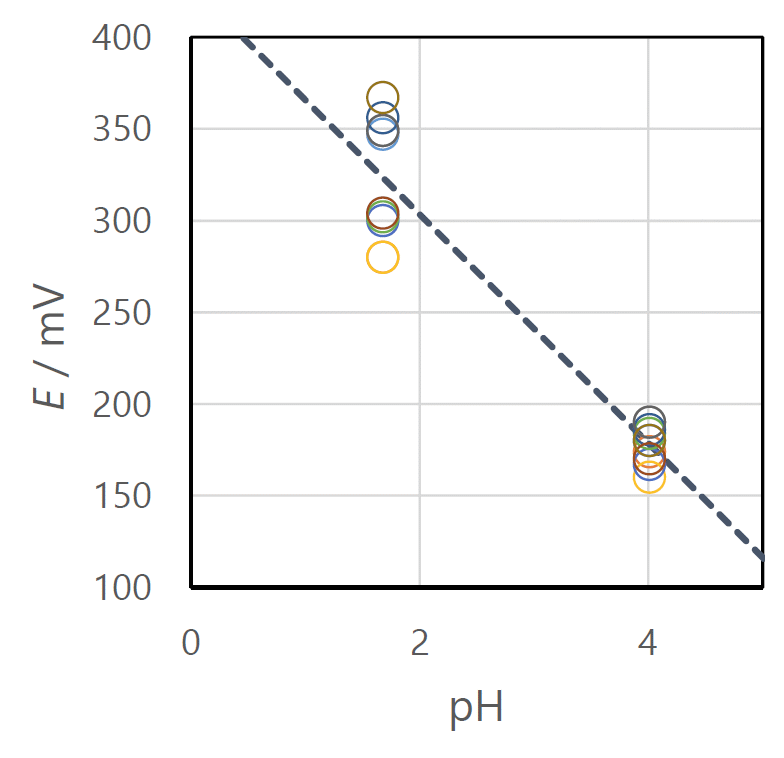
| 図 Ya. 手作りの Cu/CuSO4 電極。 | 図 Yb. 電位の pH 依存性の 10 グループによる測定結果。pH 4.0 と pH 1.7 の緩衝液のキンヒドロン溶液の電位。 図中の点線は最小2乗法で引いた直線。 |