 (3-1)
(3-1)
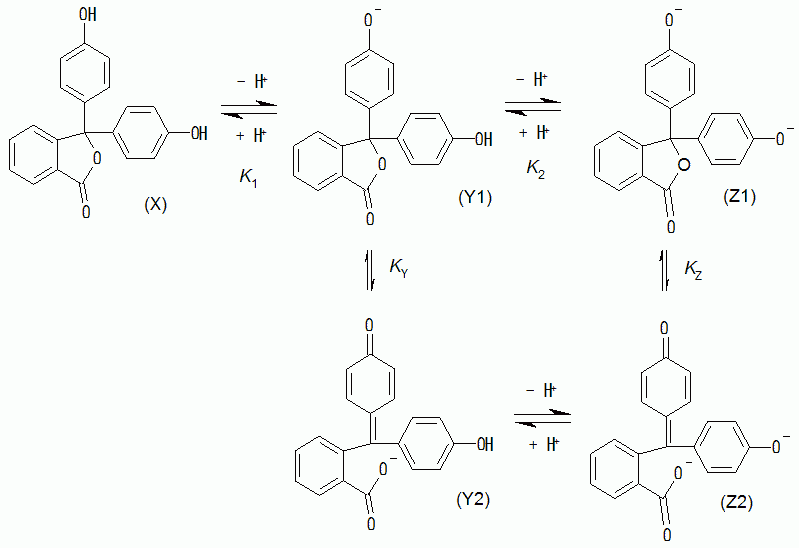
先の(1-1)式のようにHX ⇔ H+ + X- といった抽象化した化学式で書く分には単純ですが、 実際にHX、X- がどのような構造なのか等については、必ずしも明らかになっているわけではありません。 また発色に関わる分子種を特定することもしばしば困難です。 皆さんよくご存知のフェノールフタレインについても、文献にあたるといろいろ混乱があります。 今日おそらく一般に受け入れられている、フェノールフタレインが無色から赤色に変色する際の解離平衡は下図のようなものです。
 (3-1)
(3-1)
分子種が5つあって複雑そうに見えますが、水素イオン濃度に対する依存性に注目すると、X、Y(= Y1 + Y2)、Z(= Z1 + Z2)の3種で次のような関係が成立します。
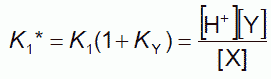 (3-2)
(3-2)
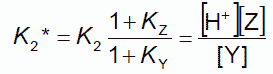 (3-3)
(3-3)
この平衡定数 pK1* と pK2* が近接した値をとるので(キャピラリー電気泳動を用いた最近の研究では8.8と9.4)、 この解離は水素イオン濃度の変化とともに、ほぼ連続的に一段で起きるものと見なせます。
この中のY2、Z2というキノン型の分子種が、赤色を示す本体ですが、 それとラクトン型の異性体Y1、Z1との間の平衡は速く、それぞれを取り出して議論することにあまり意味はありません (フェノールフタレインはさらにアルカリ性を強くすると水酸化物イオンが付加して無色になります(pH > 13)。 またゆっくりした分解反応が起きるようで、pHを変化させた時完全に色が戻りません。 フェノールフタレインの変色は小学校で習いますが、その内実はかなり複雑です)。
同様のことは今回取り扱ったブロモフェノールブルー(BPB)についても言えます。 テキストなどには BPB は pH 4付近で次のような平衡にあると書いてあったりします。
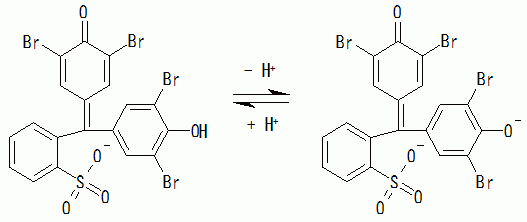 (3-4)
(3-4)
でもこの式からは、大きな吸収スペクトルの変化が起きるようには見えません。 この左辺の酸型の分子は次のように環状構造(サルトンsultone。ラクトンの親戚)との平衡にあると見なすことができます。
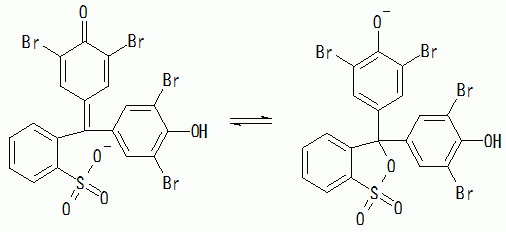 (3-5)
(3-5)
この環状構造の分子が、実際のBPBの酸型では主要な分子種になっているために、吸収スペクトルが大きく変化すると思われます。 フェノールレッド(PR)についてもこれと同様の平衡を考えることができます。