|
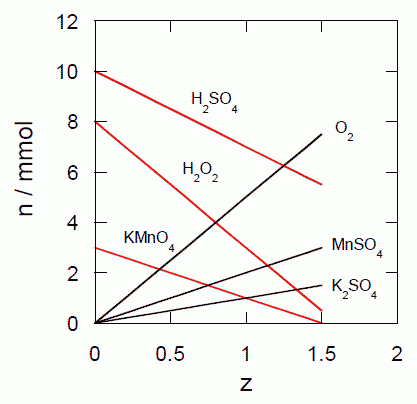
図 1.1. 過マンガン酸による過酸化水素の酸化における、反応物・生成物の物質量の変化。 |
化学反応式(反応式。chemical reaction formula)が化学変化一般を表す式であるのに対し、 化学反応方程式(反応方程式あるいは化学方程式。 chemical (reaction) equation)は反応物と生成物の間の釣り合いを表す式です。
一般に化学反応方程式は次のように書くことができます:*
∑ ri Ri → ∑ pi Pi (1.1)
ここで ri, pi はそれぞれ反応物 Ri、 生成物 Pi の化学量論係数(あるいは単に量論係数)と呼ばれるもので、 それぞれの化学種の物質量を n(Ri)、n(Pi) とすると次のような関係式が成立します。
n(Ri) = n0(Ri) - ri z (1.2)
n(Pi) = n0(Pi) + pi z (1.3)
ここでn0(Ri)、n0(Pi) は、 それぞれ反応物、生成物の反応初期における物質量で、 z は反応進行度(extent of reaction あるいは advancement)と呼ばれる量です。 量論係数を負にも拡張して、表記を下記のように簡略化することもできます。
0 → ∑ νi Xi (1.4)
n(Xi) = n0(Xi) + νi z (1.5)
化学種 Xi の量論係数 νi が正なら生成物、 負なら反応物になるように、 (1.4) 式は右辺に片寄せて表記してあります。
反応進行度(あるいは化学反応方程式)の意味するところをはっきりさせるために、具体的なケースを取り上げましょう。 ここでは次の過マンガン酸カリウムによる過酸化水素の酸化反応を考えてみます:
2KMnO4 + 5H2O2 + 3H2SO4 → 2MnSO4 + K2SO4 + 8H2O + 5O2 (1.6)
水 10 mol に、過酸化水素 8.0 mmol と硫酸 10.0 mmol を溶かした溶液が入っていたものとしましょう。 ここに過マンガン酸カリウム 3.0 mmol を加えると(1.1)式に従って反応が起き、酸素が発生します。 反応進行度が z mmol の時、それぞれの化学種の物質量は次のように与えられます(単位はmmol):
| KMnO4: 3.0 - 2z | H2O2: 8.0 - 5z |
| H2SO4: 10.0 - 3z | MnSO4: 2z |
| K2SO4: z | H2O: 10×103 + 8z |
| 5O2: 5z |
この変化の様子をグラフにしてみたのが図 1.1 です。 反応進行度の増加と共に、反応物、生成物の量が直線的に変化して行き、 過マンガン酸カリウムが完全に消費される(z = 1.5)と、反応はそれ以上進行しません。 それぞれの直線の勾配が化学量論係数に対応しています。

|
図 1.1. 過マンガン酸による過酸化水素の酸化における、反応物・生成物の物質量の変化。 |
最初に存在する反応物・生成物の量が分かっておれば、 ある化学反応に従って反応物・生成物の量がどのように変化するかを知ることは、 反応進行度 z を知ることに帰着します。 あるいは、化学反応方程式の量論係数は、 z を与えた時、それぞれの化学種がどれだけ変化するかを与える因子ということになります。 この量論係数をどのように決めるのかが、このお話で問題としようとすることです。 そしてそれには、(1.1) 式などでは Ri や Pi といった抽象的な記述に止まっていた化学種を、 (1.6) 式中の KMnO4 などのように、その化学組成(元素組成)のレベルで記述することが必要になります。
*
IUPAC の物理・生物物理化学部会は、化学反応式の記号として、量論関係を示す場合には「=」、
一方に進行することを表す場合に「→」、
正逆ともに起きることを表す場合には
「![]() 」、
化学平衡を表す場合には「
」、
化学平衡を表す場合には「![]() 」という記号を用いることを推奨しています
(Quantities, Units and Symbols in Physical Chemistry(The Green Book)
。
現行は
第3版
です)。
今回のお話では、「化学反応が進行する」ことを強調する意味で、化学反応方程式の記号に「→」を使用しています。
」という記号を用いることを推奨しています
(Quantities, Units and Symbols in Physical Chemistry(The Green Book)
。
現行は
第3版
です)。
今回のお話では、「化学反応が進行する」ことを強調する意味で、化学反応方程式の記号に「→」を使用しています。
ちなみにIUPACの化学用語集(
IUPAC Compendium of Chemical Terminology(The Golden Book)
)
のchemical reaction equationの項では、正逆ともに起きることを表す場合について、逆向きの
「![]() 」という記号を推奨しています。
」という記号を推奨しています。