last revised 2023.7 / 2020.5
吉村洋介
トリフェニルメタノールの合成
テキストの pdf 版はこちら。
カルボニル化合物と求核剤との反応は、最も一般的な有機反応のひとつであり、有機合成上非常に有用である。
また、有機合成においては、炭素求核剤となる有機金属試薬は不可欠とも言える存在である。
そこで今回は、酸触媒によるカルボン酸のエステル化反応、および、有機金属試薬として最も一般的であるGrignard反応剤の調製とそれを用いた反応を行う。
これらの合成実験を通じて、カルボニル化合物の反応性やGrignard反応剤の性質を学ぶとともに、減圧蒸留、無水条件での実験操作などの技術も修得する。
2-1. 安息香酸メチル (methyl benzoate)
[1日目]
100 mL のナスフラスコに安息香酸 20.0 g(1.0当量)とメタノール 50 mL を入れ、続いて約0.3当量の濃硫酸(注1)を加えて混合する。
ジムロート冷却器を取り付け(注2)、マグネチックスターラーを用いて撹拌しながら、オイルバスを用いて穏やかに還流する。
反応の途中、進行状況を確認するために、約15分後ごとにTLC(薄層クロマトグラフィー)によって分析する(固定相:シリカゲル、移動相:ヘキサン/酢酸エチルの混合)(注3)。
TLCにより反応の進行が停止したことを確認した後、反応溶液を室温まで冷やし、水100 mLを入れた分液漏斗に移す。
ヘキサン 75 mL でフラスコの壁面を洗い、洗液を分液漏斗に入れて抽出する。ヘキサン層を5%炭酸水素ナトリウム水溶液 50 mL × 2 で洗浄し(=分液漏斗で振る)、
未反応の安息香酸を除去する。有機層を三角フラスコに移し、無水硫酸ナトリウムを適量加えて乾燥する。
乾燥剤をろ別した後、ヘキサンをロータリーエバポレータで留去する。
[2日目]
得られた残渣は、50 mLナスフラスコに移しかえた後、ダイヤフラム真空ポンプを用いた減圧蒸留により精製し、純粋な安息香酸メチルを得る(注4)。
蒸気の温度が一定になったところで受器をかえて集める(受器の風袋を測定しておく)。収量約 16 g。
安息香酸及び安息香酸メチルのIR測定を行う。翌日の実験で調製するGrignard反応剤は含水条件下で調製・使用ができないので、用いるガラス器具を全て乾燥機へ入れ、帰宅する。
2-2. フェニルマグネシウムブロミド (phenylmagnesium bromide)
[3日目]
本実験では、ガラス器具のすり面の癒着のおそれがあるため、ガラス器具のすり面に薄くグリース(ワセリン)を塗る(注5)。
次の実験 2-3 で用いる安息香酸メチル 5.0 g が 1.0当量となり、以下はそれに合わせて試薬をはかり取る。
ジムロート冷却器と滴下漏斗(共にシリカゲルを詰めた塩化カルシウム管を付けて使用する)を付けた 200 mL の三つ口フラスコに
回転子と削状マグネシウム2.5当量と脱水テトラヒドロフラン(THF)10 mL をフラスコに入れる。
ブロモベンゼン 2.5当量を脱水テトラヒドロフラン40 mL に溶かした溶液を滴下漏斗に入れ、この溶液約10 mL を上記フラスコに滴下した後、
ドライヤーで加熱し反応を開始させる(注6)。
反応の開始を確認したら、残りのブロモベンゼンのテトラヒドロフラン溶液を反応溶液の沸騰が穏やかに持続する程度に少しずつ滴下する。
滴下終了後マグネシウムの消費がおさまるまで撹拌し、次の実験に移る。
2-3. トリフェニルメタノール (triphenylmethanol)
2 で得られたフェニルマグネシウムブロミドのテトラヒドロフラン溶液のフラスコを氷浴で冷やしながらマグネチックスターラーで撹拌する(注7)。
このフラスコに取り付けた滴下漏斗に安息香酸メチル 5.0 g(1.0当量 36.7 mmol)と脱水テトラヒドロフラン15 mL を入れて均一の溶液とし、
フェニルマグネシウムブロミドのテトラヒドロフラン溶液へ少しずつ滴下する。滴下終了後、1時間程度加熱還流する。還流を終えたら一晩室温で放置する。
[4日目]
三角フラスコに1 mol/L硫酸50 mLと氷約25 gを入れ、粥状になった反応生成物をゆっくりと注ぎ入れて撹拌しマグネシウム塩を分解する(注8)。三角フラスコの内容物を一旦分液ロートに取り、水層を分取する(有機層は分液ロートに入れたままにしておく)。分取した水層を酢酸エチル10 mLとともに、反応に使用した三口フラスコに加えてフラスコ内に残ったマグネシウム塩を分解し、得られた溶液を再び分液漏斗に戻して先の有機層と一緒にして振った後、有機層を分取する。水層をさらに酢酸エチル20 mLを用いて抽出する。得られた有機層をまとめて、1 mol/L硫酸20 mLで洗浄した後、5%炭酸水素ナトリウム水溶液30 mL、さらに飽和食塩水30 mLで洗浄する。有機層を三角フラスコに移し、無水硫酸ナトリウムを適量加えて乾燥する。乾燥剤をろ別した後、ロータリーエバポレータで、結晶が析出し溶液がなくなるまで溶媒を留去する。得られた粗トリフェニルメタノールは、メタノールから再結晶し(注9)、真空乾燥器で乾燥して精製する。安息香酸メチルに対する収率約70%。トリフェニルメタノールのIR測定を行う。
(注1)濃硫酸の取り扱いには十分注意する。
(注2)ジムロート冷却器に水流チューブを取り付ける際は、針金などを用いてしっかり固定する。
(注3)TLC による分析方法および結果の読み取り方(資料編II-15参照)は、別途説明をする。移動相に用いる溶媒の混合比は、分析する化合物に応じて、各自で検討して決める。
(注4)減圧蒸留の装置については、「続実験を安全に行うために」の12章を参考にし、蒸気温を測定するための温度計は、シーリングテープを巻いて温度計ホルダーでしっかりと固定し、減圧時に真空系に吸い込まれないように注意する。減圧時の沸点は、資料編V-3の計算図を用いて求める。
(注5)実験後にガラス器具を洗浄する前に、すり面のグリース(ワセリン)をヘキサンのしみ込んだキムワイプで完全に拭いとる。
(注6)反応が始まると、反応熱で溶液の沸騰が起こる。反応が激しくなりすぎた場合に備えて、反応容器を氷冷できるようにしておく。
(注7)氷冷すると溶液が懸濁するが、構わず安息香酸メチルの滴下を行う。
(注8)テトラヒドロフランは任意の比で水と溶け合うが、疎水性の有機物や硫酸・塩等の存在下では2相分離が起きる。
(注9)メタノールから再結晶で析出してくるのは、トリフェニルメタノールのメタノール和物Ph3COH・MeOHである。真空乾燥機中80 °C程度で乾燥することでメタノールを除く。
<廃棄物処理>
- 廃液は、水層と有機層を分離し、それぞれ水溶性希薄有機廃液用タンク、有機廃液用タンクに入れる。
- ろ別した乾燥剤は、乾燥剤のみを専用のバケツに入れ、ろ紙はゴミ箱に捨てる。
- ろ過に使用したろ紙は、アセトンで洗浄して有機物を除いてから廃棄する。洗液は有機廃液用タンクに入れる。有機物が取れない場合、そのろ紙は専用のバケツに入れる。
- 三つ口フラスコに残ったマグネシウムやマグネシウム塩は塩酸で溶かしたのちに、水溶性希薄有機廃液用タンクに入れる。
トリフェニルメタノールの合成のこと
Grignard(グリニャー。グリニャールとも呼ばれます)反応は、大学に入って勉強するちょっと”大人の反応”。
また反応機構も、いとも単純な反応に見せることもできますが、
その実とても複雑な要素を含んでいます。
ぼくの考えでは最初に持ってくるには難度の高い反応ですが、
ガツンと歯ごたえのある実験課題に挑戦してもらい、
化学の奥深さに触れてもらうのもいいのかもしれません。
Grignard 試薬の調製
Grignard 試薬は、もっぱらエチルエーテル (C2H5)2O あるいは
テトラヒドロフラン(THF。(CH2)4O)溶媒中で、
金属マグネシウムと有機ハロゲン化物との反応で合成されます。
金属が水素を発生するわけでもなく、
そのまま有機溶媒に溶けていくわけですから、
見方によっては奇妙な反応です。
セットアップ

シリカゲル乾燥管を装置に付けておく。
向かって左側がジムロート冷却器
ここでは THF 中でブロモベンゼンとの反応で臭化フェニルマグネシウム PhMgBr を作るわけですが、
注意すべきは、できるだけ乾燥状態で行うことです。
ただし、どこまで水を除く必要があるかは難しいところ。
神経質になり始めると、息をすることさえためらわれるようになるでしょう。
そこでだいたいどこまで水を除けばよいのか大まかに評価してみると、
今回の実験スケールは反応物の量は 10 mmol 程度になりますから、
水 1 mmol 程度あれば影響を及ぼすと考えてよいでしょう。
そしてどうもこれ以下にしておけば、問題なく反応は進行するようです。
水が厄介なのは、水がわれわれの身の回りにほぼ遍在していることと、分子量が18と小さいこと。
水 1 mmol が問題だというのは、
使用器具に水 0.02 g、半滴程度付いていると問題になるということです。
これまでに経験したところでは、
ジムロート冷却器に水滴が付着しているのを見過ごして失敗したというケースがほとんどです。
ジムロート冷却器は内部に配管がむき出しになっていて、
表面積が大きく冷却効率はよいものの、
その分水滴の付着も起きやすく、実験前に念入りにドライヤーで乾燥させるようにします。
こうしたガラスの表面の水の「濡れ」とともに、水の吸着も問題で、
事前に器具を加熱乾燥しておくようにします。
また通常の有機溶媒は大気に触れさせて置いておくと、少なくとも 0.1 %程度の水を含んでいると考えてよいのです。
つまり特に乾燥操作をしないで実験すると、
今回のような数十mL 程度の実験では、0.01 g 程度の水は含まれるということ。
ですから「乾燥 THF」を使用します。
ただしその乾燥の程度は今回の場合 0.01 %ぐらいで何とかなるようです
(市販の通常の THF をモレキュラーシーブで乾燥させて提供しています。
専門的には「超脱水」と呼ばれる水分 0.001 %、10 ppm のものが市販されていますが、
そこまで必要ありません)。
あるいは 25 °C で湿度を 50 %程度とすれば、
空気 1 L 中にはおよそ 0.5 mmol の水が含まれています。
容器の中に 1 L ぐらいの空気がそのまま流通する状況になると影響が出てくるということです。
ですから心得としては、装置には右図のように、シリカゲル管を付けて湿気の流入を避けるようにします
(今回の場合は反応時間がせいぜい30分程度なのであまり神経質になる必要はありません。
けれども一昼夜加熱し続けるような実験になると問題です)。
また溶媒や試薬を空気中で手早く操作する分には、
今回の場合あまり問題になりません。
マグネシウムとブロモベンゼンの反応
金属マグネシウム(削り状 Turnings。粉末だと反応が激しすぎ、
リボンだと遅すぎるので Grignard 反応用にこういう形で売られている)と脱水 THF をフラスコに入れ、
ブロモベンゼンを脱水 THF に溶かした溶液を滴下して反応させます。
まずは10 mL 程度加えて反応させ、追加投入していく形にしています。
ドライヤーで加熱していると液が少し濁ってきて、
発熱して沸騰が起きるようになります。
この反応を開始させるところで結構手間取る場合があり、
いろんな手法が知られていますが(ガラス棒でマグネシウムをこする。ヨウ素やジブロムエタンを加える)
今回の場合はドライヤーによる加熱で大丈夫です
(そもそも水が入っていてどうしようもないケースはありました。
この場合はいろいろあがくより、最初からやり直すのがよいようです)。
ブロモベンゼンを、溶液の沸騰を維持するぐらいの速度で滴下していくことにしていますが、
どれぐらいの速度が適当なのかは難しいところです。
ぼくは滴下速度が速いとブロモベンゼン濃度が上がって、
ウルツ反応 PhMgBr + PhBr → Ph2 + MgBr2 でビフェニルの生成が起き、
収率が下がると心配するのですが、
経験豊かな TA 諸君からは、大して気にすることないので、
どんどん入れればよいという意見も聞きます。
実際、最終的な収率にはあまり違いがないようです。
最終的にできる Grignard 試薬、臭化フェニルマグネシウム PhMgBr の溶液ですが、
この色合いは人によってずいぶん違います。
「黄味がかった黒灰色」とでもくくっておくのが無難ですが、かなり濃淡に差があります。
また専門家が作ると黄金色の Grignard 試薬が得られるという話を聞いたことがありますが、
どこがちがうのか謎です。
実際、教科書など見ても Grignard 試薬の色の記載は見当たらないようです。
このあたり何かあるんだと思うんですが、お分かりの方はご教示願いたいところです。
できた Grignard 試薬溶液を冷やすと、
黒豆ぜんざい(?)のような懸濁液になってきます。
これは生成した 臭化フェニルマグネシウム PhMgBr が析出してくるためです。
これは溶液を温めるとまた透明な溶液に戻ることから確認できます。
テキストの注(7) にあるように、
次の安息香酸メチルとの反応はろ過などせず、
この懸濁液について行えばよいのです。

|

|

|

|
|
ドライヤーで加熱
|
反応が始まり、反応熱で溶液が沸騰する
|
得られた Grignard 試薬溶液。
これは比較的色の薄いケース。
ほとんど黒くなることもある。
|
冷却してしばらく置くと、
Grignard 試薬の沈殿が生成しているのがわかる
|
安息香酸メチルとのGrignard 反応
氷冷した臭化フェニルマグネシウム PhMgBr 溶液に、安息香酸メチルを滴下し反応させます。
加えていくと赤みを帯びた色が現れ、
臭化フェニルマグネシウム PhMgBr の沈殿が消えていきます。
滴下終了後、この溶液を1時間程度オイルバスで加熱還流すると、
だんだん濁ってきて、黄土色の絵の具のようなものになり
(トリフェニルメタノールのマグネシウムアルコキシド)、
この段階で電源を切り、後は翌日のことということにしています。
この最後の様子はグループにより色や沈殿の量が異なり、
時には沈殿が現れず醤油のようになって終わることもあります。
これまでの経験では、沈殿が現れなくてもトリフェニルメタノールができていないわけではないので、
あまり悲観することはありません。
翌日になると沈殿が出ているケースもあり、
ここは希望をもって翌日の操作に臨んでもらいたいところです。

|

|

|

|
|
安息香酸メチルを加え終わった後。
溶液の色に少し赤みがかっています。
|
安息香酸メチルを加えた後、還流します
|
だんだん濁ってきて、最後はこんなポタージュ風になることが多いです。
|
こんな風に醤油みたいなままで終わることもあります。
経験的には、収率は落ちますが、
ブツは取れているのであまり悲観することはありません。
|
後処理とトリフェニルメタノールの分離精製
翌日になると、反応生成物はたいていの場合、
マグネシウム塩(アルコキシド)と液相に分離しています。
この時の色合いもさまざま。
ほとんど白色もあれば、黄褐色のものもあり、
中には醤油汁のような場合もあります。
醤油汁はゆすっているうちに沈殿ができてくることもあります。
これをかき混ぜて粥状(スラリー、泥漿)にして、
冷硫酸に流し込み、生成したマグネシウム塩を分解します。
この時の注意点は、未反応の金属マグネシウムが残っていると、
水素を発生してフラスコから溢れてくることがあることです。
たいてい大丈夫なのですが、確認を怠らないようにします。
テキストの注(8) にあるように、THF は水と任意の比で溶けあいますが、
ここでは無機塩や有機物などが溶け込んでいるので相分離を起こし、
上層の有機層を分取することになります。
この後、酢酸エチルでさらに抽出操作をした後、
有機層を硫酸で洗浄した後、5%炭酸水素ナトリウム水溶液、さらに飽和食塩水で洗浄します。
硫酸で洗浄するのはエマルジョンなどの形で残っているマグネシウム塩を分解するため、
飽和食塩水で洗浄するのは主にエマルジョンや水を除くためです。
炭酸水素ナトリウム水溶液での洗浄は、硫酸を除くためですが、
この操作を省くと、後でトラブルの元になる(トリフェニルメタノールのメチルエーテルができる)ので忘れないでください。
分液操作が終わると、今度は硫酸ナトリウムで乾燥した後、
エバポレーターで溶媒を蒸発させ、結晶を取り出します。
この段階でえられる結晶は不純物を含んでいて、
少しねばねばしたものになることが多いようです
(中にはほとんどサラサラのものになることもある)。
得られた粗結晶(重さをはかるのを忘れないように!粗収率も大事な情報)はメタノールから再結晶することにしています。
収量にもよりますが、およそ5 g もあれば、
メタノールを50 mL 程度加えてホットプレート上で煮沸する程度に加熱し、
振り混ぜながらメタノールを少しずつ加え、全量溶解させます。
溶解し終えたら、一端室温まで放冷して結晶を析出させ、
その後氷冷してさらに結晶を析出させ、吸引ろ過して結晶を得ます
(再結晶操作の詳細については資料編の「再結晶 による物質の精製」を参照ください)。
メタノールから再結晶して得られる結晶は、
テキストの注(9)にあるように、トリフェニルメタノールのメタノール和物 Ph3COH・MeOH です。
トリフェニルメタノールの結晶には大きな無秩序さ disorder があって、
小分子を取り込む性質があり、
メタノール以外にも DMSO なども包摂化合物を作ることが知られています。
今回の場合、こうしたメタノール和物を作るので再結晶しやすくなっているわけですが、
純粋なトリフェニルメタノールを得るには、包摂されているメタノールを除くための加熱乾燥が必須になります。

|

|

|

|
|
翌日にはこんな感じになっていることが多い。
もっと黄褐色の濃い場合、
醤油汁に白い沈殿が生じている場合など、
結構バリエーションがある。
これを硫酸で処理してアルコキシドを分解する。
|
硫酸で処理してアルコキシドを分解。
2相分離した反応溶液の上層を分取。
|
分取した溶液をエバポレーターで濃縮。
トリフェニルメタノールの結晶が出てくる。
ネトネトの時もサラサラの時もいろいろ。
|
メタノールからの再結晶。
三角フラスコに入れて、ホットプレート上で加熱、
煮沸する程度にして、振り混ぜながらメタノールを加えながら全量を溶解させる。
|
トリフェニルメチルカチオンのことなど

濃硫酸にトリフェニルメタノールを溶かす
トリフェニルメタノールは酸と反応して、
容易にトリフェニルメチルカチオンを生じます。
Ph3COH + H+ → Ph3C+ + H2O
右の写真は濃硫酸にトリフェニルメタノールを溶かしたものですが、
無色のトリフェニルメタノールが赤褐色になるのは、
トリフェニルメチルカチオンを生じたためであると考えられます。
そしてこうしてできたトリフェニルメチルカチオンは、
メタノールと反応して、容易にトリフェニルメチルのメチルエーテルになります
(0.5 mL 程度の濃硫酸に0.05 g程度のトリフェニルメタノールを溶かし、
3 mL程度のメタノールに注ぎ込むとメチルエーテルになるという実験を、
ずいぶん以前に2回生向けの入門化学実験でやっていました)。
Ph3C+ + MeOH → Ph3COMe + H+
このメチルエーテルになる反応は、濃硫酸など使わなくても、メタノール中、
トリフェニルメタノールを少量の硫酸とともに加熱するだけでも起きます。
先に抽出操作で炭酸水素ナトリウム水溶液での洗浄が入っていたのはこのためで、
実際、炭酸水素ナトリウム水溶液での洗浄操作が入っていなかったころには、
1割程度のグループがメチルエーテルを得ていました。
トリフェニルメタノールの合成のはなし
2015年の改定
この課題は古くから実施されてきたのですが(1980年以前に遡る)、
下敷きになっているのは、フィーザー Fieser の「有機化学実験」(第3版)であるようです。
それをスケールアップして実施していたのをスケールダウン、
さらに2015年度から、ほぼ元祖 Fieser のスケールに合わせるとともに、
溶媒のエチルエーテルからテトラヒドロフラン(THF)の転換を行って今日に至っています。
ぼくはこの2015年度の改定に携わりました。
過去の実験スケールを遡って調べてみたところ、下記の表な変遷を経ていることになります。
1981 年には Fieser のスケールを4倍にしたもの(ただしエーテル量はケチっている)が実施されていたのが、
2015年で元の Fieser のスケールにだいたい戻しました。
またこれを調べて分かったのですが、
これまでの実験で、硫酸での後処理の際、
反応混合物が固結してスラリーにならずにみんな苦労していたのですが、
それはどうやらエーテル量が Fieser 指定の量より、1/4 ほど少ないためだったのです。
なお THF 量を多めにしていますが、たぶんもっと減らしても大丈夫。
反応が暴走したら面倒かと、ちょっとビビッて多めにしています。
| Mg/g | PhBr/g | THF/mL | PhCOOMe/g | THF/mL |
|---|
| 2015 | 2.2 (2.5 eq) | 14 (2.5 eq) | 10+40 | 5 (1 eq) | 15 |
|
| Mg/g | PhBr/g | Et2O/mL | PhCOOMe/g | Et2O/mL |
|---|
| 2014 | 4.4 (2.5 eq) | 28 (2.4 eq) | 20+40 | 10 (1 eq) | 25 |
| 2006 | 4.4 (2.5 eq) | 28 (2.4 eq) | 20+40 | 10 (1 eq) | 25 |
| 2003 | 4 | 27 | 20+40 | 10 | 25 |
| 1996 | 4 | 27 | 60 | 10 | 25 |
| 1981 | 8 | 54 | 100 | 20 | 50 |
| Fieser | 2 | 13.5 | 15+25 | 5 | 15 |
エチルエーテルから THF への転換は、加納さんからの指摘で、
揮発性が高く火災の危険のあるエチルエーテルの使用は好ましくないという観点からでした。
特に難しいことはないだろうと考えていたのですが、
実際に THF でやってみるとエチルエーテルとはいろいろ異なる点がありました。
まず Grignard 試薬の調製が非常にスムーズになりました。
エーテルを使っていた時は、ヨウ素を加えたりしないとなかなか反応が行かなかったのが、
ドライヤーで加熱するだけで反応が進行するようになりました。
この5年、ジムロートが濡れていた、
入れる試薬を間違えたといったケース以外で、
Grignard 試薬の調製がうまくいかなかったことはありません。
THF の沸点が高く、より加熱できること、
THF のマグネシウムへの配位能が高く Grignard 試薬が安定であることなどが、
寄与しているのでしょう。
また用いる THF についても、1級試薬の THF をモレキュラーシーブで1週間ほど乾燥すれば十分です。
水素化カルシウムと還流して蒸留など試してもみましたが、
特に御利益はなく、もっと手抜きしていいのかもしれません。
なぜだったかは知りませんが、
以前エーテルの時には、研究室で使う「超脱水」のお高いエーテルを使っていたのですが、
火災の危険も低くお安く上るので万々歳です。
また THF を用いることで収率が大幅に向上しました。
ぼくがやった予備実験でも収率は88%で、当時のエーテルを用いた実験課題の公称収率52%(これは Fieser と同じ数字)を大きく上回りました。
スケールを半分にしたのですが、得られるトリフェニルメタノールの量は2割程度の減に止まるわけです。
収量の向上とも関わりますが THF を用いると副反応が抑えられ、
エバポレータで溶媒を留去するだけでトリフェニルメタノールの結晶が得られました。
エーテルを用いた場合には、エーテルを留去するだけではオイル状のものになってしまい(Fieser によるとビフェニルが相当量できるため)、
ヘキサンを加えないと結晶が得られないところです。
いいことずくめのようですが、THF にしたことで、
安息香酸メチルとの反応が室温一晩放置では完結しなくなりました
(THF のGrignard 試薬への配位能が高いためと思われます)。
そこで従来なかった1時間還流の操作を加えました
(元祖 Fieser では1日で完結させるために還流が入る)。
メタノールからの再結晶
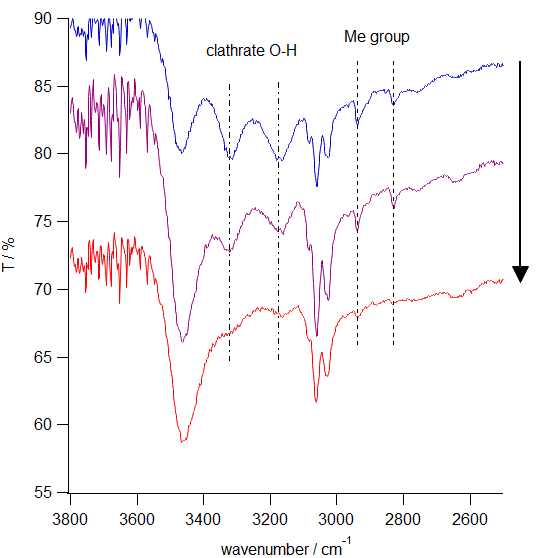
メタノールとの包摂化合物を含むトリフェニルメタノールの IR スペクトル。
乾燥が十分になると、メチル基のC-H伸縮、包摂化合物のO-H 伸縮バンドの吸収が消えていく。
THF への切り替えは問題なかったのですが、せっかくだからと再結晶操作を入れたのが、
いろいろ問題をもたらしました。
トリフェニルメタノールの再結晶溶媒として、いくつか試してみたのですが、
エタノールなどでは溶解度がかなり高く、温度による溶解度変化も小さいようで初心者は苦戦しそうでした。
この点メタノールは溶解度があまり高くなく(沸点付近で 10 wt%程度)、
初心者が使用するには適切かと思われたので採用しました。
ところが実際に実施してみて学生諸君の取った赤外(IR)スペクトルで、
2800 cm-1 ~ 3400 cm-1 に予期せぬ吸収が見られるものが多数あることがわかりました。
整理してみると右図のようにまとめられます。
トリフェニルメタノール単体の赤外吸収に、
2830, 2940 cm-1にメチル基のC-H の対称、反対称の伸縮、
そして 3180, 3320 cm-1 に包摂化合物由来の O-H 伸縮振動が乗っていて、
乾燥の度合に応じて変化していくと考えると解釈できる結果です
(3470 cm-1 はトリフェニルメタノール単体のO-H 伸縮)。
大慌てで文献を調べてみると、
結晶構造まで調べた研究まであり、
不勉強を恥じた次第です。
この初期の実験では真空乾燥器の温度設定が 60 °C でした。
以降は設定温度を上げ、80 °C にして乾燥するようにしたので、
こうした包摂化合物の吸収は学生諸君のレポートにはほとんど見られなくなりました。
けれどもまだ包摂化合物の吸収が散見されるので、乾燥温度を上げた方がいいのかもしれません。
ただトリフェニルメタノールが包摂化合物を生成すること、
またそのことが再結晶を容易にしてくれていることは、
ぼくにとっては大きな発見でした。
メタノールを再結晶に使うようにしたことのもうひとつの問題は、
メチルエーテルが生成することです。
先にも書きましたが、
硫酸で洗浄した後、
炭酸水素ナトリウム溶液での洗浄がないと、
エバポレーターにかけた後の粗生成物に、
若干の硫酸が混入する可能性があります。
わずかな量の硫酸でも存在すると、
メタノール中でトリフェニルメタノールのメチルエーテル化が進行します。
結晶化しにくい性状の違う結晶になるので気づきやすいのですが、
最初は謎めいた現象で頭をひねったものでした。
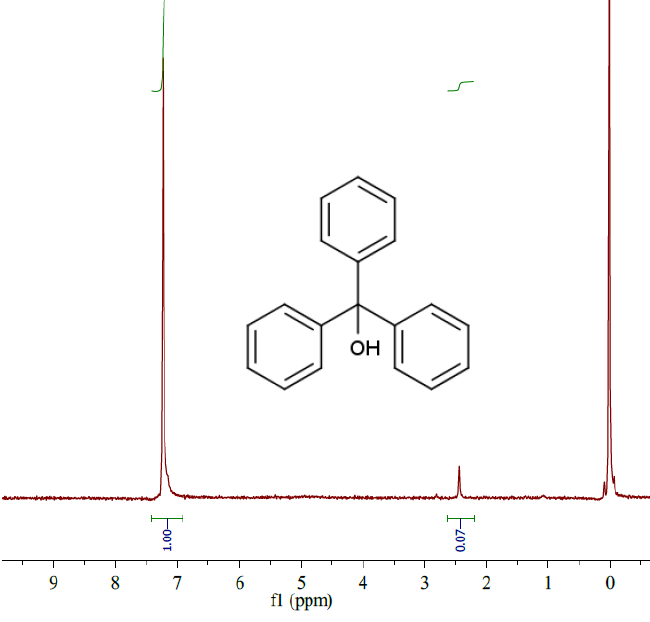
|
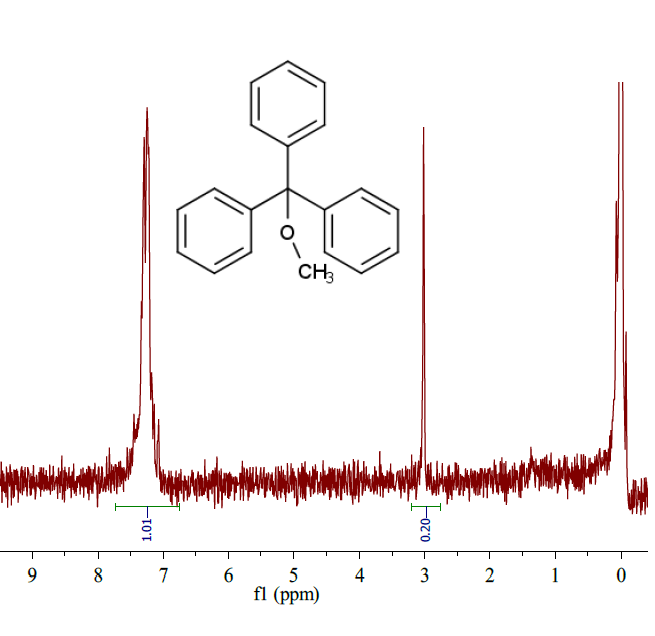
|
|
トリフェニルメタノールの H-nmr。
47 MHz。CDCl3 中。
|
トリフェニルメタノールのメチルエーテルの H-nmr。
47 MHz。CDCl3 中。
|
反応機構のこと
今回の臭化フェニルマグネシウムと安息香酸メチルの反応について、
次のような逐次反応をベースに、
電子を見てきたような矢印を付けたりした絵を描いて見せる人がいます。
PhCOOMe + PhMgBr → Ph2CO + MgBr(OMe)
Ph2CO + PhMgBr → Ph3COMgBr
教科書にもこうしたことが書いてあったりするようです。
でもこれで実際に実験した何が説明できるのか、何を予言できるのか、
冷静に考えてみないといけません。
安息香酸メチルを Grignard 試薬に滴下した時、赤みを帯びた色がでました。
あれは何だったのでしょう。
あるいはこの反応機構を信じれば、途中にできるベンゾフェノンは安息香酸メチルよりも反応性に富むはずですから、
律速段階は最初の安息香酸メチルとの反応の段階です。
では安息香酸メチルを滴下した時、
急速に臭化フェニルマグネシウムの結晶が失われる過程が進行したわけですが、
あれは何だったのでしょうか?
またその後の還流でようやくとマグネシウム塩が析出してくるわけですが、
それまで何が起きているというのでしょう?
反応物と生成物を結びつける絵を描くだけなら、
いろんな絵が描けます。
もっと単純な水素と酸素で水ができるという燃焼反応でも、
さまざまな絵を描くことができるのです。
いささか自戒の念も込めて強調したいのですが、
それが実験事実とどう切り結ぶのか、
そこを語れなくては、まさに絵に描いた餅です。
今回の実験条件を定めるにあたって、
4人の3回生のボランティアの諸君の協力をえました(協力多謝)。
少しずつ違う実験条件でやってもらったのですが、
使用するマグネシウムとブロモベンゼンの量を安息香酸メチルに対し 2.5 当量から2.2 当量に減らすと
(Grignard 試薬の量を0.5 当量過剰から0.2 当量過剰にする)、
収率が大きく減少しました(ほぼ半分ぐらい)。
反応速度が Grignard 試薬の濃度に対して、2次あるいはもっと高次の依存性を持っていると考えないと、
こうした現象は説明できません。
この点、イオンラジカルの寄与を明らかにしたかつて当化学教室で行われた研究などは、
もっと注目されてよいとぼくは思っています。
表紙のページへ

















