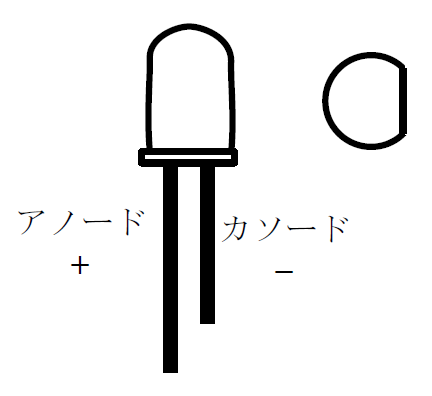2020.10
吉村洋介
光吸収・発光と光化学反応
- 分光器は精密な装置であるので、取り扱いに注意すること。
- 人間の目には映らなくても、多くの有機物は紫外部の光を強く吸収する。特に共用の溶媒の汚染には十分注意する。
- 溶液は必要な分量だけ作り、有機化合物を含む溶液は指針に従って処理する。
2 吸収・蛍光スペクトル
本課題では、種々の有機化合物溶液の吸収・発光スペクトルの測定を行う。
試料として蛍光物質として著名なフルオレセイン(fluorescein。法定色素で黄色201号とも呼ばれ、
入浴剤等にも使用される)とアントラセンとともに、
身近な生体関連物質としてクロロフィルやリボフラビンを取り上げる。
- スペクトルの測定にはCHEMUSB 4分光光度計を用いる。
CHEMUSB 4は本来、光源と検出部が一体となった光吸収を測定するための装置であるが、
その光検出部のみを使用し、励起光源を別途用意することで発光を測定することも可能である
(ただし検出感度は蛍光測定専用の装置に比べると格段に落ちることは否めない)。
- 励起光源としてここでは主にLEDを利用する。
簡便な測定には市販のキーライトなどが利用できるが、さまざまな励起波長での実験を行う上では、
種々のLEDの素子を用意して電源(ここではUSBからの給電を利用)と組み合わせて使用する必要がある。
2.1. 光源と電源
PC等に付いているUSBポートは信号の通信に使用されるが、携帯電話の充電に使用されるように、
電源としても利用できる(電圧は5 VでUSB 2.0では500 mAまで給電できることになっている)。
今回の実験では携帯電話の充電器を利用して、LED等の発光を行わせる。
PC のUSBポートを使うこともできるが、過大な電流が流れてポートが故障する恐れがあるので薦めない。
【LED素子の接続】
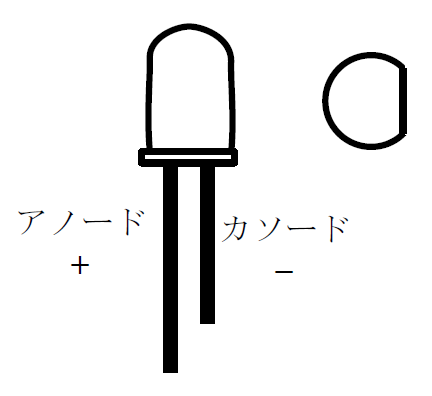
図3.砲弾型LED素子
- LEDには極性があるので、電極の+と-を正しくつなぐ。
たいていの場合LEDから出ている端子の長い方が+(アノード)。
また砲弾型のLEDでは-(カソード)側の方が真円から少し削った形にしてある。
- LEDはバイアス電圧(赤色LEDで2 V、紫外LEDで4 V程度)を超えると急激に電気を通しやすくなる。
今回の実験では過大な電流が流れるのを防ぐため、
LEDに直列に 100 Ω程度の抵抗を入れたケーブルを使用する。
2.2. フルオレセインの吸収と発光
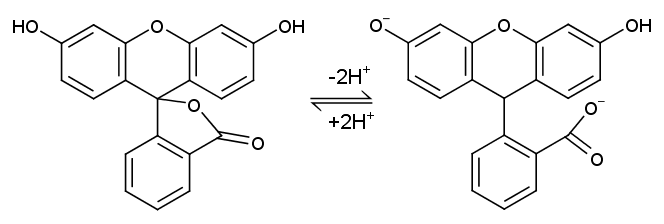
図4. フルオレセインの電離平衡
フルオレセインはおよそpH 6~7で電離して2価の陰イオンになり、強い蛍光を示すようになる。
ここでは主に炭酸塩緩衝液(pH 10)中でのフルオレセインの光吸収・蛍光を測定し、
蛍光の励起波長依存性を調べ、標準スペクトルと比較することで装置特性を調べる。
- CHEMUSB 4分光光度計で分光光度計の光源のスペクトル強度を測り、
656 nm付近の鋭いピーク(光源に使用されているD2ランプ中の重水素原子からの発光。
水素原子の主量子数 n = 3 から n = 2 への遷移に相当する)の位置を確認する。
ピーク位置が 656.1 nmから 2 nm 以上外れていたら教員・TAに知らせる。
- 光学セルにシリカゲルの懸濁液を入れ、SpectraSuiteのStrobe/Lamp Enableのチェックを外し、
CHEMUSB 4分光光度計の光源を切ってSpectraSuiteを光強度測定モードにし、
光学セルの上方からLEDで光を照射し散乱光のスペクトルが取れることを確かめる。
- 実験室の室内灯、青、赤、白のLEDなど用意されている数種のLED素子を用いて光を照射し、
シリカゲルの懸濁液を用いてそれぞれの光源のスペクトルを測定する
(散乱強度の波長依存性は大きくないので、散乱光のスペクトルを励起光源のスペクトルと同一視する)。
- 用意されている1.0×10-3 mol/Lフルオレセイン溶液を
炭酸塩緩衝液で50~100倍程度に希釈して(可視部の吸収極大の吸光度が0.5~1.5程度に収まればよい)、
CHEMUSB 4分光光度計を用いて吸収スペクトルを測定する。
- 散乱光を測定した時と同様にして、種々の励起光源に対するフルオレセイン溶液の蛍光を測定する。
- 測定に用いた溶液を4倍程度に希釈し蛍光スペクトルを測定する。
【検討】
- 励起光を変化させて得られた蛍光スペクトルを比較し、
吸収する光によらず蛍光スペクトルの形状が変化しないことを確認せよ。
- 溶液の希釈前後の蛍光スペクトルを比較して、蛍光の再吸収の影響を検討せよ。
- 得られた蛍光スペクトルを標準スペクトルと比較し、装置の感度の波長依存性を検討せよ。
- pH 4あるいはpH 7の緩衝溶液中でのフルオレセインの吸収スペクトルと蛍光スペクトルを測定し、
炭酸塩緩衝溶液中の結果と比較する。
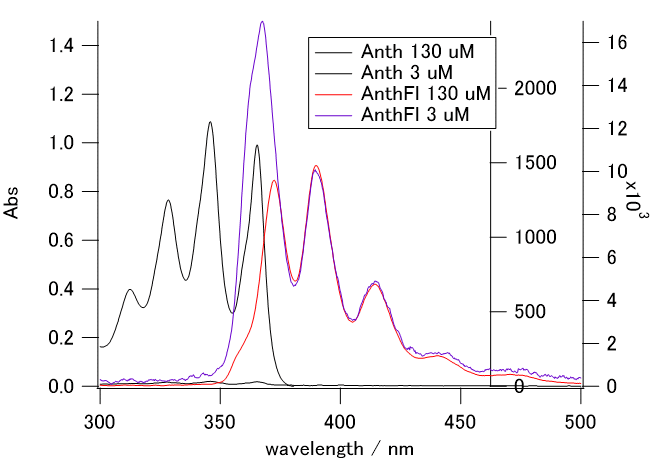
2.3. アントラセンの光吸収と発光
アントラセンは吸収・発光スペクトルに明瞭な振動構造を示す。
このアントラセンのスペクトルを解析し、ストークスシフトや吸収・発光スペクトルの振動構造についての理解を深める。
- アントラセンの1.0×10-4 mol/L程度の酢酸エチル溶液を調製し* 、
適宜希釈してCHEMUSB 4分光光度計を用いて吸収スペクトルを測定する
(UV用のディスポセルを使用する。300~400 nmの吸収極大の吸光度が0.5~1.5程度に収まればよい。
なお 260 nm以下では溶媒の酢酸エチルの吸収が大きく測定は困難である)。
* 1 mg/mL程度の溶液を調製し、その0.1 mL程度を希釈して5 mL程度にすればよい。
溶液の汚染に十分注意すること。
- フルオレセインの場合と同様にして、紫外 LED(極大波長約 370 nm)を使用して蛍光を測定する。
測定に用いた溶液を4倍程度に希釈して同様に蛍光を測定する。
【検討】
- 溶液の希釈前後の蛍光スペクトルを比較して、
再吸収の影響のない場合の蛍光スペクトルのピークの値を評価せよ。
- 吸収・蛍光スペクトルの振動構造の間隔を求め、
励起状態・基底状態で、光吸収・発光にともなって励起される振動モードの振動数を評価せよ。
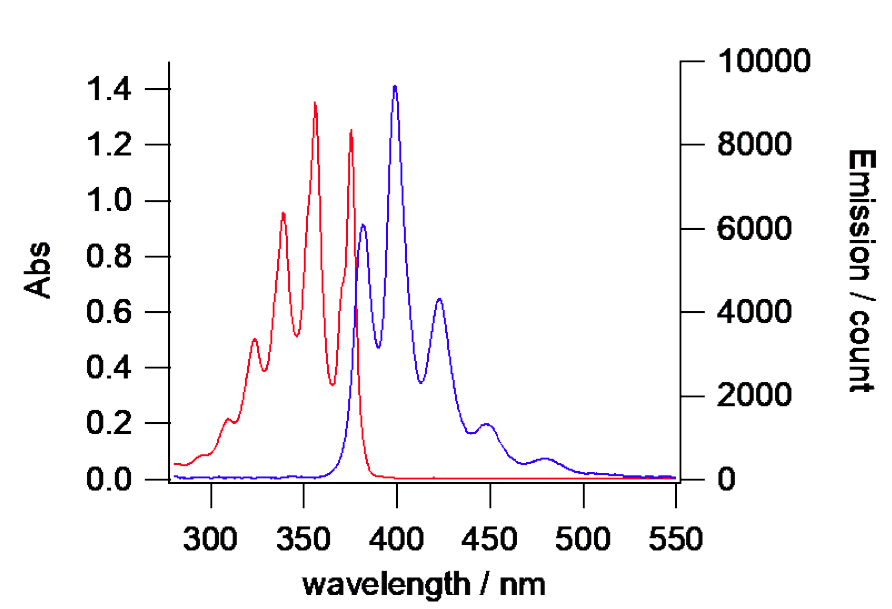
|
図5.アントラセンの吸収スペクトルと蛍光スペクトル(370 nm励起)。
|
2.4. クロロフィル・フィコシアニンの光吸収・蛍光
光合成には種々の色素が関与するが、
中でもクロロフィル(油溶性)とフィコシアニン(水溶性タンパク質)はそのカギとなる色素であるといってよい。
ここでは市販のシアノバクテリアの乾燥粉末の酢酸エチルによる抽出物とpH 7の緩衝液による抽出物について、
それぞれの光吸収・発光挙動を調べる。
酢酸エチル抽出液にはクロロフィルとカロチン等、
水抽出液にはフィコシアニン等が含まれていると期待される。
- 市販の「スピルリナ パウダー」を0.03 g程度ずつ2本のサンプル管にとり、
1本にはpH7のリン酸緩衝液、もう一本には酢酸エチルを2 mL程度加えて混ぜ、
得た水抽出液と酢酸エチル抽出液をろ過し、それぞれ吸収と発光の測定を行う。
ろ液は0.5 mLも取れば十分で、ろ紙が目詰まりしてろ過が進まなくなったらろ過を打ち切り、
適宜ろ液を希釈して使用すればよい。
- フルオレセインの場合同様、4倍程度に希釈した状態でも測定を行う。
励起光源としては用意してあるLEDと赤色レーザー(655 nm程度)を利用する。
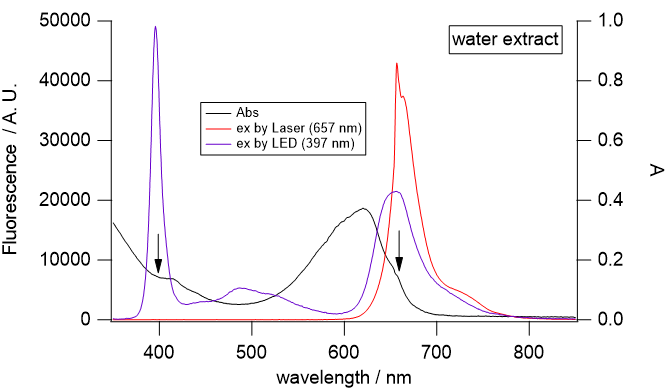
|
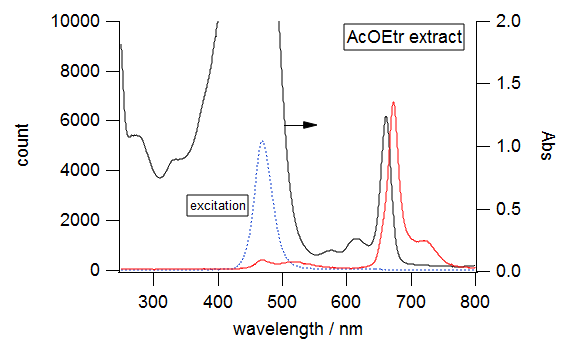
|
|
図6. スピルリナの水抽出液(左)と酢酸エチル抽出液(右)の光吸収と蛍光スペクトル。
|
2.5. リボフラビンの定性試験
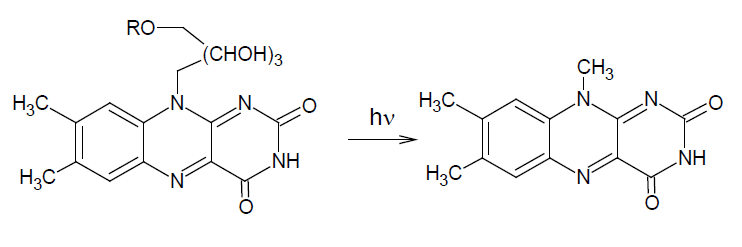
図7. リボフラビンの光分解によるルミフラビンの生成。
水溶性ビタミンのリボフラビン(ビラミンB2)はアルカリ性で容易に光分解して油溶性のルミフラビンになる。
このことを利用してリボフラビンを定量する手法が食品分析で使用されている。
ここでは公定法を簡略化して、栄養ドリンク中のリボフラビンの定性試験を行う。
- 栄養ドリンクをリボフラビン濃度が1 mg/100 mL程度になるように適宜希釈して試料溶液を調製する。
- CHEMUSB 4分光光度計を用いて試料溶液の吸収スペクトルを測り、
フルオレセインの場合と同様にして、青色LEDを用いて発光スペクトルを取る。
- 試料溶液を5 mL取り、1 mol/L水酸化ナトリウム溶液3 mLを加える。
- (3)の溶液を2本のサンプル管に等量取り、一方は遮光し、
もう一方は蛍光灯の近くにおいて1時間程度光を照射する。
- それぞれのサンプル管の内容物を2本の遠沈管に取り、酢酸0.3 mLを加えて中和し、
それぞれにクロロホルムを5 mL加えてよく振り混ぜる。
- 水層を除き硫酸ナトリウム約2 g加えて脱水する。
- それぞれのクロロホルム層の吸収・発光スペクトルを測定する。
【検討】
- 光吸収と蛍光を用いた検出法の感度と得失を検討せよ。
- ここで得た蛍光スペクトルと、前の課題のフィコシアニンの蛍光スペクトルとの類似性を検討せよ。
吸収・蛍光スペクトルのこと
励起光源・光学セル・溶液調製
実験にあたって、
まず重要な光源や光学セルの選択、
試料溶液の調製について簡単に紹介しておきましょう。
励起光源
励起光源にはもっぱら LED を用います。
電源には手軽な USB からの給電を使用することにしています。
PC の USB ポートを使ってもらってもよいのですが、
過大な電流を流して USB ポートをパンクさせる恐れがあるので、
用意してある携帯電話の充電器を使うことをお薦めしています
(何せ素人細工なもので、実は実験中にショートして、
ぼくの PC の USB ポートが1つパンクしたことがあるのです・・・)。
LED では概ね、
1個の電子が LED にかけた電圧 \(V\) で得たエネルギーを、
1個の光量子\(h\nu\) に変換すると考えてよく、
\(\lambda \approx hc/eV\) という関係を仮定できます。
ちなみに「エネルギー換算表」を見てみると、eV と 波数 cm-1 の変換で
1 eV = 8065.5 cm-1 となっていますが、
これは 1 V で電子が得たエネルギーが、
1240 nm の光量子のエネルギーに相当するということです。

|

|

|
|
図 8a. LED を光らせているところ。
黒い熱収縮チューブを巻いてあるところには抵抗が入っていて、
光らせていると熱くなる。
|
図 8b. 接続ケーブルに熱収縮チューブを嵌める前。
100 Ω 程度の抵抗が組み込んであり、
USB に接続した時、電流値を 50 mA 以下に押さえる。
|
図 8c. 高輝度の青色 LED も用意してある。
高輝度の LED では、
ケーブルの抵抗値を下げてあり、
発熱も大きい。
|
光学セル
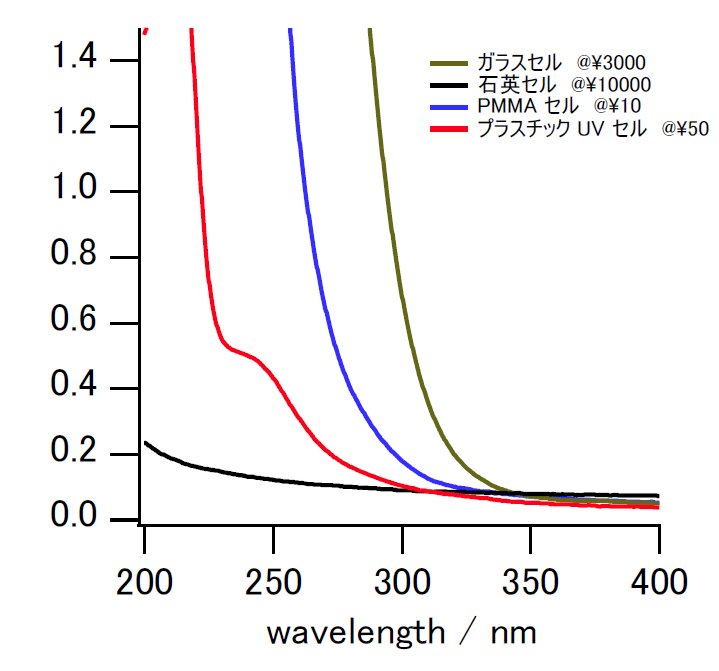
図9. 種々の光学セルの吸光度。
空気を参照にして、
水を入れて吸光度を測った結果。
A実験の光吸収の実験では、
水溶液系については PMMA(ポリメタクリル酸メチル樹脂。単にアクリル樹脂とも呼ばれる)製のもの
(あるいはポリスチレン(PS)製のもの)、
酢酸エチル溶液についてはポリオレフィン系樹脂のもの(UVセルと呼んでいる)を使用してもらいました。
PMMA の光学セルは有機溶媒全般に弱いのですが、
同じプラスチックでも、
UV セルはアセトンや酢酸エチルなどには使用可です。
ただしクロロホルムやトルエン、あるいはヘキサンといった極性の低い溶媒には使用できません。
図9に示すように、吸光度の測れる波長範囲は、
ガラスセルはおおむね300 nm ぐらいまで(PS 製のセルも同程度)、
PMMA セルでは280 nmぐらい、
UV セルでは240 nm ぐらい、
石英セルでは200 nm でも大丈夫といったところです。
もっぱら測定波長範囲とお値段・耐久性を考えて、
使用する光学セルは選定しています。
ここでの実験では、使用する光学セルの本数が1~2本といったところなので PMMA セルは特に使用せず、
水や酢酸エチル溶液についてはポリオレフィン系樹脂の UVセルを使用してもらい、
クロロホルムを使用するリボフラビンの実験については、
ガラスセルを使用してもらうことにしています。
結構くどく注意しているつもりですが、例年、プラスチックセルにクロロホルム溶液を入れて、
セルを溶かしてしまう人がでてきますが、
まあそれもよい経験かと大目に見ています。
溶液の調製 ~~ 汚染に注意して、濃度の精度は1ケタで十分
定性的なレベルの実験なので、
溶液濃度の精度は1ケタ程度で十分です。
たとえば吸収・発光の実験に用いるフルオレセイン溶液は用意されている1.0 mmol/L溶液(原液)
を取りあえず100倍程度に薄めればよく、
ざっくり半滴程度を2 mL程度にする、
あるいは天秤で0.02 g程度の原液の重さをはかって、炭酸塩緩衝液を加えて 2 g程度にするというのでも可です。
なおフルオレセイン原液はフルオレセインを炭酸塩緩衝液に溶解して調製してあるのですが、
イオン交換水で希釈するとさすがに緩衝作用が効かず、
蛍光が思うように出ないことがあるので注意します。
なおフルオレセインのように目で見て、光の吸収・発光が確認できる場合はよいのですが、
紫外部の吸収を問題にする時には要注意です。
今回の実験ではアントラセンを使用しますが、
洗浄が不十分だと、思わぬところでアントラセンの特徴的なとさか型の吸収と出会うことになります。
特に溶媒が汚染されると何を測っているのか分かりません。
溶媒を採取するスポイトはきちんと区別して、
試料溶液に使うスポイトを使いまわすのは止めましょう。
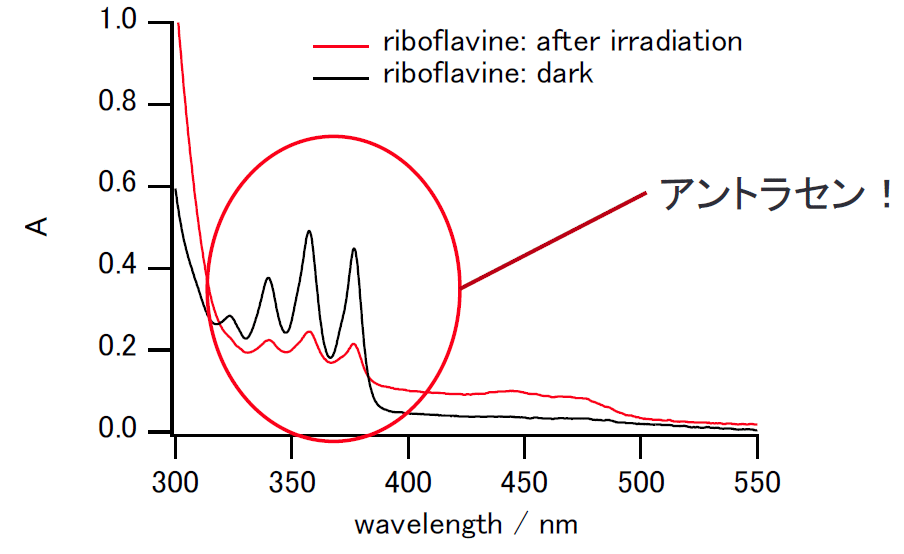
図 10. リボフラビンの吸収測定に現れたアントラセンの吸収。
芳香族の場合には紫外部に強い吸収のある物質が多く、
セルや容器の洗浄には特に注意する。
光源および蛍光スペクトルの測定
課題の最初「2.2. フルオレセインの吸収と発光」では、
フルオレセインを題材に、
光源のスペクトルや、吸収・蛍光スペクトルの挙動に親しんでもらいます。
光源のスペクトル
LED の発光スペクトルを得るのには、
シリカゲルの懸濁液を用いて、
そこからの散乱光を測ってもらいます。
この懸濁液はあまり濃いと、
散乱光がかえって弱くなるので、
向こうを通してみて、
少し濁っているぐらいでよいのです。
また色のついていない懸濁液なら何でもよいので、
シリカゲルではなく、
たとえば塩化カルシウムの溶液に、
炭酸ナトリウムや炭酸水素ナトリウム溶液を加えて作った炭酸カルシウムの懸濁液でもOKです。
|
|
|
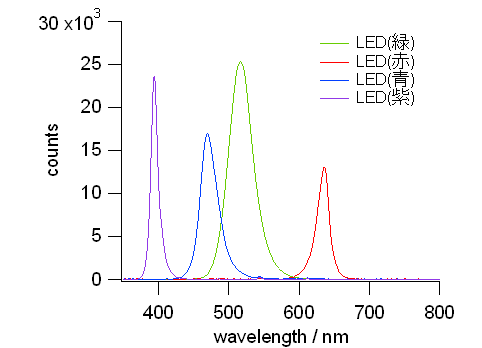
図 11a. 種々の単色の LED の発光スペクトル。
単色の LED からの発光は概ね10~数十nm の巾を持つ。
見た目に同じ色のように見えても、
LED の発光のピーク波長は製造メーカーや用途によっても少しずつ異なる。
|
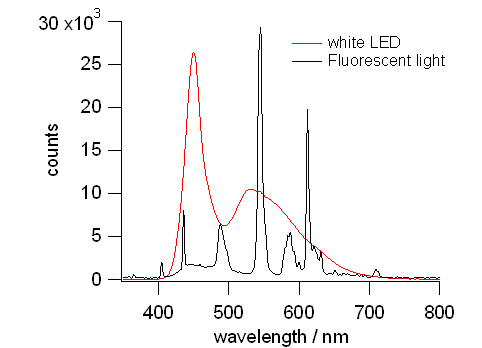
図 11b. 白色 LED と蛍光灯スタンドのスペクトル。
見た目には区別が付かないが、
蛍光灯スタンドのスペクトルには、多数の水銀の輝線が現れ、
白色 LED からのスペクトルは、青の LED による460 nm 付近のピークと、
それによるなだらかな蛍光から構成されている。
|
蛍光スペクトルと蛍光の再吸収
フルオレセインの蛍光について、
溶液を希釈した場合の蛍光スペクトルを取ってもらいますが、
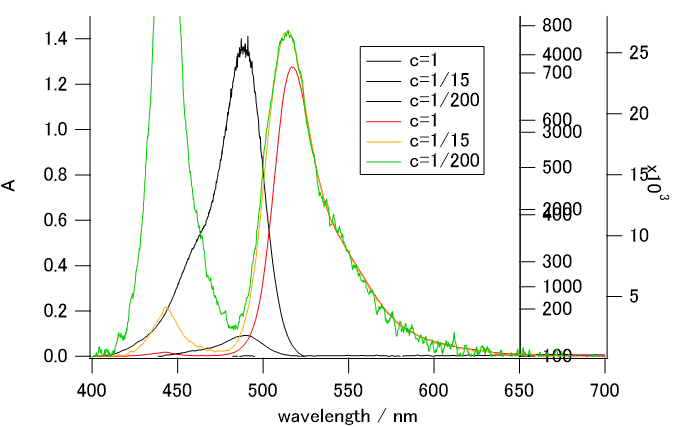
思い切って1/200 まで希釈した結果を図 12a に示します。
取りあえず蛍光を見てもらうように、
テキストでは最初かなり濃度の高い設定にしているので、
蛍光スペクトルは再吸収の影響で、短波長側がいささか削れた形になっています。
吸光度が0.1 以下になってくると再吸収の影響はかなり抑えられます。
専門的に蛍光を測定する分には、
高純度の溶媒を用いるのは無論、
通常10-6 mol/L 以下の濃度の、低吸光度の条件で測定を行うのにはこうした事情があります。
図12b にはちょっと先回りして、アントラセンの場合の再吸収の影響を示しました。
アントラセンの場合にはストークスシフト(吸収と蛍光のピーク位置の差)がほとんどないので、
再吸収の影響だ明瞭に出てきます。
なお強度の異なるスペクトルを多数表示する際、
Igor では Graph -> Modify Trace Appearance... で、
それぞれのスペクトルの Offset を操作してもよいのですが、
スペクトルを描画する時にスペクトルごとに新しく軸を設定して付け加えていった方が、
スケールの変更が手軽にできて便利です。
|
|
|
図 12a. フルオレセイン溶液を、1/200 まで希釈していった時の吸収・蛍光スペクトルの変化
(炭酸塩緩衝液中、440 nmで励起)。
最初の濃度 c はおよそ 20 µM。1/200 の時の吸収は、このスケールではほとんど見えない。
多数のスペクトルを重ねて表示する際、
縦軸を追加していくのが手軽。
|
図 12b. 希釈したアントラセン溶液の吸収・蛍光スペクトル。
40倍に希釈した時の変化
(酢酸エチル中、370 nmで励起)。
励起光の散乱光がかなり入っているが、
希釈した溶液では蛍光スペクトルのピーク位置が、ほぼ吸収スペクトルのピーク位置と重なっていることが分かる。
|
スピルリナ抽出液の光吸収・蛍光
前期の A 実験で、光合成色素の抽出液のカラムクロマトグラフィーを扱いました。
ここではシアノバクテリア(ぼくは「藍藻類」と教わりました)の光合成色素について、
扱うことになります。
「スピルリナパウダー」は、もっぱらカロテンに注目した健康食品として市販されていますが、
手軽に入手できるシアノバクテリアの試料です。
シアノバクテリアというのは、青いバクテリアということなのですが、
「スピルリナパウダー」を一見すると緑の粉で青くは見えません。
ここでは実際にそれが青いこと(”ガリガリブルー”とぼくは呼んでいます)、
蛍光を発することを見てみようということになります。
課題にあるように「スピルリナパウダー」を、
酢酸エチル、pH 7 緩衝液で抽出してもらうと、
図 13 のように黄色い抽出液と、
青い抽出液が得られます。
この酢酸エチル抽出液には、油溶性の色素、
カロテンとクロロフィルが含まれ、
pH 7 の緩衝液による抽出液には、
水溶性の色素であるフィコシアニンが含まれ、
シアノバクテリアらしい青、
アイスキャンデーのガリガリ君® の青
(ガリガリ君の袋には着色料として「スピルリナ青」が記載されています)を示します。

|

|

|

|
|
図 13a. スピルリナ パウダーの懸濁液のろ過。
|
図 13b. 酢酸エチルによる抽出液。
|
図 13c. pH 7 緩衝液による抽出液。
これぞシアノバクテリア。
若干蛍光して、赤みがさしている。
|
図 13d. イオン交換水とpH 7 緩衝液による抽出液。
イオン交換水で抽出すると、色合いが異なってくる。
|
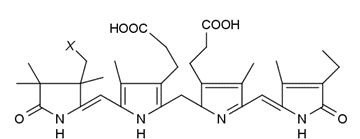
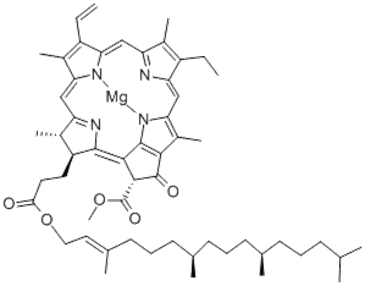
フィコシアニン、クロロフィル a の構造式として、
よく紹介されるものを図 14 に示します。
よく知られているようにクロロフィルはポルフィリン環を持ち、
フィコシアニンではポルフィリン環が開いたフィコビリン構造を持っています。
これは発色団に注目した構造式なのですが、
フィコシアニンを考える上では、ささやかに書かれた X が重要です。
この X がフィコビリン構造よりはるかに巨大でタンパク質なのです。
ですからフィコシアニンを抽出したり、
蛍光を測ったりするうえで溶液の pH の設定が重要になります。
図 13d. のようにイオン交換水で抽出したりすると、
時として色合いが変わってきます。
|
|

|
|
図 14a. フィコシアニンの構造式。
|
図 14b. クロロフィル a の構造式。
|
図 14c. フィコシアニンの蛍光。
|
この実験では、
パウダーのままでは強い蛍光が見えないのに、
溶液にすると強い蛍光が現れることにも注目しておいてもらえるとよいでしょう。
つまり光合成するような構造に組み込まれていると、
蛍光として放出されるエネルギーが、
どこかに使われているということです。
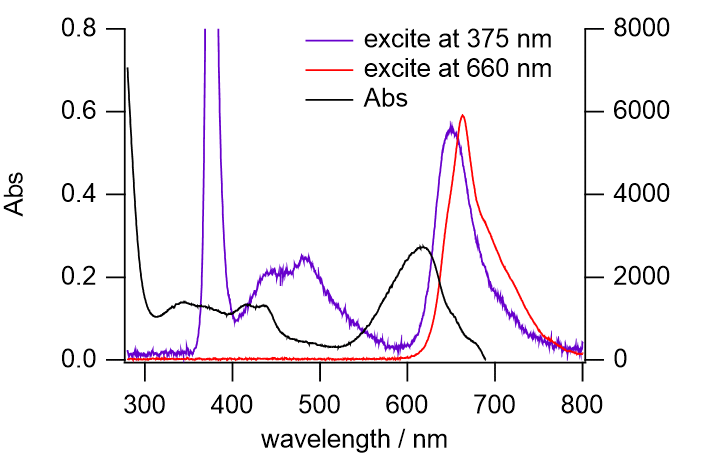
半導体レーザーで励起した場合の蛍光も見てもらうことにしていますが、
注意して欲しいのは、励起波長よりも短波長側に蛍光が見えることです。
これはフルオレセインなどの蛍光の再吸収でも言えることですが、
入れた光より大きなエネルギーを持った光が放射されることに注目ください。
なお紫外部で励起して観察される蛍光には、
後のリボフラビンの実験で観察される蛍光以外に、
より短波長の蛍光が認められることに注意してもらってよいでしょう。
|
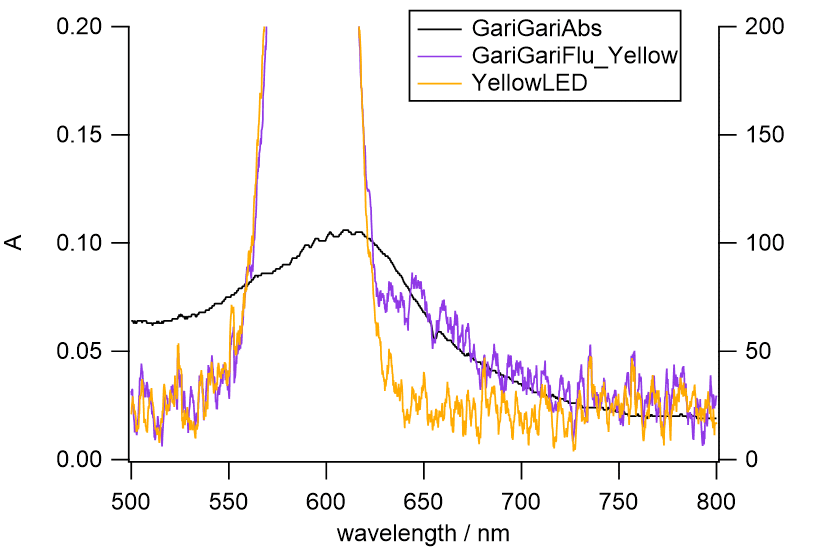
|
|
図 15a. スピルリナのpH 7 緩衝液の抽出液の蛍光スペクトル。
紫外部の励起光を使用し、
水溶性ビタミン由来と思われる蛍光が明瞭に見えている。
なおここでは赤色 LED を使っているので、
図6ほど明瞭に励起光より短波長側の蛍光が見えない。
|
図 15b. ガリガリ君の蛍光スペクトル。
溶けたガリガリ君のシロップに、黄色のLED を照射して蛍光を測定したもの。
|
光化学のページへ