Crotonsäure

Isocrotonsäure
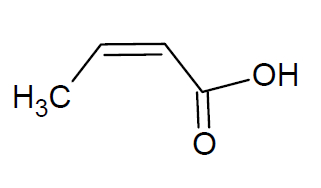
Allozimtsäure
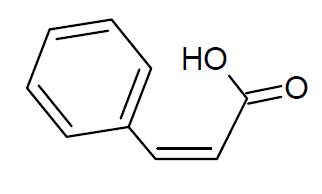
Allofurfuracrylsäure
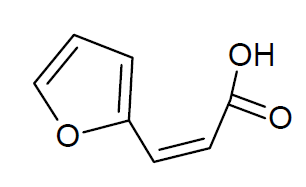
Pinonsäure
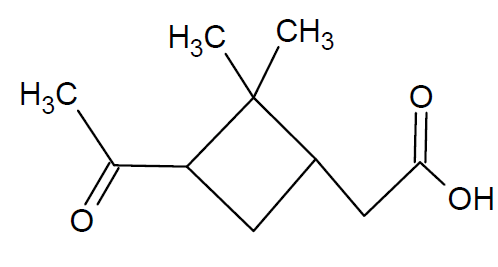
α-Dioxydihydrocampholensäure
β-Dioxydihydrocampholensäure
Hexahydrosalicylsäure
Hexametahydrooxybenzoësäure
まずは 100 年以上前、 実験室での電気の使用さえままならなかったような時代に、 すでに知られていた実験事実を紹介しましょう。
中和反応にともなう体積変化の研究は、 「物理化学」という学問分野の草創期、19 世紀後半ごろまでさかのぼるようです。 ここではまずぼくの知る、最初期の研究である 1878 年の オストワルドによる浩瀚な測定結果を紹介しましょう。 オストワルドは種々の酸と塩基(水酸化カリウム、水酸化ナトリウム、アンモニア)の溶液の混合にともなう体積変化を測定しました。 その一塩基酸についての結果を、表 1-1 に示します。
| 酸 | 化学式 | KOH | NaOH | NH3 | KOH - NH3 |
|---|---|---|---|---|---|
| 硝酸 | HNO3 | +20.0 | +19.8 | -6.4 | +26.5 |
| 塩酸 | HCl | +19.5 | +19.2 | -6.6 | +26.1 |
| 臭化水素酸 | HBr | +19.6 | +19.3 | -6.6 | +26.2 |
| ヨウ化水素酸 | HI | +19.8 | +19.5 | -6.4 | +26.2 |
| ギ酸 | HCOOH | +12.4 | +12.2 | -13.6 | +26.0 |
| 酢酸 | CH3COOH | +9.5 | +9.3 | -16.3 | +25.8 |
| モノクロロ酢酸 | CClH2COOH | +10.9 | +10.6 | -15.1 | +25.9 |
| ジクロロ酢酸 | CCl2HCOOH | +12.9 | +12.7 | -13.0 | +25.9 |
| トリクロロ酢酸 | CCl3COOH | +17.4 | +17.1 | -8.7 | +26.0 |
| プロピオン酸 | C2H5COOH | +7.9 | +7.7 | -17.8 | +25.7 |
| 酪酸 | C3H7COOH | +7.0 | +6.8 | -18.6 | +25.6 |
| イソ酪酸 | (CH3)2CHCOOH | +6.3 | +6.2 | -19.3 | +25.6 |
| グリコール酸 | CH2(OH)COOH | +9.6 | +9.5 | -16.5 | +26.1 |
| 乳酸 | CH3CH(OH)COOH | +8.3 | +8.1 | -17.7 | +26.0 |
オストワルドは物質の「親和力(Verwandtschaft、Affinität)」に注目する形で検討していますが、 表 1-1 の結果は今日的な理解に立って解釈すると、次のように整理できるでしょう:
硝酸、塩酸など強酸の中和の体積変化は I と II に対応します。 また弱酸であるカルボン酸の場合には、酸解離度を α とすると、 中和の体積変化 ΔV(HA+OH) は次式で評価されます:
ΔV(HA+OH) = (1 - α) [ΔV(HA) + ΔV(OH)] + α ΔV(OH) = (1 - α) ΔV(HA) + ΔV(OH)
酢酸や酪酸など、解離度が小さく α = 0 と見なせる場合には、 ΔV(HA) + ΔV(OH) ~ +10 cm3 mol-1 となっており、ギ酸やトリクロロ酢酸など酸解離度が大きいものになるにつれ、 体積変化が大きくなることがわかります。 また水酸化カリウムとアンモニアに対する体積変化の差は、 カルボン酸の場合、アンモニアとの中和反応の体積変化が次式で与えられることに注意すると
ΔV(HA+NH3) = (1 - α) [ΔV(HA) + ΔV(NH3)] + α ΔV(NH3) = (1 - α) ΔV(HA) + ΔV(NH3)
強酸・弱酸の区別なく、次式のようにほぼ +26.5 cm3 mol-1 になることがわかります:
ΔV(HA+OH) - ΔV(HA+NH3) = ΔV(OH) - ΔV(NH3) = 26.5 cm3 mol-1
またこれは次のアンモニウムイオンの中和反応の体積変化に対応しています:
NH4+ + OH- → NH3 + H2O ΔV = 26.5 cm3 mol-1
体積変化は濃度条件によって少し変化しますが、表 1-1 の結果は溶液 1 kg に溶質 1 mol (質量モル濃度とは異なり、溶媒ではなく溶液 1 kg 当たりです) 溶けた状態の、酸と塩基の混合の際の体積変化です。 この表の結果は、その後の研究の値と比べて、 数 cm3 mol-1 の違いの見られるケースもありますが、ほぼ妥当なものです。 オストワルドはこの中和反応に関わる論文の前に、 酸と塩溶液の混合の体積変化などに関する論文、 を発表していますが、その中の硫酸と硫酸カリウム溶液の混合の体積変化の研究などは、 今日的には中和反応 H+ + SO42- → HSO4- に関わるものになっています。 なおこれらの論文はオストワルドの学位論文のようです。
前節で、種々の中和反応にともなう体積変化を見ました。 一口に中和反応と言っても、体積の増加する場合と減少する場合があり、 H+ + OH- のように、反応の結果、反応物の電荷が消失する場合には、 水 1 分子分(18 cm3 mol-1)に匹敵するような、 大きな体積増加が観察されます。 一方、アンモニアによる中和のように、反応物と生成物で電荷に変化がない場合には、 10 cm3 mol-1 に満たない程度の体積変化に止まります。 今の目から見ると不思議ですが、 こうしたところから、電荷の消失が大きな体積増加をもたらす(あるいは電荷の出現が体積減少をもたらす)、 という立場からのアプローチはすぐには生まれなかったようです。
溶液反応の体積変化は、反応物と生成物の部分モル体積の差に相当するわけですが、 種々の物質の部分モル体積(「モル溶液体積」Molekulares Lösungsvolumen と呼ばれています)自体に注目した研究は、 体積変化の研究より遅れ 1890 年代になって始まったようです (モル体積に関する分子論的な研究は、 19 世紀半ばに Kopp の法則などの形で現れています)。 その中で電離してイオンになることで体積が収縮するということが主張され、理論的な研究も始まります。
イオンになることで体積が収縮する根拠としては、 酸とその塩の部分モル体積の差 ΔV(HA - NaA) が挙げられ、 表 2 に示すのは、トラウベによる検討結果です (J. Traube, Samml. Chem. Chem-Tech. Vorträge, 4, 255 (1899) から。 トラウベ J. Traube は表面張力の実験で使用される トラウベの滴数計 Stalagmometerのトラウベです)。 塩化水素と塩化ナトリウムの部分モル体積には 1 cm3 mol-1 程度の差しかありません (近年の研究でもこれは支持されます)。 この一方、有機酸のナトリウム塩の部分モル体積は 15 cm3 mol-1 程度、有機酸より小さくなっています。 こうしたことが「イオン化によって体積の収縮が起きる」という形で、 当時の化学者に強く訴えたようです。
今日の目から少していねいに、この有機酸とそのナトリウム塩の部分モル体積の相違 ΔV(HA - NaA) を整理してみると、 有機酸の酸解離度が 0 であるとすると、
ΔV(HA - NaA) = V(HA) - V(NaA)
= [V(H+) + V(A-) - ΔV(HA)] - [V(Na+) + V(A-)]
= -ΔV(HA) + [V(H+) - V(Na+)]
ですから、 ナトリウムイオンと水素イオンの部分モル体積がほぼ同じなので ΔV(HA - NaA) は、 酸解離反応の逆、酸会合(中和反応) H+ + A- → HA にともなう体積変化 -ΔV(HA) に対応し、 酸解離反応の体積変化 ΔV(HA) がおよそ -15 cm3 mol-1 ということに相当します。 こうして見ると、先行して行われた中和反応にともなう体積変化に関するオストワルドの研究が、 電離にともなう体積の減少、収縮という文脈で理解されなかったのは不思議に思えますが、 そもそもの電解質溶液の理論が未開拓だった中では(アレニウスの強電解質の理論が出るのは 1884 年)、 やむを得なかったのかもしれません。
トラウベは分子構造決定の一助になるという期待もあって、 有機物を中心に広範な物質の測定を行い、 構成原子の体積の和として分子の部分モル体積が表されるという、 部分モル体積の加成則の基礎を築きました。 なお表 1-2 の結果の中で、トリクロロ酢酸の ΔV(HA - NaA) が 15.4 cm3 mol-1 というのは、オストワルドのえた結果と矛盾し、 トリクロロ酢酸が強酸であることを踏まえると疑問です。 トリクロロ酢酸は潮解性なので、実験上の問題があったのかもしれません。