
|

|

|

|
| 図1a 銅粉は水をはじくので、こんな感じになりますが大丈夫。 | 図1b 過酸化水素を加えると少し発熱して銅が溶解、 溶液が青くなってきます。 | 図1c 溶解が一段落したら、湯浴中でしばらく加熱して反応の完結をはかる。 | 図1d できた硫酸銅溶液をろ過します。 |
硫酸銅の合成は、金属銅を硫酸に溶解させるところから始めます。 以前は配線の余りの銅線を利用し、亜塩素酸ナトリウムを使った手順を採用していましたが、 たまたま銅粉の在庫が出てきて、イオウの実験で使うことになり、 この機会に、より安全な過酸化水素を使った手法に切り替えました。
まず反応の量論を押さえておくと、 銅 1.0 g (16 mmol)に硫酸 18 mmol を加え、 ここに過酸化水素 24 mmol を加えることになっています。 過酸化水素の分解(2H2O2 → 2H2O + O2)も考慮して、 過酸化水素の量は5割過剰に設定しています。
Cu + H2O2 + H2SO4 → CuSO4 + 2H2O
硫酸銅五水和物 CuSO4·5H2O は最大、4 g 取れる勘定です。
ここで使用する銅粉はそのままでは水をはじくのですが、 特に問題ありません。 界面活性剤(洗剤)を加えて分散させたりすると、 泡が出て後の操作が面倒になります。 硫酸を加えるところは、濃硫酸にすることも考えたのですが、 以前のように試験管で間近に観察できるわけではないので、 危険の少ない2倍希釈の硫酸(9 mol/L)にしています。 過酸化水素水を加えると、 少し発熱して、 銅が溶解してきます。 しばらくして反応が落ち着いてきたら、 湯浴中で加熱して反応を完結させます。 なお溶解の際に少し酸素の泡らしきものが出ますが、あまり過酸化水素の分解は起きないようです。
湯浴中で加熱してしばらくすると、 溶け残りのゴミのようなものが残りますが、 ほとんど銅粉は溶解します。 この溶液を濾過すると、 清澄な青い硫酸銅の溶液を得ます。

|

|

|

|
| 図1a 銅粉は水をはじくので、こんな感じになりますが大丈夫。 | 図1b 過酸化水素を加えると少し発熱して銅が溶解、 溶液が青くなってきます。 | 図1c 溶解が一段落したら、湯浴中でしばらく加熱して反応の完結をはかる。 | 図1d できた硫酸銅溶液をろ過します。 |
硫酸銅の溶解度は 0 °C でも質量分率 12.4 %(無水物として)あるので、 このまま氷冷しても結晶は出てきません (ろ液中の硫酸銅濃度はせいぜい 8 % 程度。硫酸が入っているので少し溶解度は下がりますが、 大きくは変わりません)。 そこでこれを2倍程度に濃縮し、 冷却して硫酸銅の結晶を得ます(80 °C での硫酸銅の溶解度は 36 %)。 手順はろ過操作のところでやった通りです。
小学校ぐらいでは磁石に付くかどうかで、磁性、非磁性を判断しますが、もう少し慎重に調べると、 「非磁性」のものでも、磁石に引き寄せられるもの(常磁性)と磁石に反発するもの(反磁性)とがあることが分かります。 ここではこの差を、磁気天秤を用いて調べてもらいます。 ここで使用する磁気天秤はSherwood Scientific 社 製で、 非常に手軽に磁化率を測ることができます。 操作があまりに簡単なので忘れられがちですが、 この磁気天秤はねじり秤を使った、非常に高感度なものです。 ですから磁気を帯びたものやペンチやドライバーなど鉄製のもの (あるいは特に冬場、静電気を帯びたもの)を近づけると、 値が安定せず ”心霊現象” が起きるので要注意です。

|

|

|

|
| 図3a 磁気天秤 MSB Mk1。 上部の 4 mm の穴にサンプル管を挿入して磁化率をはかる | 図3b 硫酸銅を入れたサンプル管。 定性的な実験でもあり、この程度入れるぐらいで可 | 図3c 塩化ナトリウムとホスフィン酸を入れると、浅黒い緑色になる。 | 図3d しばらく置くと、塩化銅(I) にまで還元され白色になる |
まず何も入れないサンプル管を磁気天秤に差し込んでみてもらいます。 値が負に振れて、反磁性を示すでしょう。 ガラスや水は反磁性です。 このサンプル管に硫酸銅の粉を入れて測ると、 今度は正の値を示し、また数値は数十倍ぐらいになるでしょう (粒径が大きい時は、素焼きの板の上でスパチュラを使って潰してもらえばよい)。 こうした挙動は不対電子の有無で説明できます。 ガラスや水には不対電子がなく、 一方硫酸銅では Cu2+イオンに不対電子が含まれます。
実験では硫酸銅 CuSO4 を塩化銅(I) CuClに還元すると、 Cu+イオンは閉殻構造になり、 反磁性になることを見てもらいます。 塩化銅(I) への還元には、 ホスフィン酸(われわれオールドタイマーは、次亜リン酸の方がなじみ深い)H3PO2 による還元を採用しました (ちなみに、この反応は塩化物イオンがないと、水素化銅 CuH が生成するという、 ちょっと奇妙な反応です)。
2Cu2+ + H3PO2 + 2Cl- + H2O → 2CuCl + H3PO3 + 2H+
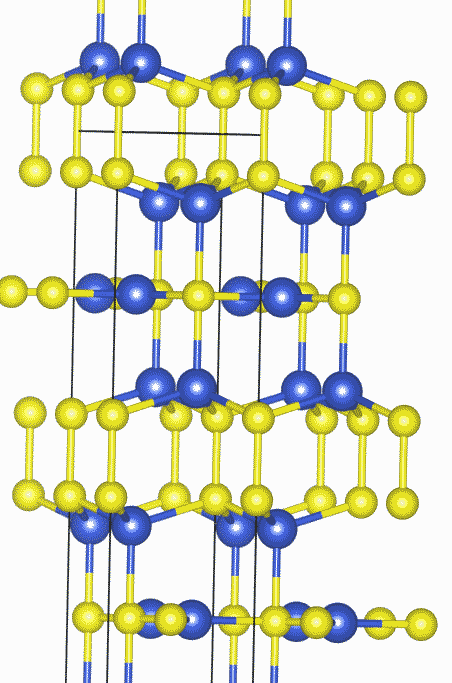
| 図4 硫化銅 CuS の結晶構造。青は Cu、黄色は S。 国立研究開発法人物質・材料研究機構 AtomWork http://crystdb.nims.go.jp/ (参照:2020.10.27) |
この装置でイオウの課題で作った硫化銅 CuS をはかってもらうと、 反磁性になっているのがわかるでしょう。 単純に考えると CuS は、Cu2+ と S2- からなり、Cuは2価で不対電子を持つので、 常磁性になりそうですがそうはなりません。 これは CuS が単純な構造をしているわけではないことを示しています。 実際図 4 のような結晶構造を取ることが知られており、結晶中でイオウは S2という単位で存在し、 Cu は +1 価として存在しているようです。 こうしたことが、 硫化銅が導電性を示すこととも関わることになってきます。 同様に硫化銅(I) Cu2S も一見単純そうですが、複雑な結晶構造を示します。
なお CuO は常磁性を示します。 このため酸化銅(II)が混入すると、見かけ上、常磁性を示すので、 実験では希硫酸で洗浄する操作を入れています。