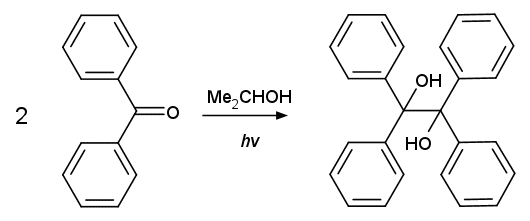
|
| 図1. ベンゾフェノンからベンゾピナコールの生成 |
ベンゾフェノンのアルコール溶液に太陽光を照射すると、 ベンゾピナコールが生成することは古くから知られていました(Ciamician & Silber 1900)。 そしてその後の研究などで、 2-プロパノール中の反応について次のことが分かっています。
こうしたことから、このベンゾピナコールの生成反応はラジカルが関与する反応で、 次のような機構で進行すると考えられています。
光を吸収して励起状態になったベンゾフェノン Ph2CO* が 2-プロパノールから水素を引き抜いて中性のケチルラジカル Ph2Ċ-OH が生成。 同時に生成するアセトンのケチルラジカル Me2Ċ-OH は不安定で、 基底状態のベンゾフェノンと反応してベンゾフェノンのケチルラジカル Ph2Ċ-OH とアセトンになる。 そしてベンゾフェノンのケチルラジカルは二量化して、 ベンゾピナコールになるというわけです。 ベンゾフェノンからすると、 光を当てられカッカ来て1個水素を 2-プロパノールから引き抜いたら、 こちらもどうぞと、もう1個水素を友達に押し付けられ、 結局友達と2人くっついたという展開です (励起状態のベンゾフェノンが、 アセトンのケチルラジカルから水素引き抜きを起こすように解説する向きがありますが、 量子収率からも、 また両者の濃度からも成り立たない議論でしょう)。
この反応で前段のベンゾフェノンの励起状態については、 これまでよく検討されてきました。 ベンゾフェノンは 340 nm 付近の光を吸収して、 酸素原子付近に分布している電子が C=O 結合全体に広がり(n → π* 励起)、 また高い効率で3重項状態になる(系間(項間)交叉 intersystem crossing)ことが知られています。 こうしたことが 2-プロパノールからの水素引き抜き反応を促進するであろうことは、 少なくとも定性的には理解できます。 けれどもこの反応の後半、 基底状態のベンゾフェノンがアセトンのケチルラジカルから水素引き抜きを起こす過程については、 あまり研究が進んでいないようです。
なお酸素が存在するとベンゾフェノンの光励起状態から酸素がエネルギーを受け取って、 2-プロパノールからの水素引き抜き反応で過酸化水素が生成するプロセスが最初に進行し、 溶存酸素がなくなるとベンゾピナコールの生成反応にバトンタッチするという事になります。 ただし2-プロパノール中の酸素濃度は、 酸素分圧が 0.2 気圧程度であればおよそ 2 mmol/L で、 今回の実験では2-プロパノール 2 mL ですから、 酸素量は 4 μmol 程度。 入っているベンゾフェノンは 1.1 mmol(0.2 g)でこの百倍のオーダーですから、 大勢に影響ありません。
実験ではまず 2-プロパノール(イソプロパノール)にベンゾフェノンを溶かします。 ベンゾフェノンの量が多いので、超音波洗浄機を使ったり、軽くヒートガンなどで加熱するのもアリです (ベンゾフェノンの融点は 48 °C)。 ここで古くからのお筆先に従って、 アルカリ分解を防ぐため酢酸を少し加える処方にしていますが、 実は今回の場合には必要ありません。
酢酸を添加するのは、 従来の実験手順が太陽光による反応で、 1週間以上も光照射を続けることになるため、 ガラスから溶けだしてくるアルカリ成分で、 ベンゾピナコールが次のように、 ベンゾフェノンとジフェニルメタノール(ベンズヒドロール)に分解する (そしてベンゾフェノンはまた光還元を受け、最終的にすべてジフェニルメタノールになる) 恐れがあるためです。
この分解反応を積極的に行わせる処方も、 L. F. Fieser の"Experiments in organic chemistry" の1941 年の第2版に載っています (酢酸の代わりに金属ナトリウムを、今回のスケールでいうと、数 mg 加えて光還元するとベンズヒドロールがとれる)。 老人としては、こうしたテーマの展開についての記憶が失われて欲しくないので、 酢酸の添加を残しているのですが、 無用の混乱を生むので、なくした方がいいんでしょうね。 きっと・・・
光照射には、ジェルネイル(光硬化樹脂を用いたマニキュア)用の、 UV ランプを用いた紫外光源を用います。 図2 のような感じで、 各グループのサンプル管に入れた試料溶液を並べてセットして、 光照射を行います。 従来であれば、こうした装置は学生実験では、 お値段的にとても手が届かないものでした。 それが民生用になって安価に入手できるようになったお陰で、 太陽光で1週間という実験が、 1時間でできるようになったわけです。
図3 に光源の発光スペクトルを示します。 見た目は青い光ですが、 実際にこの光源で反応に使用するのは 目に見えない領域(400 nm 以下)の 360 nm 付近の紫外光です。 「最初の実験」で測った蛍光灯のスペクトルを思い出してもらうと、 照明用に使われる蛍光灯ではカットされていた、 400 nm より短波長側の発光が利用されていることがわかるでしょう。 これは UVA と呼ばれる315 nm より長波長領域の紫外光で、 日焼けサロンなどで使用される、 人体にあまり害のない領域の紫外光なので、 あまり健康被害を恐れる必要はありません。 けれども長時間浴び続けると有害で、 あまり直視しないように注意します (さらに短波長側の紫外光は、この光源でもカットされています。 そうした配慮がないのが、殺菌灯として使用される放電管になります)。 なお最近は紫外 LED を用いた光源が普及してきていますが、 発光の波長域が長波長側にある(~400 nm)ので、 今回の実験には適さないでしょう (ベンゾフェノンの光吸収は340 nm 付近になだらかな極大がある)。
この装置に入れて、 だいたい 40 分ぐらい経つと、 図4a のようにベンゾピナコールの析出してきます。 できれば 1 時間ぐらい、 光照射は続けたいところです。 この光照射の時間に、 ショウノウのボルネオールへの還元の実験をやってもらうことにしています。 なおベンゾピナコールは過飽和になりやすく、 結晶が出なくても慌てなくて大丈夫。 図4c のように、取り出してから、 スパチュラでサンプル管の器壁をこすったり、 刺激を与えると析出するケースも間々あります。 また結晶が析出していても、 しばらくスパチュラで攪拌することをお薦めします。 まだ溶存しているベンゾピナコールが析出してくることが多いです。 析出してきたベンゾピナコールは、 ミクロろ過器で漉過して回収すればいいでしょう。 この時、結晶に付いた溶液を、メタノールでよく洗浄しておくようにします。 未反応のベンゾフェノンが、 赤外スペクトルに出てくることがあります。
なお光照射装置に入れる時、 サンプル管が転倒しないように、 転倒防止策を講じておいた方がよいです (多人数で使用するので、出し入れの際、以前ちょっとした悲劇が起きました)。 図4d には、 塩ビの短冊(昔懐かし OHP フィルムを切って作ったもの)を利用した、 転倒防止の袴(ハカマ)を穿かせた例を示します。

|

|

|

|
| 図4a 紫外光照射して 40 分。 ベンゾピナコールの結晶が溜ってきた (分かりやすいよう、転倒防止をしていない) | 図4b 析出してきたベンゾピナコール | 図4c 過飽和状態になり、 光照射装置から取り出してから、 急に析出してきたベンゾピナコール | 図4d サンプル管の転倒防止をしておくのが吉 |
炭素骨格が変化する転位反応は、 ちょっと大人な反応の空気があります。 ここでは古典的な転位反応であるピナコール転位を扱います (ちなみに発見者はフィッティッヒ反応でおなじみの W. R. Fittig)。 ベンゾピナコールのベンゾピナコロンへの転位反応は、 次のような機構で起きるとされています。
ちょっと有機化学を齧ったことがある人から見ると、 この転位反応では意外なことが起きているでしょう。 ワーグナー - メアワイン Wagner-Meerwein 転位の時には、 「安定な三級炭素のカチオンに転位する」と習うのですが、 ここでは三級炭素のカチオンから二級炭素のカチオンへの転位が起きています。 カルボカチオンの安定性には種々の要素が関係し、 それがまた有機化学の奥行き、魅力を形作っているといってもいいでしょう (こういうのを嫌う人もいますが・・・)。
ここでのベンゾピナコールの転位反応の実験は、 氷酢酸中(純度の高い酢酸は冬場に凍るので、氷酢酸 glacial acetic acidと称します)で行います。 注意すべきは、氷酢酸をただの酢(す)だと甘く見ないことです。 氷酢酸は目に入ると角膜損傷を起こし、重大な事態に至ります。 特に今回の実験では氷酢酸を沸騰させたりするので、 保護メガネをするのは当然ですが、 加熱に使用する試験管等にヒビなど入っていないか、 沸騰して周りの人にかかる恐れはないか、 十分注意して実験に当たってください。
実験ではまず、光還元で生成したベンゾピナコールに氷酢酸を加え、 そこにヨウ素の欠片を加えます。 ヨウ素の量は ”適当” でよく、 また後で加熱する段階で溶けるので、 最初、完全に溶かす必要はありません。 図6a のような状態から、ヒートガンで加熱していくと、 溶液の色が褐色から赤紫色になり、 ベンゾピナコールが溶けていきます。 加熱して沸騰させていると、 ベンゾピナコロンが析出してきます (析出しないこともあります)。 加熱していて酢酸が蒸発し、 ほとんど液体がなくなる状態になっても問題はありません。
加熱を終えたらそのまま放冷します。 析出してきたベンゾピナコロンをこの段階で漉過して分取するのは、 氷酢酸に直接触ることになるのでお薦めしません。 テキストにあるように、 メタノールを加えて結晶を懸濁させた後、 溶液だけをスポイトで除くという操作を、 ヨウ素の色がほとんどなくなるまで繰り返すのがよいでしょう。 この際、図6d のように、 メタノールに懸濁していたベンゾピナコロンが沈降してきたところで、 スポイトを試験管の底に突き当てるようにして、 溶液を吸い取るようにするのがよいでしょう。 スポイトの先と試験管の底面のすき間で漉過を行うわけです。 洗浄が終わったら、 ミニろ過器で漉過して液切りするのがよいでしょう。

|

|

|
|
| 図6a ベンゾピナコールに氷酢酸とヨウ素を加えて振り混ぜる。 | 図6b ヒートガンで加熱、沸騰させているとこんな感じになる。 結晶がすぐに出てくることもある | 図6c 放冷してメタノールを加え懸濁させたところ。 使ったベンゾピナコールが多め | 図6d 析出してきたベンゾピナコロンの洗浄。 ヨウ素の色はほとんどなくなっている |
ショウノウ(樟脳)は和装品の防虫剤として古くから用いられ、今も根強い支持があります。 中学校・高校の科学クラブに入っていた人は、 ショウノウ船でおなじみかもしれません。 ショウノウは、クスノキ(樟/楠)の枝や葉に含まれていて、 クスノキの葉を水とともにフラスコに入れて蒸留すると、 油分とともに結晶として得られます。 こうした天然のショウノウは光学活性がありますが、 市販のショウノウはたいてい合成品でラセミ体になっています (その合成原料は「植物生まれ」ではあります)。 なおショウノウはテルペンの仲間で、 2つのイソプレン(C5)骨格を持つ、モノテルペンと言われるグループに属しています (モノテルペンには、ハッカの成分のメントールなどがあります)。
ショウノウはケトンで、 これを還元してアルコールであるボルネオール(龍脳)にします。 だいたいベンゾフェノンの光還元の実験の光照射の時間(1 時間弱)くらいで完結するはずです。
実験ではエタノールにショウノウを溶かし、 ここに金属ナトリウムを加えていきます。 この時、金属ナトリウムが水素を発生して、 ナトリウムエトキシドになりますが、 水素の発生はあくまで副反応であることに注意してください。 実際、試験管に触ってもらうと、 水素の発生があまりない状態でも、 発熱が起きていることが確認できるでしょう。
溶媒をエタノールではなくメタノールにすると、 水素の発生は激しいのですが、 肝心のショウノウの還元があまり起きず、 ボルネオールがあまり得られませんでした。
発熱が収まってきたら、 しばらく湯浴中で加熱して反応を完結させるようにします。 ナトリウムの溶解が進み、 溶液にとろみが出てきても、 振り混ぜながら辛抱強く加熱してください。 ナトリウムが溶けてしまったら、 内容物をビーカーに入れた水に注入すると、 ボルネオールが析出してきます (後の処理を考えると、 ここで湯を使った方がスムーズですが、 金属ナトリウムが残っている場合を考えて冷水の使用を推しています)。 このままだとボルネオールは微細な結晶になっていて、 漉過の際に目詰まりを起こすことがあるので、 しばらく加温して結晶を熟成させた後、 冷却、漉過してボルネオールを得ます。
ここで得られたボルネオールは、 メタノール-水混合溶液から再結晶してもらいます。 まず少量(3 mL ぐらい)のメタノールを加え、 湯浴で温めながら粗製ボルネオールを溶かし、 温かいまま水を滴下していって、ボルネオールが析出してくるぐらいの状態にして、 放冷、冷却してもらうのがよいでしょう。 以前は再結晶溶媒にシクロヘキサンを使ったのですが、 シクロヘキサンを加え過ぎて結晶が出てこないケースが続出し、 現在のスタイルになっています。

|

|

|

|
| 図8a 藤澤樟脳。和服の虫よけの昔からのブランドです(現在製造中止) | 図8b ショウノウのエタノール溶液に金属ナトリウムを入れたところ | 図8c 反応が収束し、内容物をビーカーの水に注ぎ込む | 図8d 金属ナトリウムが残っていると、 こんな事も起きる |
測定する赤外スペクトルについて、 その特徴と注目点について紹介します。 ここでの赤外スペクトルは、すべて ATR 法によるもので、 装置や測り方については、カフェインの課題の解説を見てください。
図9a に市販のショウノウ(藤澤樟脳)、 図9b に今回の実験で得られたボルネオールの赤外吸収スペクトルを示します。 ショウノウについては、1736 cm-1 に強く鋭い吸収が見られます (NIST のwebbook の透過法の結果では、 少し高波数の 1744 cm-1 ぐらい。この差は ATR 法による影響)。 これは典型的なカルボニル基 C=O による吸収です。 ショウノウが還元されてボルネオールになると、 ショウノウで見られた 1736 cm-1 の強い吸収は消失し、 代わって 3300 cm-1 付近に巾広い吸収が現れます。 これは、有機化合物の固体で見られる典型的な水酸基 -OH による吸収になります。 また指紋領域 fingerprint region と呼ばれる 1500 cm-1 程度以下の領域では、 吸収ピークにさまざまな相違が見られます。
実験で得られるボルネオールには、 しばしば未反応のショウノウが含まれ、 図9c のように、 1736 cm-1 の吸収が残ります。 なおショウノウを多く含む場合には、 3300 cm-1 付近の水酸基 -OH 由来の巾広い吸収が、 高波数側に移動する傾向があります。 水酸基 -OH 由来の3000 cm-1 近傍の吸収は、 水素結合することで強度を増し、低波数側にシフトして幅広くなることが知られています。 ボルネオールはショウノウと固溶体を作るようで、 ショウノウで希釈されることで、 水素結合のネットワークが断ち切られ、 高波数側へのシフトが起きるようです。
なおショウノウの還元では、予習チェックで取り上げた、 ボルネオールの異性体であるイソボルネオールも生成します。 ボルネオールとイソボルネオールは 1000 cm-1 付近の赤外吸収に、 明瞭な相違が認められことが知られています。 スペクトルを少し詳細に検討すると、 得られたボルネオールにイソボルネオール由来の吸収が認められますが、 あまり明瞭ではありません。 文献によると、 ショウノウをナトリウムで還元して得たボルネオールには、 25 % 程度イソボルネオールが含まれるようです。 再結晶の過程でイソボルネオールが除かれるのかもしれません。
図11a にベンゾピナコールの赤外吸収スペクトルを示します。 ベンゾピナコールの水酸基 -OH の吸収は、 ボルネオールとは随分様子が違っています。 吸収が 3550 cm-1 付近にあって、 ボルネオールより 200 cm-1 以上高波数側で強度が弱く、 ピークが2本に分裂しています。 これは嵩高いフェニル基の立体障害のために、 結晶中でベンゾピナコール分子同士が水素結合できず、 ほぼ孤立した状態で、図10 のように分子内で水素結合した状態で存在しているためと解釈できます。 孤立しているので高波数側にシフトし、 分子内で水素結合を供与する水酸基 -OH と、受容する水酸基 -OH の赤外吸収が、 区別されて見えるわけです。
孤立した状態で、 水酸基 -OH の吸収が高波数側に移動し、 強度が減少することは NIST の データベースに収められている、 気相のボルネオールの赤外吸収スペクトルを見ても確認できます。 今回の実験で得られる、図9b で見た固体中のスペクトルとはちがって、 水酸基 -OH の吸収が 3660 cm-1 の鋭いが弱いピークになっています。
なお実験で得られるベンゾピナコールには、 しばしば未反応のベンゾフェノンが混入してきて、 1655 cm-1 付近に吸収が現れます。 結晶を漉過する際に、 付着した溶液をメタノールでよく洗い落とすとともに、 赤外スペクトルを測定する試料については、 簡単な再結晶操作を加えた方がよいのかもしれません。
ベンゾピナコールがベンゾピナコロンに転位すると、 水酸基 -OH の吸収がなくなり、 カルボニル基 C=O の吸収が、 1670 cm-1 に現れます。 ベンゾフェノンもそうですが、 ショウノウのカルボニル基 C=O の吸収より低波数側に出るのは、 共役系を持つカルボニル基の特徴です。