
|

|

|
| 図1a. 沸騰した 30 mL の湯に塩化鉄(III)の 1 mol/L 溶液 0.5 mL をスポイトで加える (2 グループが同じバーナーで作業中)。 | 図1b. 赤褐色の水酸化鉄(III) コロイド溶液ができる。 | 図1c. He-Ne レーザーでチンダル現象を確認。 |
ここでは、疎水コロイドの溶液の調製を行います。 取り扱う水酸化鉄(III) にしろプルシャンブルーにしろ、 「沈殿」として水となじまず分離するものです。 それを水に分散させているわけで、 準安定な状態であることを意識しておく必要があります。 ですから操作の順序なども重要で、 混ぜてから温めるか、 温めてから混ぜるかで結果が大きく異なったりします。 このあたりは、料理と似ているかもしれません。
ここで述べている水酸化鉄(III) コロイドの調製法は、 たいていの初歩の化学の教科書にあるものですが、 まじめに考えてみるといろいろ問題があります。 教科書には「濃い塩化鉄(III)溶液を沸騰水中に加える」という風にあっさり書いてあったりしますが、 どれぐらい「濃い」のでしょうか? 塩化鉄(III) は水によく溶け、室温付近で 50 mass%(無水物 FeCl3 として) 近くまで溶けます。 実験で使用する 1 mol/L の塩化鉄(III) 溶液は、およそ 15 mass% に相当しますが、 もっと濃い方がよいのでしょうか? もっと薄くてもよいのでしょうか? そもそも薄めれば、 もっと溶けるはずではないですか?

|

|

|
| 図1a. 沸騰した 30 mL の湯に塩化鉄(III)の 1 mol/L 溶液 0.5 mL をスポイトで加える (2 グループが同じバーナーで作業中)。 | 図1b. 赤褐色の水酸化鉄(III) コロイド溶液ができる。 | 図1c. He-Ne レーザーでチンダル現象を確認。 |
取りあえず押さえておかないといけないのは、 水酸化鉄(III) の溶解度です。 データブックを参照すると水酸化鉄(III) の溶解度積 pKsp( = -log [Fe3+][OH-]3)は、 およそ 39 ぐらいです(標準濃度は 1 mol/L に取っていて、あからさまに記述していません)。 ですから水酸化鉄(III) の沈殿が生じないためには、
[Fe3+][OH-]3 < 10-39 つまり [Fe3+] < 103 [H+]3 (1)
である必要があります。 実験で使用する 1 mol/L の塩化鉄(III) の溶液は沈殿のない赤褐色の溶液ですが ([Fe3+] ~ 1 mol/L として)、 pH が 1 以下(水素イオン濃度 0.1 mol/L 以上)と想定されることになります。 つまり塩化鉄(III) の数% が Fe3+ + H2O → Fe(OH)2+ + H+ のように加水分解して酸性度を高め、 均一な溶液になっていると考えられるわけです。 では、これを希釈していったらどうなるでしょう? 百倍に薄めた、0.01 mol/L の塩化鉄(III) の溶液では、 水酸化鉄(III) の沈殿が生じないためには、 pH が 2 程度以下であることが必要です。 つまり塩化鉄(III) 濃度と同程度の水素イオン濃度が必要で、 塩酸などを添加しなければ、 Fe(OH)2+ + H2O → Fe(OH)2+ + H+ さらには Fe(OH)2+ + H2O → Fe(OH)3 + H+ と加水分解が進行し、 水酸化鉄(III) Fe(OH)3 が沈殿してくることなります。
水を加えて溶かすのは日常経験するところですが、 水を加えて希釈すると沈殿してくるというのは少し奇妙です。 こうした事が起きるのは、 (1) 式の溶解度積の関係からは、 右辺がおよそ濃度の3乗に比例して急激に変化するため、 希釈にともない、 大小関係が逆転するためとして理解できます。
こうして塩化鉄(III) の濃厚溶液を希釈することで、 水酸化鉄(III) の沈殿が生成するわけですが、 室温付近で希釈しても、 水酸化鉄(III) の生成速度は遅く、 1日ぐらいかけると通常の沈殿(水あか)ができてきます。 それを温度を上げ一挙に析出させることで、 微小な粒子の分散した、 コロイド状態にしてやるわけです。 ですから手順を逆にして、 冷水に濃厚塩化鉄溶液を加えてから加熱すると、 モラモラができたり、水酸化鉄(III) がこびりついたりして、 コロイド溶液にならないというわけでもないですが、 あまりうまくいきません。
水酸化鉄(III) コロイドは、正に帯電したコロイドですが、 負に帯電したコロイドも取り上げてみようと、 2014 年度からプルシャンブルー(タンブルブルー)のコロイドを課題に加えました。 負コロイドにもいろいろありますが、 プルシャンブルーは顔料として古くからよく知られ、 高校の化学でも、 また絵の具などでも学生諸君におなじみだろうと採用しました (伝統的には硫化ヒ素 As2S3 コロイドがよく言及されますが、 亜ヒ酸、硫化水素の扱いが厄介なので止めました)。 もっとも、プルシャンブルーは込み入った内実を持つ物質で、 詳細な化学的な説明は厄介です。 実のところを言えば、 赤血塩の在庫をたくさん抱えていたという事情もあったりします・・・
ヘキサシアニド鉄(III)酸 Fe(CN)63-と鉄(II) Fe2+で、 青色の沈殿ができるという話は高校で習います。 でもこの反応でできるものの化学式は、 たいていぼかして書いてあると思います。 麗々しく Fe4[Fe(CN)6]3 という、 化学式を与えたりしている参考書もあるようですが、 こうした物質ができるとしてイオン反応式を立てると、 次式のようになります。
4Fe(CN)63- + 4Fe2+ → Fe4[Fe(CN)6]3 + Fe(CN)64-
ヘキサシアニド鉄(III)酸が一部還元され、 ヘキサシアニド鉄(II)酸になることになります。 単純な沈殿反応の枠にはまらないことがお分かりでしょう。 プルシャンブルーの結晶を得て構造の決定を行った研究では、 濃塩酸に溶かしたプルシャンブルーの溶液に、 ゆっくり水を加えていくという手法で Fe4[Fe(CN)6]3· xH2O (x = 14~16)という組成のものを得ていますが、 赤血塩と硫酸鉄(II) を混ぜた (あるいは黄血塩と硫酸鉄(III) を混ぜた)だけで、 すぐにそうした”理想的”な組成のものが得られるわけはありません。 今回の処方の場合、ヘキサシアニド鉄(III)酸 20 μmol に対し、 鉄(II) Fe2+ を 14 μmol 加えていますが、 このように鉄(II) Fe2+ が少ない条件では、 溶性プルシャンブルー(soluble purussian blue)と呼ばれる、コロイドが生成します。 おそらくさまざまな組成のコロイド粒子ができているのでしょうが、 KFe[Fe(CN)6] という組成のコロイドが生成しているとでもしておくのが、 無難なところでしょう (対応する酸である H[FeIIIFeII(CN)6] は、 ベルリン酸と呼ばれます(した))。 なお硫酸鉄(II) を過剰に加えると、 コロイドにならずに沈殿してきます (実験で量を誤って加えるのはよくある話)。 プルシャンブルーの色が濃いので、 沈殿していることが分かりづらいのですが、 後で行うペーパークロマトグラフィーを試してみると、 図 3 に見るように歴然です。 硫酸鉄(II) を過剰に加えて沈殿するのは、 シュルツェ-ハーディの法則に従って、 電荷の大きいカチオン(Fe2+)が存在することで、 凝析が起きているとみることができます (加える硫酸鉄(II) の濃度を 0.02 mol/L にとり (空気酸化を防ぐため硫酸を少量加えてあります)、 赤血塩濃度の 1/5 にしてあるのは、 混合の際の凝析を防ごうという意図です)。
|
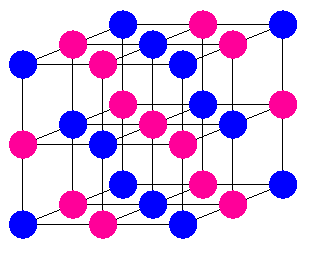
図4. プルシャンブルーの結晶の単位格子の模式図。 一辺が約 1 nm の立方体。 ●は Fe3+、 ●は Fe2+ で、 シアン化物イオン CN- が橋渡しをする形。 安定とされる組成 Fe4[Fe(CN)6]3 では ● Fe2+ のサイトの内 1/4 が空隙になっている。 |
教科書や実験書には、コロイド粒子がセロハン膜を透過しないことの話がよく載っていますが、 まずは低分子量の溶質がセロハン膜を透過する話が大切だろうと、 この実験課題には、 色のついた溶質についての実験を組み込んでいます。 実験してもらうと、 コロイドがセロハン膜を透過しないこと、 また通常の溶質分子がセロハン膜を透過すること、 ただし溶質の種類によって、 透過速度に差があることが見て取れるでしょう。

|

|

|

|
| 図5a. 水酸化鉄(III) コロイドの透析。 | 図5b. 過マンガン酸カリウム溶液の透析。 透析を開始してすぐに、過マンガン酸の透過が確認できる。 | 図5c. ローズベンガル溶液の透析。 透析を始めて約20 分。ローズベンガルの透過を確認。 | 図5d. メチレンブルー溶液(左)とプルシャンブルー溶液(右)の透析。 メチレンブルーは透過してくるが、 プルシャンブルーは透過しない。 |
実験書などを見ると、図5a のように、セロハンの袋にコロイド溶液を詰めて、 イオン交換水中に浸すように指示してあったりします。 たぶん実験する上で、一番問題になるのは、 セロハン紙で袋を作るところでしょう。 提供するセロハン紙は、 果物や花束の包装に使う巻物(50 cm 巾で長さ30 m)です。 ここからセロハンを切り取って、 袋を作ろうというわけですが、 入れる溶液量が少ない場合は結構、難物です。
折り紙で巾着を作って使ったりするのもアリですが、 乾いたままセロハンで折り紙すると、 しばしば角のところが破れて穴が開き、 そこから内部液が漏れ出てしまいます。 あらかじめ濡らして軟らかくしてから折ろうとすると、 今度はうまく折り目が付かず、 形が崩れてしまいます。
現在のところ、 液量が少ない場合のぼくのお薦めは、 小さなプラカップ(ワインの試飲用)の底を切り取って型取り用にし、 濡らしてブヨブヨになったセロハン紙をはめ込むという方法です。 後は図6a のように底抜けのプラカップに針金を巻きつけて、 イオン交換水を入れた容器に浸すという次第。 大きめにセロハン紙を取って濡らし、 それでビーカーを覆い輪ゴムで固定するというのもありですが(図5d)、 ちょっと見てくれがよくありません。 何にせよ、このあたりは学生さんの創意工夫に期待するところです (瞬間接着剤で貼り合わせるという技もありますが、 合わせ目から漏れ出すトラブルが頻発。お薦めしません)。 なお以前は包装用のセロハン紙ではなく、 まさに透析用のヴィスキングチューブを使ったこともあるのですが、 意外に適当なサイズのものがなく、 何より値段が張るので現在は使用していません。
透析をやってみると、 コロイド粒子はさすがに透過しません (透過する時は、セロハンに穴が開いていないかチェック!)。 一方、 過マンガン酸カリウムは直ちに、 赤紫の過マンガン酸が透過してくるのが分かります。 メチレンブルー、ローズベンガルは透過はするのですが、 かなり遅めです(特にローズベンガル)。 このため気のせく学生さんは、 早々にメチレンブルー、ローズベンガルを「透過しない」と判断しがちですが (実験テキストには、20 分ぐらいは待つことにしましたが、 20 分は結構長い)、 他の作業をしながらでも、あたたかく見守って欲しいところです。 こうした色素がセロハンを透過することは、 実験を終えた後のセロハン紙をチェックしてもらうことでも確認できます。 セロハン紙が色素の色に染まっているでしょう。 染まっているということは、 セロハン紙に浸透しているということ。 つまりセロハンを透過するということです。
水酸化鉄(III) コロイドの透析については、 そのままでは目視確認のできない、 塩酸の透過の確認も行ってもらいます。 硝酸銀溶液を加えると、 図8 のように塩化銀の白濁を生じ、 塩化物イオン Cl- の確認ができます。 ちなみにこの塩化銀はたいていの場合、 沈殿ではなく、コロイドとして扱うのが適当です (ろ過するとそのまま白濁した溶液が透過する)。 水酸化鉄コロイドを透析した溶液の pH は、2 ~ 3 ぐらいになっているでしょう。 注意しておきたいのは、この溶液の pH は、 pH 試験紙で正しく測ることができないことです。 希薄な溶液(0.01 mol/L 以下ぐらい)の pH を pH 試験紙で測るのは、 pH 試験紙の pH を測るようなものです。 酸性雨かどうか、雨水の pH を pH 試験紙で測ったりしませんよね? こうしたことは pH 試験紙のメーカーのカタログにも書いてあります。 簡易型でよいので pH 計を使いましょう。 あるいはメチルオレンジなどの指示薬を、 あらかじめイオン交換水に加えておくのも手です。
実験課題では、コロイドの電荷の正負を見る意味で、 ペーパークロマトグラフィーも加わっています。
ここでの「ペーパークロマトグラフィー」は、 有機化学実験などで出会うような、スポットを打って、 溶媒で展開するといったものを想定していません。 溶液にろ紙の短冊なりを浸け、 浸みこんでくる様子を観察するというだけのものです。 コロイドはろ紙を透過するわけですから、 無論、ろ紙に浸みこんできます。 けれどもろ紙への吸着の度合いに応じて、 浸みこむ速さが違ってきます。
一般にセルロースは、 ヒドロキシメチル基 -CH2OH の一部が酸化されてカルボキシ基 -COOH ができて電離し、 負に帯電する性質があり、 正に帯電するコロイド粒子は強く吸着されるため、 吸い上げられにくくなります。 同様にカチオンの方が、アニオンより吸着されやすく、 吸い上げられにくい傾向にあります。 実際にやってもらうと、 セロハンを透過できなかったプルシャンブルーのコロイドが、 ろ紙に速やかに吸い上げられていくことがわかるでしょう。 またセロハンの透過の遅かったローズベンガルの方が、 メチレンブルーより速く吸い上げられていくのも、 面白いところです。
一般に疎水コロイドは、 電解質を加えていくと不安定になり、 凝析(沈殿)します。 大規模なところでは、 川の水が海に注ぎ込むところで、 土壌コロイドが沈殿して干潟ができる要因になっています。
疎水コロイドを凝析させるのに必要な最小限の電解質濃度を、 凝析価と呼びます。 実験ではナトリウムイオン濃度を揃えるように設定して、 塩化ナトリウムと硫酸ナトリウムを加えてもらいます (0.2 mol/L 塩化ナトリウム NaCl 溶液と 0.1 mol/L 硫酸ナトリウム Na2SO4 溶液は、 それぞれ 1 mol/L 溶液を希釈して調製。 以前は固体の試薬から調製してもらっていましたが簡易化し、 希釈操作の形で調製操作自体は残しています)。 加えてみると、 硫酸ナトリウムではすぐに凝析が起きて溶液が濁ります。 これをしばらく置くと、 水酸化鉄(III) の沈殿があらわれます。 一方塩化ナトリウムでは凝析が起きません。
疎水コロイドの凝析価については古くから検討され、 もっぱらコロイドと反対電荷のイオン(今回の場合、塩化物イオンと硫酸イオン)で決まり、 また反対電荷が大きい方が、桁違いに凝析価が小さくなる (凝析しやすい)ことが知られています (シュルツェ-ハーディ則)。 水酸化鉄コロイドの場合、 塩化マグネシウムと塩化ナトリウムの凝析価は同程度なのに、 硫酸ナトリウムは塩化ナトリウムと桁違いに小さな凝析価を示します
疎水コロイドに親水コロイドを吸着させ、 凝析しにくくさせたものは、 保護コロイドと呼ばれます。 墨汁は、疎水コロイドであるススを、 親水コロイドである膠(ゼラチン)で安定化させており、 保護コロイドの例として有名です。

|
| 図11. 水酸化鉄(III) コロイド溶液にゼラチン溶液を加えた後、 硫酸ナトリウム溶液を加えて混合したもの(左)、 とゼラチンを加えなかったもの(中央)。 右は塩化ナトリウム溶液を加えたもの(図10b) |
実験では水酸化鉄(III) コロイドを、 ゼラチンを加えて保護コロイドにした後、 硫酸ナトリウム溶液を加えても凝析が起きないことを確認してもらいます。 凝析は起きませんが、注意して見ると、 元のコロイドと色合いが少し違っています。 このあたりは何かあるんでしょうが、 なぞめいています。 墨も擦り方によって色合いが違ったりするようですが、 何か関連があるのかもしれません。
使っているゼラチンはスーパーで買ってきたケーキなどに使う料理用の粉末ゼラチンで、 2 mass% の溶液にしていますが、 これはゲル(ゼリー)になるギリギリぐらいの濃度。 冷蔵庫などに仕舞っておくとゲル化して固まってしまいますが、 実験前に電子レンジで温めて、融かしておくようにします。 一端融けると、少々冷えても実験時間中はもう固まりません。
ゼラチンで保護コロイドにするのは有名ですが、 この実験課題では、 ドデシル硫酸ナトリウム(SDS。ラウリル硫酸ナトリウム LDS とも。C12H25OSO3Na) を加えた時にどのような影響が出るか見てもらいます。 図12a に見るように、 SDS を加えると水酸化鉄(III) コロイドは、 ただちに凝析します。 さらに生じた沈殿は、 (うまい比率で混合されておれば)トルエンを加えると、 図12c のようにトルエン相中に溶けて、 トルエン相が赤褐色になります。 金属の水酸化物が親油的になり、 有機溶媒に溶けるようになったわけです。 こうした話題は、 有機化学で相間移動触媒(PTC。試験に出る!?)でも触れられるところでしょう。 この事情を、分子を見てきたような話をすると、 図12d のように、 水酸化鉄(III) コロイドに、SDS のアニオンが吸着され、 外側に親油的なドデシル基 C12H25- を向けた格好で、 いわば油のボールのようになり、 有機溶媒に溶けるようになったと考えることができます。 凝析で生じる沈殿が、白っぽくて硫酸ナトリウムで凝析したものと様子が違っていることも、 このことを示唆します。

|
|
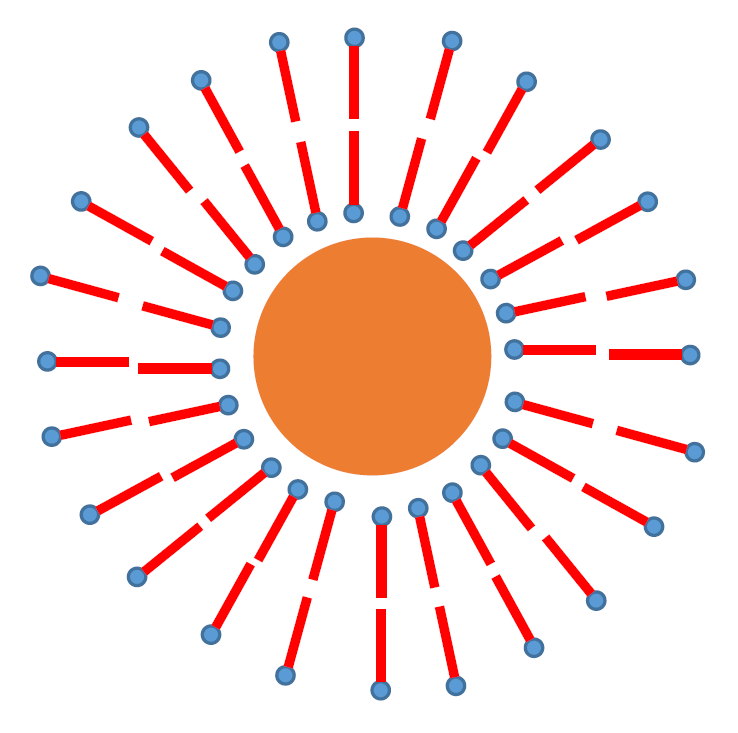
| 図13a. 水酸化鉄(III) コロイド溶液に加える 0.01 mol/L SDS 溶液の量を変えて、 トルエンへの抽出挙動を調べた実験例。 | 図13b. SDS を過剰に加えた場合の、 水酸化鉄(III) コロイド会合体の概念図。 親油的な層に SDS のアニオンが吸着され、 親水的に振舞うようになる。 |
なおこの実験、 水酸化鉄(III) コロイド溶液の濃度、 加える SDS 溶液の量等で、 人によりさまざまな挙動を示します。 図13 には加える SDS 溶液を変えて実験した結果を示しますが、 SDS の量が増えるにしたがって、 トルエン相に抽出されるようになり、 やがてトルエン相に溶ける量が減り、 白っぽいヘドロの様相を呈するようになることが分かります。 見てきたような説明をすると、 最初、水酸化鉄(III) コロイドに SDS のアニオンが取りついて、 図12d のような親油的な粒子になってトルエン中に溶ける。 ここにさらに多量の SDS の添加で、 今度は親油的な粒子の外側に、 図13b のように SDS のアニオンが取りついて、 親水的な性質も示すようになって凝集し、 ヘドロのようなものになるという風に説明できます。
こうした説明は ”おはなし” としてはいいでしょうが、 穴だらけです。 たとえば電荷だけから単純に考えると、 シュルツェ-ハーディ則からは、 SDS の凝析価は塩化ナトリウムと同程度になりそうですが、 1ケタ低い濃度で凝析が起きています。 また加えた SDS のアニオンの大部分が、 水酸化鉄(III) のコロイド粒子に吸着されることになりますが、 塩化物イオンではなくSDS のアニオンが強く吸着されるのはなぜでしょう。 SDS 分子同士の会合は(SDS の cmc は 0.008 mol/L 程度)、 どう関わってくるのでしょう? などなど、 こうした問題は、実用的な側面とも関わって、 活発に検討されているところになります。
溶液中にコロイド粒子が分散して流動している状態をゾル sol、 固まって流動性を失った状態をゲル gel と呼びます。 ゲルに関わる問題はきわめて多岐にわたります。 たとえば見方によっては、 生物はゲルからできているといえ、 生物に関する問題はゲルの問題とさえ言えるかもしれません。 ここではシリカゲルを題材に取り上げ、 そうしたゲルの世界の一端に触れようというわけです。
ケイ酸ナトリウムを中和してシリカゲルができるというのは、 高校の教科書などにもよく紹介されています。
Na2SiO3 + H2SO4 → H2SiO3 + Na2SO4
たいてい教科書ではこうしてできたケイ酸 H2SiO3 が、 シリカゲルになるというので終わっているのですが、 事態はかなり複雑です。

|

|

|
|
| 図14a. 中和してできたシリカゾルのチンダル現象 | 図14b. しばらく置いてゲル化したところ | 図14c. シリカゲルのチンダル現象 | 図14d. 両手にゲル。 硫酸を過剰に加えたものを中和し、 しばらく置いてゲル化したもの(右)。 |
フェノールフタレインの呈色が消失し、 中和した段階では、 ゲル化せずサラサラした状態です(ゾル)。 この溶液にレーザー光を当ててみると図14a のようにチンダル現象が現れ、 コロイドが生成していることが分かります(シリカゾル)。 これをしばらく(10 分以上)置くと、 固まってゲルになります(図14b)。 ゲル化するとチンダル現象はより明瞭なものになります(図14c)。 ゲル化は加速度的に進行していきます。 ですからゾルの状態のまま、 変化がほとんど認められずに置いておいて、 「実験が終わった」と、 試験管を洗浄しようという段になって、 ゲル化に気づくこともよくあります (ゲルになる前に廃液だめに捨ててしまうケースもあり)。 ここは辛抱して欲しいところです。 また酸性が強ければゲルになりやすいというわけではなく、 硫酸を過剰に加えると、 かえってゲルにならなくなります。
こうしたゲルにまつわる問題には、 実生活の中でもさまざまな局面で出会います。 たとえばコンクリートが固まるという現象を考えてみると、 生コンの状態ではサラサラしている(ゾル)のが、 2~3時間たつと急速に固まってきます(ゲル)。 あるいは寒天やゼリーは、 固めた温度より高い温度にしないと融けません。 こうしたゲルの挙動については、 どちらかというと応用面での研究が先行しながらも、 活発に研究が行われているところです。
ケミカルガーデンというのは、 水ガラスの溶液に硫酸銅や塩化コバルトなどの結晶を入れると、 色とりどりの樹木のようなゲル状のものが成長してくるという現象です。 歴史的には 17 世紀の半ばまで遡る実験で、 19 世紀には生物学的な観点からも注目され、 最近は chemobrionics (ギリシャ語で膨張・成長を意味する"bruein" から作られた造語とのこと) と装い新たに売り出し中です。 小中学校レベルの化学のデモ実験の定番で、 たいてい知っているものだと思っていたのですが、 意外に知らない学生が多く、 シリカゲルとも関わって、 できるだけやってみるように推奨しています。
ケミカルガーデンは、 水ガラスの組成・濃度によっても様相が変化しますが、 ここではシリカゲルの実験で使っている、 ケイ素とナトリウムの物質量比が 1 : 1 ぐらいで、 固形分が 3 % 程度の溶液をそのまま使ってもらうようにしています。 いろんな金属塩で学生諸君が試していましたが、 この水ガラス溶液では、 塩化コバルトの成長が速く、また ”美しい” ようです。
ケミカルガーデンの ”樹木” は、 水ガラスと金属塩とが反応して、 金属塩の周りに不溶性の半透膜が形成されることで生じます。 図17a に、 試験管の壁面に張り付いて成長した、塩化コバルトの ”樹” の写真を示します。 何本かの ”樹” が成長してきたのですが、 これはその中の ”ひこばえ(孫生え・蘖)” のようなものでしたが、 試験管の壁面に沿って成長し、 ガラス越しに眺めているわれわれに、 ちょうど”樹” の断面を示してくれた格好になっています。 先の図16c でもそうですが、 水ガラスと接する側に青緑色の薄い ”樹皮” があり、 その内側に白っぽい層が見受けられ、 あたかも植物の外皮と形成層とも見えます。 「半透膜が形成」というわけですが、 その半透膜はどうやら二層構造になっていて、 ”樹皮” に相当する部分はコバルトのケイ酸塩か水酸化物、 ”形成層” に相当する部分はおもにシリカゲルのように見えます。
図17b は、塩化コバルトの ”樹” の成長の動画です。 成長速度が 0.05 mm/min 程度の、ゆっくりした成長ですが、 一定速度で伸びていくものではありません。 ”樹” の先端部分が破裂して内部液が放出されて ”樹” が伸長、”樹皮” が形成されていき、 ふたたび先端部分が破裂、内部液の放出というプロセスが繰り返されていくことが分かります。 このことが「芸術的」といってよいような、 コバルトの ”樹” の形を作っているわけです。 ”樹皮” の破裂が起きるのは浸透圧のためで、 また先端部が破れるのは、 まだ膜ができたばかりで強度が低いためでしょう。 上方に伸びていくのは、 放出された内部液の密度が水ガラスよりも小さいためで、 水ガラスの濃度によっては、図16d のように、”樹” にならず ”苔” のようになるケースが出てくるわけです。 なおこうした ”樹” の先端が液面に達すると、 今度は内部液が液面を広がっていき、”華” が咲いたようになります(図16a のマンガン、コバルト)。
まあこうした詳細な観察もいいですが、 まずは何より、水ガラスの溶液に金属塩の結晶を沈めるという単純な系で、 複雑多岐にわたる世界ができ上っていくことを体験してもらいたいところです。 そうした学生諸君から、 将来の「化学の樹」が育ってくれることを期待します。