|
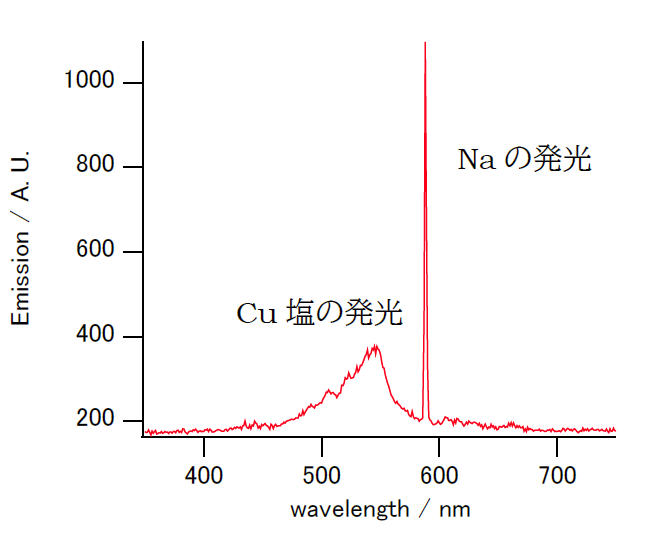
| 図X1. 塩化銅・塩化ナトリウム混合物の発光 |
実験に慣れてもらう意味も込めて、古典的な無機定性分析に関わる2つの課題に挑戦する。
Red Tide分光光度計を用いて、炎色反応等のスペクトルを調べる(「参考2」参照)。
種々の陶磁器で見られるように、遷移金属元素はケイ酸塩やホウ酸塩などのガラス中で独特の色調を示すことがある。 ホウ砂球反応は、ホウ砂(Na2B4O7·10H2O)を加熱脱水して得られるホウ酸塩ガラスの呈色を利用して、 金属元素の確認を行う手法である。

|
| 図X1. 塩化銅・塩化ナトリウム混合物の発光 |
ナトリウムと銅は鮮やかな炎色反応を示すことで知られるが、そのスペクトルの形状は図X1に示すように大きく異なる。 ナトリウムは鋭いピークを持つ(線スペクトル)のに対し、銅の炎色反応は幅広いスペクトル(帯スペクトル)を示す。 これはナトリウムの発光が原子からの発光であるのに対し、銅からの発光が CuO や CuCl といった分子からの発光であることに起因しており、 塩化アンモニウムを混ぜると CuCl 成分が増えて炎色反応は青みを増す。
人間の感じる色彩は一般に3成分の混合で表現できる(「3原色」)。 コンピュータのディスプレイなどでよく採用されるRGB表色系と呼ばれるものでは、赤(R。700 nm)、緑(G。546.1 nm)、青(B。435.8 nm)の単色光を3原色とし(CIEによる)、 3者をさまざまな比で混合して人の感じるすべての色を作ることになる。あるいはそれ以上の詳細なスペクトル情報を通常の人間は検知できない。
ホウ砂(「ほうさ」あるいは「ほうしゃ」。硼砂borax)は化学式Na2B4O7·10H2O (FW 381.37。構造に忠実にはNa2[B4O5(OH)4]·8H2O)。 古くから陶磁器の釉薬(うわぐすり、glaze)に用いられ(焼成してフリットと呼ばれるガラスの形で使われることが多い)、 鉱物等の融剤(flux)としても知られている。ここで行うホウ砂球反応(ホウ砂球試験bead test)はこのことを利用したもの。 また pH の緩衝作用があり、カルシウムやマグネシウムと塩を作ることで硬水を軟化する効果があるので洗剤等にも使用される。 なお pH 9 の標準緩衝溶液はホウ砂の 0.01 mol/L溶液(0.4 mass%溶液)に相当する。
ホウ砂球反応は、陶磁器同様、酸化炎を用いるか還元炎を用いるか等で呈色が変化することがある。 リン酸水素ナトリウムアンモニウム(Na(NH4)HPO4·4H2O。 microcosmic salt)を用いた同様の試験も知られている。 なお炭酸ナトリウムを用いた時、酸化炎中でマンガンは緑色を示す。