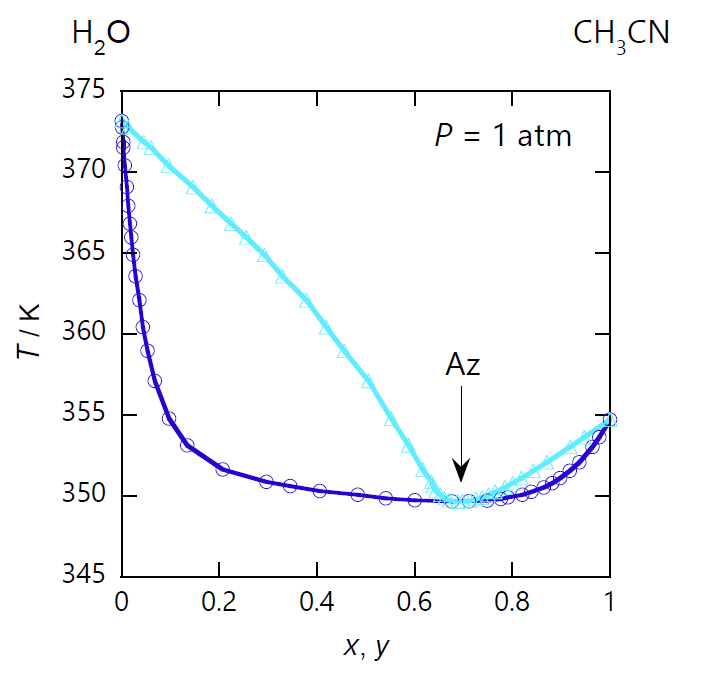

|
| 図 x-1. アセトニトリル CH3CN -水 H2O 系の等圧相平衡図。 圧力は 1 atm(= 101.35 kPa)。 図中、水色の線は露点曲線、 青色の線は沸点曲線です。 純粋な物質では露点と沸点は一致しますが、 2 成分系では一般に異なります。アセトニトリルのモル分率 0.40 の混合流体は 88 °C(360 K)で凝縮し、 77 °C(350 K)で沸騰します。 共沸点では露点と沸点が一致し、モル分率 \(x\) 0.70 のところに共沸点 Az があります。 (DDB data set #23535) |
大学の物理化学では 2 成分混合溶液の気液相平衡に関わって共沸現象が取り上げられ、 図 x-1 のような極値を持つ、頭(尻?)の丸い相線が登場します。 蒸発・凝縮の相線(沸点曲線と露点曲線)はこの極値で接し共沸点と呼ばれます。 共沸点では気液の密度は異なるものの組成は変わらず、 蒸留によって両成分を分離・精製することはできません。 あるいは混合物であっても、組成の変化がなく蒸発・凝縮のプロセスが安定に進行するわけで、 身近なところではエアコンの冷媒として使用されたりします (現在使用されているところでは R410A(CHF3 と C2HF5 の共沸混合物)など)。
こうした現象は気液の相平衡に限らず、固液の相平衡などでも見られ、 一般に2成分系で 2 相が平衡にある時、 等圧条件で両相の組成が等しければ、共存温度が極小(あるいは極大)となります。 あるいは等温条件であれば、共存圧力が極大(あるいは極小)となります。 これをギブズ-コノバロフの法則と呼びます(ギブズ-コノバロフの定理 theorem あるいは規則 rule と呼ばれることもあります)。 共沸現象の存在はよく知られているとは思いますが、 ギブズ-コノバロフの法則を正面に据えて、 なぜ両相の組成が同じなら共存温度・圧力に極値が現れるのか (あるいは逆に共存温度・圧力が極値を持つなら両相の組成が同じなのか)については、 あまり物理化学の教科書で語られることがないようです。
このおはなしでは、ギブズ-コノバロフの法則とそれに関わって、 共沸や一致転移(組成の変化をともなわない相転移。congruent transition)一般について紹介しようと思います。
ギブズ Gibbs, J.W. はよく知られていますが、 コノバロフ(あるいはコノヴァロフ)については、日本の物理化学の教科書にまず登場しません。 コノバロフはロシア-ソ連の科学者で、 ソ連の計量制度の発展にも尽力したようです。 コノバロフは元々のキリル文字で Коновалов と綴られますが、このローマ字への翻字 Konovalov が安定しなかったようで、 Konowalow、Konovalow、Konowaloff といった表記も行われ、カタカナ表記で「コノワロフ」とされていることもあります (ご当人の論文ではドイツ流(?)で D. Konowalow となっています)。
目次