共沸現象は、注目する温度、圧力領域を変えたり、取り扱う物質をさまざまに変えたりすることで消失し、 他の相挙動に移行することがあります。 ここではまず正の共沸、混合液体の沸点が純粋な A、B 両液体の沸点より低くなるケースについてみてみます。

|
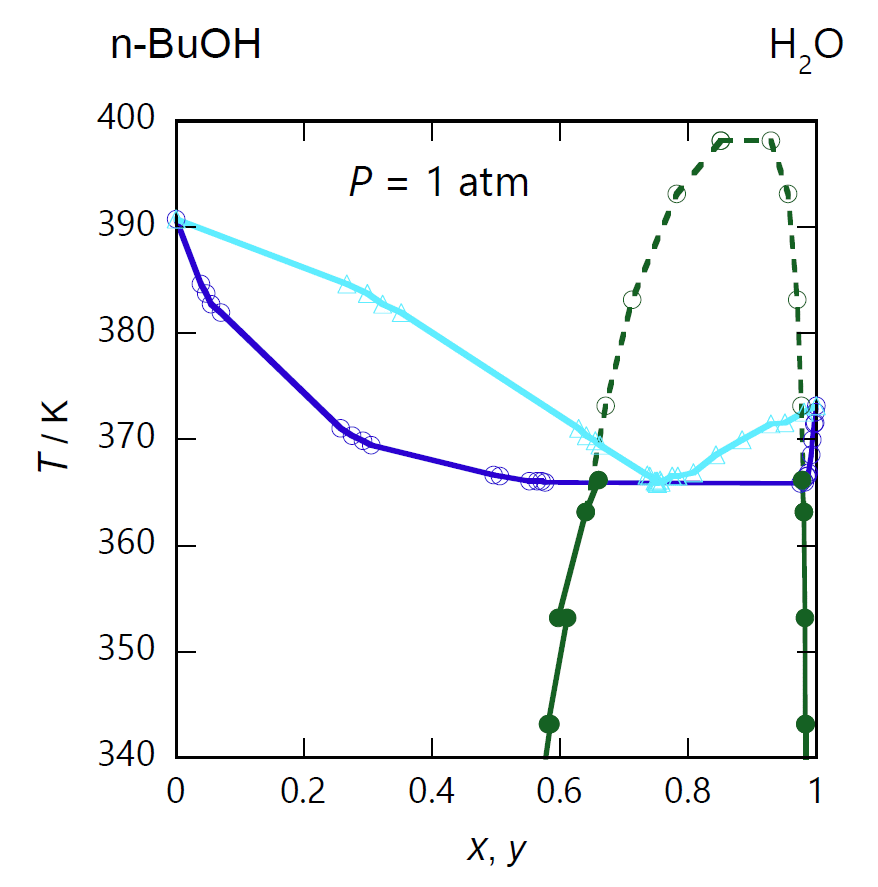
| 図 2-1. 1-ブタノール CH3(CH2)2CH2OH -水 H2O 系の等圧相平衡図。 圧力は 1 atm(= 101.35 kPa)。 図中、緑色の破線は圧力を上げた場合の液液分離の相線で、 130 °C 以上では液液分離が現れなくなります(気液液の 3 相共存状態がなくなる)。 |
先にアセトニトリル-水系で、共沸温度より低温で、液液分離が現れることを見ました。 正の共沸を示す場合、先の正負の共沸の条件式で、 \(g_{xx}^\mrm{vap} \gt g_{xx}^\mrm{liq}\) となっていることからも推察されるように、 純液体同士の混合による安定化があまり大きくないので、 液液分離が起きやすい傾向にあります。 実際に液液分離を示すケースとして、 図 2-1 に水-1-ブタノール系の等圧平衡図を示しました。
常温常圧で水-1-ブタノール系は、1-ブタノールのモル分率が約 2 mol%(質量分率 8 mass%)の水相と、約 50 mol% (80 mass%)の有機相に相分離します。 液相が 2 相分離しているとき、平衡に存在する蒸気の組成は一定です。 1 atm では 2 相分離の状態では、共沸の場合同様、両純成分の沸点(水は 100 °、1-ブタノールは 118 °C)より低い 93 °C で沸騰し、 この時の水相の組成はあまり変化しませんが、有機相の側の1-ブタノールのモル分率は少し大きくなって 約 40 mol% になっています。 そしてこの両液相と共存する蒸気相中の1-ブタノールのモル分率は 25 mol% です。
液液の相分離が起きるときの気液平衡の相線を、 共沸状態の場合と比較すると、気相線(露点曲線)は U 字型ではなく V 字型になっていて、 液相線(沸点曲線)は底が水平なスープ皿型(?)になっています。 液相線については、液液 2 相の共存領域なので置いておくとして、 気相線側に注目すると極小点は、液相の水相側と有機相側との気相線の交点になっています。
さて先に共沸点近傍での等圧条件下の相線の関係式を見ましたが、 共存する X、Y 2 相の組成が異なる場合については次式が得られます:
\begin{equation} \pdifA{T}{x_\mrm{A}^\mrm{X}}{P, \Delta \mu_\mrm{A}=0} = - \frac{\Delta x_\mrm{A}}{x_\mrm{A}^\mrm{Y} \Delta S_\mrm{A} + x_\mrm{B}^\mrm{Y} \Delta S_\mrm{B}} g_{xx}^\mrm{X} \label{eq:TxCoexLineX} \end{equation}
気相に注目しているので、X 相を気相とすると、凝縮にとなうエントロピー変化は一般に負なので、 気相線の勾配は、蒸気と液体の組成の差に比例する形になり、2種の液相と蒸気の共存する状態の前後で、 符号が反転することになります。 つまり U 字型ではなく、V 字型になるわけです。
ここでは液液分離の場合の、3 相共存線上の気相線が V 字型に折れ曲がることを見ましたが、 同様のことは後で見るように共融(共晶)現象に関わって、固固分離の場合に、3 相共存線上の液相線の V 字型の折れ曲がりに見ることができます。
ここで紹介した、液液分離をともなう気液平衡は、 香油、エッセンシャルオイルの製造などで用いられる水蒸気蒸留でもおなじみでしょう。 これを「不均一共沸(不均質共沸?。heteroazeotropy)」と呼ぶ向きもあるようです。 共沸混合物を単なる「定沸点混合物」とする立場からは、こうした名付け方もあるでしょうが、 共沸というのは共存する 2 相の組成の一致が前提で、 いささか外していると思います。
前節では正の共沸、混合液体の沸点が純粋な A、B 両液体の沸点より低くなるケースについてみましたが、 ここでは負の共沸、混合液体の沸点が純粋な A、B 両液体の沸点より高くなるケースについてみてみましょう。
|
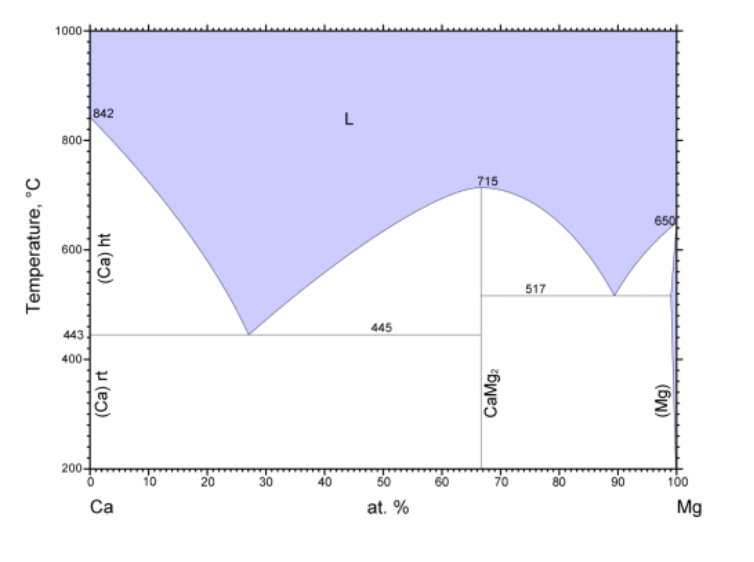
| 図 2-2. カルシウム Ca - マグネシウム Mg 系の相図。 金属カルシウムは 443 °C 以下では面心立方構造、以上では体心立方構造が安定です。 |
負の共沸は、先の正負の共沸の条件式で、 \(0 \lt g_{xx}^\mrm{vap} \lt g_{xx}^\mrm{liq}\) となるケースです。 ここからも推察されるように、 純液体同士の混合による安定化が大きいケースです。 この液体同士の混合による安定化が進むと \(g_{xx}^\mrm{liq}\) が極端に大きくなり、ある組成で液体同士の混合のモル自由エネルギーが下に尖るようなケース、 化合物の生成と分類されるケースに至ることになります。
こうした負の共沸現象が化合物生成にまで発展した相挙動は、 通常、一致転移として括られることが多いでしょう。 こうしたケースには水和結晶やピクレートなどありますが、 金属間化合物は極めて多彩な挙動を示し、また実用的にも重要で古くから研究されています。 図 2-2 に示したのは、比較的単純なカルシウム Ca - マグネシウム Mg 系の相図ですが、 醒めた目で見ると、負の共沸の成れの果て(?)の CaMg2 の一致転移(一致融解)と、 液液分離が進行して V 字型の気相線に移行した正の共沸の成れの果て(?)の 共融点が現れていることが分かります。
まれなケースですが、圧力一定の条件で組成を変えた時、2度共沸点(二重共沸 double azeotrope)を経る例も知られています。 図 2-3 に示すベンゼン C6H6 -ヘキサフルオロベンゼン C6F6 系は有名です。
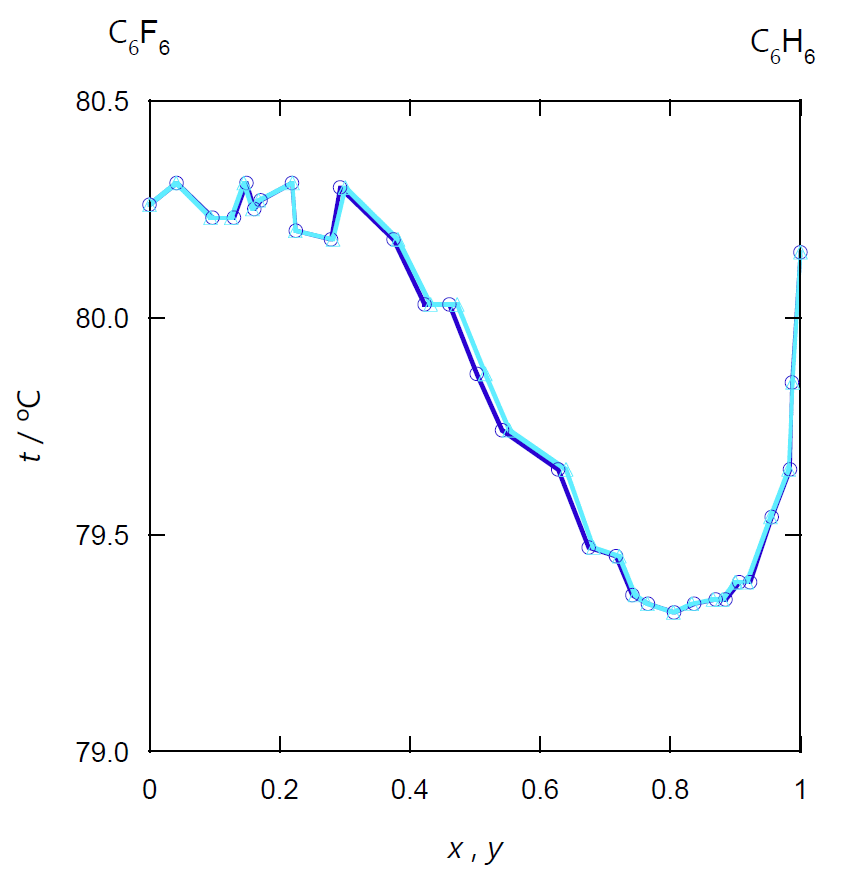
1 気圧におけるベンゼンの沸点が 80.15 °C、ヘキサフルオロベンゼンの沸点が 80.26 °C ときわめて近接しており、 図 2-3a の気液の \(Tx\) 図では、露点(凝縮)曲線と沸点(蒸発)曲線を判別するのが難しいぐらいです。 ベンゼンの液相のモル分率 \(x\) を 0 から 1 まで変化させて、その変動幅は 1 °C に収まります。 けれどもその変化を仔細に見ると、 ベンゼンに富んだ組成の側に正の共沸現象(沸点の極小)が見られ、 ヘキサフルオロベンゼン側に負の共沸現象(沸点の極大)がかすかに見て取れます
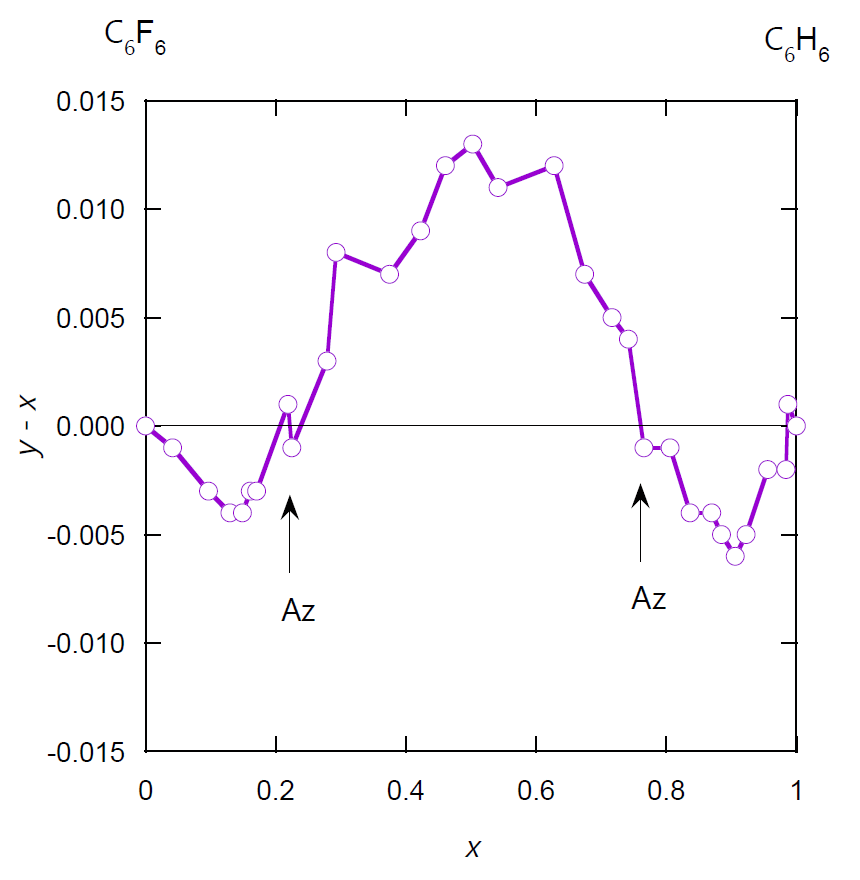
この点を明確にするために、ベンゼンの気相中(\(y\))と液相中(\(x\))のモル分率の差 \(y -x\) を液相中のモル分率に対してプロットしたのが図 2-3b です。 ベンゼンのモル分率 \(x\) 0.2 付近と、0.8 付近に、 気液の組成比が等しくなる点、共沸点が確認できます。 しかしそもそもの気液のモル分率の差は 0.01 程度。 先に見た典型的な共沸挙動のような \(xy\) プロットを取ると、 ほとんど勾配 1 の対角線上に乗ってしまいます。
|
|
| 図 2-3a. ベンゼン C6H6 -ヘキサフルオロベンゼン C6F6 系の等圧相平衡図。 圧力は 1 atm(= 101.35 kPa)。 (Landolt-Börnstein, Physical Chemistry, IV/3, No. 298) ベンゼン濃度の低い側に正の共沸、高い側に負の共沸を認めることができます。 | 図 2-3b. ベンゼン C6H6 -ヘキサフルオロベンゼン C6F6 系の等圧平衡の組成図。 組成の差が小さいので、ベンゼンのモル分率の蒸気相中(\(y\))と液相中(\(x\))の差を、 液相組成に対してプロットしました。 |
理論的にはこうした二重共沸は興味深く、 図 2-3a の2つの共沸温度が等しくなるように圧力を調整してやることができたなら、 \(Tx\) 図で、温度が極大、極小ではなく、変曲点となる「共沸」挙動が見られることになります。 先の正負の共沸の条件式でいうと、 \(g_{xx}^\mrm{vap} = g_{xx}^\mrm{liq}\) となる状態が実現できるわけです(特に名前はないようですが、自由度 0 の状態)。 けれどもそういう状態を実現できたからといって、 見出されている二重共沸(あるいは多重共沸)が、 上にも触れたようにあまり明瞭なものでないこともあって、 何か新たな興味ある現象が現れるかというと、 今のところ見当たらないようです。
「頭の丸い」相線の話をしているわけですが、「腹の出た」相線にも触れておきましょう。
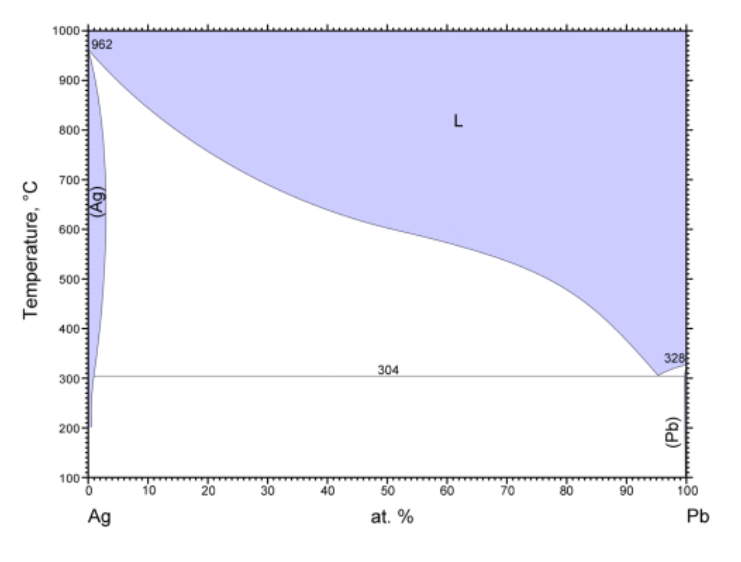
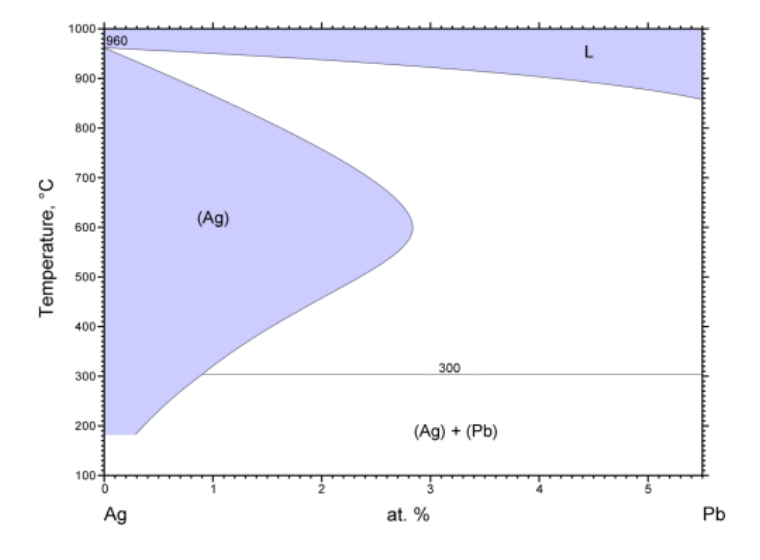
図 2-4 に示すのは、古典的な銀の精錬の灰吹き法にも関わる、鉛と銀の相図です。 液体の鉛に銀が溶ける一方、 銀と鉛は固溶体を作り、銀に鉛は数 at% のオーダーで固溶化します。 この鉛の溶解度は 600 °C ぐらいまで、 温度とともに大きくなって 3 at% (質量分率 6 mass%)近くで最大となり、 さらに温度を上げると小さくなっていきます。 「腹の出た」相線になっているわけです。 一方、固溶体と平衡にある液相中には 600 °C で鉛は 50 at%(66 mass%)程度溶けており、 こちらは温度とともに単調に減少(銀は単調に増加)しています。
「腹の出た」相線を持つ場合、 温度を下げていって一端固相が現れた後、さらに下げると再び固相が溶解する現象が現れることになります。 ぼくなどは「再溶解」「再融解」と呼びたくなるのですが、 こうした現象は材料関係のリーグでは「逆行溶解度 retrograde solubility」と呼ぶようです (「再融解(remelting あるいは catatectic)」というのは、ある固相が、異なる固相と液相に転移する現象(材料関係の人は「反応」と呼ぶ)を指すようです)。 なお同様の現象は高圧気液平衡では頻繁に現れ「逆行凝縮 retrograde condensation」 「逆行蒸発 retrograde vaporization」などと呼ばれます。
|
|
| 図 2-4a. 鉛 Pb - 銀 Ag 系の相図。 銀は鉛を数 at% 溶かし込んだ固溶体を作ります。 国立研究開発法人物質・材料研究機構 AtomWork http://crystdb.nims.go.jp/ (参照: 2024.3) | 図 2-4b. 鉛 Pb - 銀 Ag 系の相図の銀の組成に富む部分の拡大図。 銀に鉛は最大 3 at% まで固溶化しますが、 固溶化する鉛の量は 600 °C ぐらいで最大となり、 それより温度が低くても高くても小さくなります。 |
「頭の丸い」相線、 共沸あるいは一致転移のような場合には、 共存する 2 相の相線は温度の極値を持って接し、 組成は一致しました。 けれども銀と鉛の場合には、 一方の固溶体の側の相線の「腹が出」ているからといって、液相側の相線に特に変化はありません。
「腹が出」ている相線の場合、相線が組成依存を持たないところで、式 \eqref{eq:TxCoexLineX} の右辺で、 \(x_\mrm{A}^\mrm{Y} \Delta S_\mrm{A} + x_\mrm{B}^\mrm{Y} \Delta S_\mrm{B} = 0\) という関係が成り立っていることになります。 これは相 X から相 Y の組成に相当する混合物を取り出して、 相 Y に入れた時のエントロピー変化(あるいはエンタルピー変化)が 0 であることを意味します。 同様のことを相 Y から相 X について行った時に、 エントロピー変化が 0 になる保証はなく、 実際、図 2-4 のように、一方の相線の「腹が出」ているからと言って、 平衡にある他方の相線の挙動に変化はみられません。