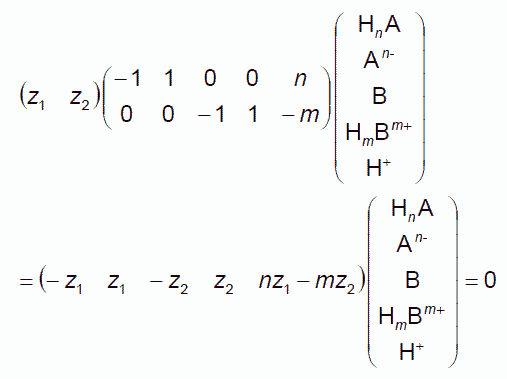
酸塩基反応は一般に、化学種間の水素イオンのやり取りと位置づけられます。
m HnA + n B → m An- + n HmBm+
ここで HnA、HmBm+ と表記した化学種は、 たとえば下記のような化学変化を考慮することで、 他の化学種と同等なものと見なすことができます。
H2 [Ca(OH)2] 2+ → Ca2+ + 2 H2O
あるいは H2 [Ca(OH)2] 2+ といった化学種を想定せずに、 もっと直截な形で表現してもよいのです。
Ca(OH)2 → Ca2+ + 2OH- H+ + OH- → H2O
ここでは量論関係のみを問題とするので、 こうした化学種の内実には関心を払わないことにします。
酸塩基反応を2つの反応に分解し、それぞれの反応進行度を z1, z2 としましょう。
HnA → n H+ + An-
m H+ + B → HmBm+
この2つの反応を、水素イオンの出し入れが等しくなるように構成することで、 酸塩基反応の量論係数を釣り合わせることができます。 行列を使った表示では、次のような表式で表現できます。
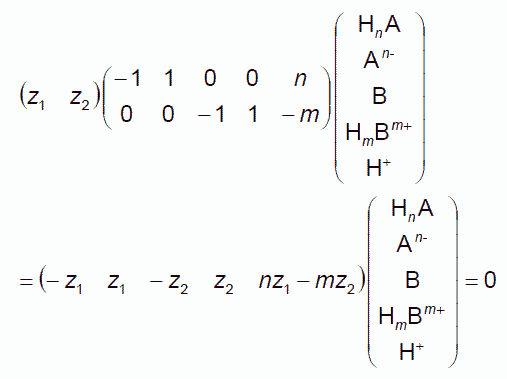
ここから n z1 = m z2 = z、 (z1, z2) = (1/n, 1/m) z と反応進行度を定める、量論係数を定めればよいわけです。
(1/n) HnA → H+ + (1/n) An-
H+ + (1/m) B → (1/m) HmBm+
まとめると、次のような式になります。
(1/n) HnA + (1/m) B → (1/mn) HmnAmBn
たとえば硫酸に酸化アルミニウムが溶ける反応は 1 mol の硫酸 H2SO4 が2 molの水素イオンを、 1 mol の酸化アルミニウム Al2O3 が 6 mol の水素イオンを受け取ることに注目すると、 次のように量論係数を決めることができます:
(1/2) H2SO4 + (1/6) Al2O3 → a Al2(SO4)3 + b H2O
ここで未知の係数a、bは右辺と左辺で Al (あるいは S )と H の数が釣り合うように決めればよく、 ただちにa = 1/6、b = 1/2 であることがわかります。
酸HnA(あるいは塩基B)に関して、反応相手の塩基(酸)によらず、 分数の量論係数からなる化学反応を導入しておけば、 酸塩基反応を考える限り、たとえば下記のように反応相手によらず量論係数を同じに取ることができるわけです。
HCl + (1/2)Ca(OH)2 → CaCl2 + H2O
(1/2)H2SO4 + (1/2)Ca(OH)2 → MgSO4 + H2O
(1/3)H3PO4 + (1/2)Ca(OH)2
→ (1/6)Ca3(PO4)2 + H2O
(1/3)H3PO4 + NaOH → (1/3)Na3PO4 + H2O
このような量論係数の操作は単に表記法の上での簡便さだけではなく、実際に実験を行う上でも有用です。 たとえば硫酸の 0.20 mol/L 溶液と 0.05 mol/L 水酸化ナトリウム溶液から硫酸ナトリウム Na2SO4 の溶液を調整する際、 それぞれをどれだけの容量比で取ればよいでしょうか? この時、硫酸1 mol が 2 molの水素イオンを放出することから、 あらかじめ 0.20 mol/L の硫酸溶液を 0.40 mol/Lの“水素イオン溶液”と見なしておいた方が、 容量比をより簡単に割り出すことができるでしょう。 こうした考えから、酸塩基反応で用いる試薬について、(今日通常行われる化学式から割り出した物質量ではなく、) 供与(あるいは受容)することのできる水素イオンの物質量から割り出した物質量が用いられ、 (酸塩基反応における)化学当量 chemical equivalence と呼ばれます。
化学当量に基づく濃度で表記することも、従来広く行われてきました。 この濃度表示を(酸塩基反応における)規定度 normality と呼び、 通常mol/L単位で表し、化学式による物質量と区別するために単位記号N(Norと書く文化もある)で示し規定 normal と読みます。 たとえば 0.1 mol/L の硫酸は 0.2 N 硫酸であり、 0.1 mol/L の硫酸アルミニウム Al2(SO4)3 溶液は 0.6 N 硫酸アルミニウム溶液に相当します。 同様の濃度の表記は、酸化還元反応について電子の授受に関しても行われてきました。
規定度による濃度表記は19世紀から用いられてきたものです(1860年ごろイギリスのJ. J. Griffinが用い始め、K. F. Mohrによって広められたらしい)。 しかし語られる文脈によって規定度が異なることがありえて(酸塩基反応に閉じた世界でも、 たとえばリン酸は pH 10 程度までなら2塩基酸としてふるまい、 1 mol/L は 2 N と見なせる)、分子論(そして電卓)が普及した現在では用いられることが少なくなりました。 なお「規定」は以前は計量法に定められた法定計量単位でしたが、 1997年10月1日以降、法定計量単位ではなくなっています。