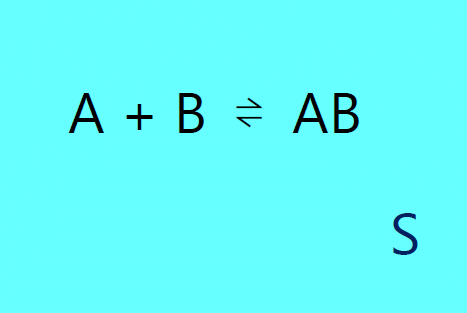
まず化学反応式の量論関係についての、基本的な取り扱いを押さえておきましょう。 次のような分子種 \(\mrm{X}_i\)(\(i = 1, 2, \ldots\))間の化学反応を考えます:
\begin{equation} 0 \to \sum_i {\nu_i \mrm{X}_i} \label{eq:chemeq} \end{equation}
ここで \(\nu_i\) は \(i\) 番目の分子種の量論係数です。 以下の議論では \(i\) は反応・生成物を示すものとします。 これはたとえばトリメタリン酸の生成する 3H3PO4 → (HPO3)3 + 3H2O という反応であれば、 0 → -3H3PO4 + (HPO3)3 + 3H2O と表記したことになっています。 ここで問題にする A と B の会合平衡 A + B ⇌ AB であれば、0 ⇌ -AB + A + B というわけです。 無から有を生じるような記法になっていますが、 終わりから始まりを引くという筆法に従っています。 反応物の方に負の量論係数を導入することで、化学反応にともなう諸量の変化をコンパクトに表現することができます。
反応の進行の度合いを表すのに、反応進行度 \(\xi\) を用いるのが便利です。 反応進行度を用いると、反応の進行にともなう各成分の物質量 \(n_i\) は次式で表されます。
\begin{equation} n_i = n_{i0} + \nu_i \xi \label{eq:eor} \end{equation}
ここで \(n_{i0}\) は、初期の成分 \(i\) の物質量です。
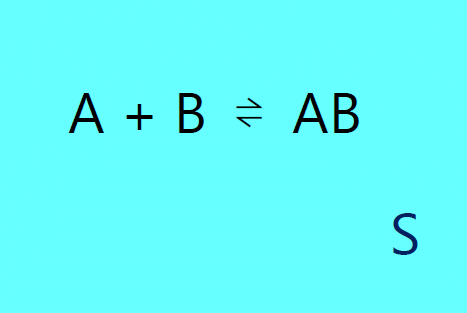
|
| 図 1a. 溶媒 S 中に無限希釈量溶けた A と B が会合して AB となる |
さてこのお話では、もっぱら溶媒 S 中での A と B の会合平衡 A + B ⇌ AB を扱います。 そして A、B、AB は体積 \(V\) の溶液中に極微量、無限希釈量存在するものとします (\(n_i/V \approx 0\) あるいは \(n_i \ll n_\mrm{S}\)、\(i = \mrm{A, ~B, ~AB}\)) A、B、AB は極微量なので反応が起きても体積は一定と考えることができ、 \(z = \xi/V\) として、 それぞれの濃度変化は次のように書くことができます。
\begin{eqnarray} [\mrm{A}] &=& [\mrm{A}]_0 - z\\ [\mrm{B}] &=& [\mrm{B}]_0 - z\\ [\mrm{AB}] &=& [\mrm{AB}]_0 + z \label{eq:eorx} \end{eqnarray}
皆さん高校以来おなじみでしょうが、\([\mrm{R}]\) は成分 \(\mrm{R}\) の濃度 \( c_\mrm{R} = n_\mrm{R}/V\) を表します。
無限希釈量しかないので、一般に熱力学量 \(X\) の反応・生成物 \(i\) の物質量 \(n_i\) への応答は、 溶媒 S の物質量のみに依存し、 \[ \pdifA{X}{n_i}{n_{k \ne i}} = \pdifA{X}{n_i}{n_\mrm{S}} \] とすることができます(\(k\) は溶媒も含めた全分子種です)。 このおはなしでは、基本、こうした省略はしない方向で進めます。
化学反応にともなう熱力学量 \(X\) の変化 \(\Delta_{\mrm{r}}X\) は、次式で与えられます:
\begin{equation} \Delta_{\mrm{r}}X = \pdif{X}{\xi} \label{eq:tqch} \end{equation}
この式は多変数関数の微分の連鎖律を用いて、次のように書けます(\(i\) は反応・生成物を示し、\(k\) は溶媒も含めた全分子種を示します)。
\begin{equation} \Delta_{\mrm{r}}X = \sum_i {\pdifA{X}{n_i}{n_{k \ne i}} \pdif{n_i}{\xi}} = \sum_i {\nu_i \pdifA{X}{n_i}{n_{k \ne i}}} \label{eq:tqch1} \end{equation}
このお話では、特に断らない限り、反応にともなう熱力学量の変化(\(\Delta_{\mrm{r}}X\))は、 温度 \(T\)、圧力 \(P\) 一定の条件のものであるとします。 すると \(X\) がエンタルピーや体積のような示量的な量の場合、 \(X\) の部分モル量 \(X_i = (\partial X/\partial n_i)_{T, P, n_{k\ne i}}\) を用いて、A と B の会合平衡にともなう熱力学量の変化を次式のように表せます。
\begin{equation} \Delta_{\mrm{r}}X = \sum_i {\nu_i X_i} = X_\mrm{AB} - (X_\mrm{A} + X_\mrm{B}) \label{eq:tqch2} \end{equation}
なお \(X\) がギブズエネルギーの場合、その部分モル量 \((\partial G/\partial n_i)_{T, P, n_{k\ne i}}\) は成分 \(i\)の化学ポテンシャル \(\mu_i\) に等しく、 次式が成り立ちます。
\begin{equation} \Delta_{\mrm{r}}G = \sum_i {\nu_i \mu_i} = \mu_\mrm{AB} - (\mu_\mrm{A} + \mu_\mrm{B}) \label{eq:tqch3} \end{equation}
部分モル量 \(X_k\) は、もとの示量的な熱力学量 \(X\) との間に \[ X = \sum_k {n_k} X_k \] という関係が成り立ち(同次式に関するオイラーの関係式)、特に純物質であればモル量と同一視でき(\(X_k = X/n_k\))、 直観的な取り扱いが容易です。 実験的に設定が容易なこともありますが、 部分モル量の問題に還元できるので、 反応にともなう熱力学量の変化は、通常、温度 \(T\)、圧力 \(P\) 一定の条件で扱われます。 何でもないことのようですが、反応にともなう熱力学量の変化については、 もっぱら部分モル量を扱っていることに注意してください。
さて溶液中の各溶質成分の化学ポテンシャルは、 溶質が希薄な状態では、次の関係式で与えられます。
\begin{equation} \mu_i = \mu_i^\circ + RT \ln \frac{c_i}{c^\circ} = \mu_i^\circ + RT \ln a_i \label{eq:mudil} \end{equation}
ここで上付き \(\circ\) は標準状態の量であることを示し、\(c^\circ\) は標準状態のモル濃度で、たいてい 1 mol/L が取られます (標準状態を表す記号としてはプリムソル(喫水線マーク)⦵ もよく用いられますが、ここでは \(\circ\) で通します)。 また \(a_i = c_i/c^\circ\) は成分 \(i\) の活量と呼ばれます (濃度が高くなると、\(a_i \ne c_i/c^\circ\) となりますが、ここでは反応・生成物が無限希釈状態にあると考えています)。 標準状態の取り方としては、モル濃度(単位体積中の物質量)ではなく、 質量モル濃度 \(m\) (最近は記号 \(b\) を使うことも多いです。単位質量の溶媒当たりの物質量。 名称に「濃度」と付いていますが、組成比であって濃度ではなく、異なる次元を持つ物理量であることに注意しましょう) を取る流儀もありますが、以下の話ではモル濃度にもとづく標準状態を取ることにします。
質量モル濃度にもとづく標準状態をとる流儀では、標準状態 \(m^\circ\) をたいてい 1 mol/kg にとり、溶媒が水の場合には密度がほとんど 1 kg/L なので、 濃度が低い場合にはモル濃度と数値がほとんど変わらず(25 °C で 0.3 %)、しばしば混同されます。 けれどもこのおはなしで取り上げるファントホッフの式の場合あらわになるように、 本質的な差異が存在するので注意が必要です。 なおぼくは好みませんが、公的にはこの質量モル濃度にもとづく標準状態の取り方を推奨する方向です。
式 \eqref{eq:mudil} の関係から、反応のギブズエネルギー変化は、反応・生成物の濃度を用い次式のように表されます:
\begin{eqnarray} \Delta_{\mrm{r}}G &=& \sum_i {\nu_i \mu_i} = \sum_i {\nu_i \mu_i^\circ} + RT \sum_i {\nu_i \ln \frac{c_i}{c^\circ}}\\ &=& \Delta_{\mrm{r}}G^\circ + RT \ln \prod_i {c_i^{\nu_i}} - RT \ln {c^\circ}^{\sum_i {\nu_i}}\\ &=& \Delta_{\mrm{r}}G^\circ + RT \ln Q \label{eq:eqconst0} \end{eqnarray}
ここで \(Q\) は反応商 reaction quotient と呼ばれる量です。 問題にしている A と B の会合平衡 A + B ⇌ AB の場合について、 あらわに書けば次のようになります:
\begin{eqnarray} \Delta_{\mrm{r}}G &=& \Delta_{\mrm{r}}G^\circ + RT \ln \frac{c^{\circ} [\mrm{AB}]}{[\mrm{A}][\mrm{B}]} \nonumber\\ Q &=& \frac{c^{\circ} [\mrm{AB}]}{[\mrm{A}][\mrm{B}]} \label{eq:eqconstab} \end{eqnarray}
温度 \(T\)、圧力 \(P\) 一定の条件の下での化学平衡状態では、 ギブズエネルギーが最小となり \(\Delta_{\mrm{r}}G = 0\) となるので、 次式が成り立ちます。
\begin{equation} \Delta_{\mrm{r}}G^\circ = -RT \ln {}^{\natural}Q = -RT \ln K \label{eq:eqconst1} \end{equation}
ここで記号の左肩の \(\natural\) は、化学平衡状態を示します。 ここで
\begin{equation} K = {}^{\natural}Q = {c^\circ}^{-\sum_i {\nu_i}} \prod_i {{}^{\natural}c_i^{\nu_i}} = \prod_i {{}^{\natural}a_i^{\nu_i}} \label{eq:eqconst} \end{equation}
を熱力学平衡定数(あるいは標準平衡定数 \(K^{\circ}\))と呼びます。 A と B の会合平衡 A + B ⇌ AB の場合は次のようになります:
\begin{equation} \Delta_{\mrm{r}}G^\circ = \mu^\circ_\mrm{AB} - (\mu^\circ_\mrm{A} + \mu^\circ_\mrm{B}) = - RT \ln K \label{eq:eqconstabx} \end{equation}
\begin{equation} K = {}^{\natural}Q = \frac{c^{\circ} {}^{\natural}[\mrm{AB}]}{{}^{\natural}[\mrm{A}] {}^{\natural}[\mrm{B}]} = \frac{{}^{\natural}a_\mrm{AB}}{{}^{\natural}a_\mrm{A} {}^{\natural}a_\mrm{B}} \end{equation}
なお化学平衡状態であることを示す記号(ここではぼくの好みで \(\natural\) を付しています)を省くこともよくあります。 「察してくれよ」というわけですが、いろいろ混乱のもとになることがあります。
熱力学平衡定数 thermodynamic equilibrium constant にかかわっては、(ぼくは好みませんが) 質量モル濃度にもとづく標準状態をとり、 標準平衡定数 standard equilibrium constant \(K^{\circ}\) と呼ぶことが推奨されています。 けれどもあまり一般的にはなっていないようです。 また同時に溶液の標準状態の圧力として 1 bar(= 100 kPa)を取ることが推奨されています。 ですから濃度(あるいは組成)の標準状態を定めれば、熱力学平衡定数(標準平衡定数)は温度のみの関数ということになります。 温度の設定には自由度をもたせる一方、圧力については標準状態を定めるというのは、 化学工学方面ではよく用いられる手法で、 圧力下の平衡定数(化学平衡状態の反応商)は「見かけの平衡定数」と呼ばれることになります。 ぼくのように溶液の標準状態の圧力を定めない、温度・圧力に依存する平衡定数を考える立場もありますが、 「熱力学平衡定数」とは呼べない世間の空気になりつつあるのかもしれません・・・
熱力学平衡定数(標準平衡定数)を単に平衡定数と呼んだりもします。 熱力学平衡定数は単位 1 の無次元の量で、一般に標準状態の取り方によって値が変化し、 熱力学平衡定数には(往々にして忘れられがちですが)標準状態を記すことが必要です。
また同様に、さまざまな平衡定数の表現が行われているので注意が必要です。 標準状態の濃度として通常、単位濃度(通例 1 mol/L)が取られるので、 あからさまに \(c^\circ\) を書かず、単位を持つ「平衡定数」を扱う流儀もあり、 区別する時は濃度平衡定数 \(K_c\) と呼ばれます。 またこの方が濃度にもとづいて標準状態を設定していることを、あからさまに表すことができます。 皆さんは高校時代から酸解離定数(Ka = [H+][A-]/[HA])などの表現で出会っていて、 熱力学平衡定数よりむしろおなじみでしょう。 A と B の会合平衡 A + B ⇌ AB の場合であれば、mol-1 L といった単位を持つことになります。
\begin{equation} K_c = \prod_i {{}^{\natural}c_i^{\nu_i}} = \frac{{}^{\natural}[\mrm{AB}]}{{}^{\natural}[\mrm{A}] {}^{\natural}[\mrm{B}]} \label{eq:eqconstcon} \end{equation}
濃度ではなく、組成にもとづいて標準状態を取ることもよく行われ、 質量モル濃度 \(m\) で平衡定数を表すこともしばしば行われます(繰り返しになりますが、質量モル濃度は濃度ではなく、組成比であることに注意してください)。 この場合も濃度平衡定数同様、 あからさまに \(m^\circ\) (たいてい 1 mol/kg)を書かず、単位を持つ平衡定数を扱う流儀もあり、 区別する時は質量モル濃度平衡定数 \(K_m\) と呼ばれます。 A と B の会合平衡 A + B ⇌ AB の場合であれば、mol-1 kg といった単位を持ちます。
\begin{equation} K_m = \prod_i {{}^{\natural}m_i^{\nu_i}} = \frac{{}^{\natural}m_\mrm{AB}}{{}^{\natural}m_\mrm{A} {}^{\natural}m_\mrm{B}} \label{eq:eqconstmol} \end{equation}
溶液ではまず見かけませんが、混合気体を扱う際には、 モル分率 \(x\) で表すこともあり、 モル分率平衡定数 \(K_x\) と呼ばれます。 標準状態のモル分率 \(x^\circ\) には一般に \(x = 1\) が取られ、 あからさまに表記されることはまずありません。 また \(K_x\) は無次元量です。
\begin{equation} K_x = \prod_i {{}^{\natural}x_i^{\nu_i}} = \frac{{}^{\natural}x_\mrm{AB}}{{}^{\natural}x_\mrm{A} {}^{\natural}x_\mrm{B}} \label{eq:eqconstfrac} \end{equation}
混合気体を扱う際には、 高校でも登場しますが、分圧 \(p_i\) で表すのがむしろ普通で、 標準状態の圧力 \(P^\circ\) には 1 bar(= 100 kPa)あるいは 1 atm(= 101.325 kPa)がよく用いられます。 あからさまに \(P^\circ\) を書かず、単位を持つ平衡定数を扱う流儀もあり、 圧力平衡定数 \(K_P\) と呼ばれます。 A と B の会合平衡 A + B ⇌ AB であれば、たとえば bar-1 という単位を持ちます。
\begin{equation} K_P = \prod_i {{}^{\natural}p_i^{\nu_i}} = \frac{{}^{\natural}p_\mrm{AB}}{{}^{\natural}p_\mrm{A} {}^{\natural}p_\mrm{B}} \label{eq:eqconstpp} \end{equation}
平衡定数は「質量作用の法則」の昔(1864 年)から、さまざまな分野で議論され、 それぞれの分野にとって便利で使いやすい形で表現されてきました。 そのため濃度・組成の表現にさまざまな流儀があるように、 平衡定数の表現にもさまざまな流儀が生まれてました。 この 30 年ばかりの間に標準化が進みつつありますが、 今も混乱があり、その綻びが露わになることがあります。 このおはなしで扱うファントホッフの式は、その典型と言っていいかもしれません。