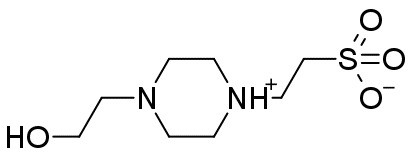
 。
いわゆる Good の緩衝液(Good は人名)の1つで、よく目にします。
。
いわゆる Good の緩衝液(Good は人名)の1つで、よく目にします。
pH や酸化還元電位などの大きな変動を和らげる溶液を緩衝液(緩衝溶液 buffer solution)と呼び、 通常、弱酸の解離平衡を利用する pH 緩衝液を指します。 弱酸 HA の解離平衡 HA ⇌ H+ + A- を考えると、pH と解離定数 Ka = [H+][A-]/[HA] の間に次の関係が成り立ちます。
pH = pKa + log [A-]/[HA]
ですから弱酸 HA とその共役塩基 A- の濃度が十分大きく、 実験中の反応などによる濃度変動が無視できるなら、 pH の値は pKa 近傍の値で安定に保つことができます。 なお弱酸と共役塩基の濃度比 [A-]/[HA] を調整することで、設定する pH の値を変えることができますが、 これには限度があります。 たいていの実験では数 mmol/L 程度ぐらいまでの濃度での応答をみるので、 実験に影響を及ぼさないように緩衝液に使用する酸塩基の濃度は 0.1 mol/L 以内には抑えたいところで、 また pH を安定にするには、弱酸 HA とその共役塩基の濃度は 0.01 mol/L 程度は欲しいところです。 このため弱酸と共役塩基の濃度比で変えることのできる緩衝液の pH の値は、 およそ pKa ± 1.0 の範囲になります。
ここでは pH の代表的な緩衝液として、pH 標準液、Clark-Lubs の緩衝液、 トリス緩衝液を取り上げます。 またしばしば問題になる緩衝液の pH の温度依存性についてもまとめておきます。
公的に pH の値の基準となる緩衝液が定められています(JIS 8802:2011「pH測定方法」)。 国家認定を受けた製造者の供給する「認証 pH 標準液」を購入して使用することもできますが、 次の処方箋に沿って調製した「調製 pH 標準液」を使用することもできます(カッコ内の pH の値は 25 °C における典型値。試薬の精製法は省略)。 高い精度を求めないのであれば、調製 pH 標準液に準ずるもので十分でしょう。
pH や 体積(1 L)は 25 °C における値です。 他の温度における pH の値は「pH の原理と測定」の付表を参照してください。 以前は容量モル濃度で定義されていたので、用いる試薬のおもさが以前の規格と若干変わっています。
実際に学生実験で使用する分には、市販のフタル酸水素カリウムなどをそのまま用いています (二シュウ酸三水素カリウム二水和物はシュウ酸の在庫がたくさんあるので、合成・再結晶したものを使用)。 1 L 作るようにしていますが、おもさは 0.01 g までの秤量で済ましています。 また炭酸塩緩衝液については、セスキ炭酸ナトリウム(トロナ) Na2CO3·NaHCO3·2H2O 4.75 g(0.025 mol)を水に溶かして 1 L にするということにしています。 これまでのところ、実験で得られた酢酸やトリスの pKa 値などには問題がなく、 こうした調製法は妥当なものと判断しています。
Clark-Lubs の緩衝液は古くから知られた緩衝液で、精度は高くありませんが、 ありふれた試薬の組合せで幅広い pH 領域の緩衝液を構成できます (W. M. Clark and H. A. Lubs, J. Bacteriol. 2, 1 (1917)。 この論文は酸塩基指示薬による pH 決定に関する第1部で、 第2部、 第3部が引き続き刊行されています。 W. M. Clark and H. A. Lubs, J. Biol. Chem. 25, 479 (1916) も参考になります)。 この緩衝液は JIS K8001「試薬試験方法通則」にも採用されています (緩衝能については、その後詳細に検討されています)。
Clark-Lubs の緩衝液は pH 領域に応じて 5 種類あり、20 °C で使用することが想定されています。 次の A~F の物質 X について、それぞれの 0.2 mol/L 溶液を、下表のように VX mLずつを混合し、 水を加えて全量を 200 mL にして調製します (原報によります。 文献によっては全量が 100 mL になるように数値を調整していることなどがあります)。
たとえば pH 5.0 の緩衝液であれば、 0.2 mol/L のフタル酸水素カリウム溶液 50.00 mL と 0.2 mol/L の水酸化ナトリウム溶液 23.85 mL を混ぜ、 水を加えて 200 mL にするわけです。 なお pH 7.8~10.0 の緩衝液で VB+F としてあるのは、 B と F それぞれが 0.2 mol/L、つまり 1 L 中に塩化カリウム 14.91 g、ホウ酸 12.37 g 溶けた溶液のことです (原報は当時の原子量が今と違っているので(ホウ素 B の原子量が 11 だった時代)、少しちがう重さ 12.4048 g を取っています。 今の原子量を使うのは適切でないかもしれませんが、精度的に問題ないと思うので 0.2 mol/L の ”顔” を立てています)。
| pH | 1.0 | 1.2 | 1.4 | 1.6 | 1.8 | 2.0 | 2.2 |
| VA | 97.0 | 64.5 | 41.5 | 26.3 | 16.6 | 10.6 | 6.7 |
| VB | 50.0 | 50.0 | 50.0 | 50.0 | 50.0 | 50.0 | 50.0 |
| pH | 2.2 | 2.4 | 2.6 | 2.8 | 3.0 | 3.2 | 3.4 | 3.6 | 3.8 |
| VA | 46.70 | 39.60 | 32.95 | 26.42 | 20.32 | 14.70 | 9.90 | 5.97 | 2.63 |
| VC | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 |
| pH | 4.0 | 4.2 | 4.4 | 4.6 | 4.8 | 5.0 | 5.2 | 5.4 | 5.6 | 5.8 | 6.0 | 6.2 |
| VD | 0.40 | 3.70 | 7.50 | 12.15 | 17.70 | 23.85 | 29.95 | 35.45 | 39.85 | 43.00 | 45.45 | 47.00 |
| VC | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 |
| pH | 5.8 | 6.0 | 6.2 | 6.4 | 6.6 | 6.8 | 7.0 | 7.2 | 7.4 | 7.6 | 7.8 | 8.0 |
| VD | 3.72 | 5.70 | 8.60 | 12.60 | 17.80 | 23.65 | 29.63 | 35.00 | 39.50 | 42.80 | 45.20 | 46.80 |
| VE | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 |
| pH | 7.8 | 8.0 | 8.2 | 8.4 | 8.6 | 8.8 | 9.0 | 9.2 | 9.4 | 9.6 | 9.8 | 10.0 |
| VD | 2.61 | 3.97 | 5.90 | 8.50 | 12.00 | 16.30 | 21.30 | 26.70 | 32.00 | 36.85 | 40.80 | 43.90 |
| VB+F | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 | 50.00 |
トリス(ヒドロキシメチル)アミノメタン(単にトリスと呼ばれます。(CH2OH)3CNH2)は、 生物化学的な用途でよく使用されます。 さまざまな処方が知られていますが、下記は Bates と Bower による Clark-Lubs にならった処方で、 0.1 mol/L のトリス(ヒドロキシメチル)アミノメタン溶液 Vtris mLと 0.1 mol/L 塩酸 VHCl mL を表 6 のように取って混ぜ、 水を加えて100 mL にします(Clark-Lubs の半分のスケール)。 なおこれは 25 °C の値で、温度を 1 °C 上げると pH は 0.03 程度減少します。
| pH | 7.0 | 7.2 | 7.4 | 7.6 | 7.8 | 8.0 | 8.2 | 8.4 | 8.6 | 8.8 | 9.0 |
| VHCl | 46.6 | 44.7 | 42.0 | 38.5 | 34.5 | 29.2 | 22.9 | 17.2 | 12.4 | 8.5 | 5.7 |
| Vtris | 50.0 | 50.0 | 50.0 | 50.0 | 50.0 | 50.0 | 50.0 | 50.0 | 50.0 | 50.0 | 50.0 |
緩衝液の pH 温度依存性は、緩衝液を構成する酸解離定数 Ka の温度依存性でほぼ評価できます。 酸解離定数の温度依存性は、ファントホッフの関係から、 解離のエンタルピー変化 ΔrH を用いて次式で評価されます(R は気体定数、T は熱力学温度)
ln 10 × d pKa/dT = ΔrH/RT2
酸解離反応のエンタルピー変化は、一般に強酸は発熱的で弱酸は吸熱的、 また電荷の変化のない反応(たとえば NH4+ ⇌ H+ + NH3 )の方がより吸熱的になります。 表 7 には Goldberg らがまとめた緩衝液に関わる酸解離の標準エンタルピー変化 ΔrH° (R. N. Goldberg, N. Kishore, and R. M. Lennen, J. Phys. Chem. Ref. Data, 31, 231 (2002)) から、学生実験に関わりそうなものをまとめました (25 °C、イオン強度 0 での値です)。
| 酸 | 化学式 | pKa | ΔrH° /kJ mol-1 | 103 (dpKa/dT)/K-1 |
|---|---|---|---|---|
| 酢酸 | CH3COOH | 4.756 | -0.41 | -0.2 |
| アンモニア | NH4+ | 9.245 | 51.95 | 31 |
| ホウ酸 | H3BO3 | 9.237 | 13.8 | 8.1 |
| 炭酸 | H2CO3 | 6.351 | 9.15 | 5.4 |
| HCO3- | 10.329 | 14.7 | 8.6 | |
| HEPES* | C8H18N2O4S | 7.564 | 20.4 | 12.0 |
| シュウ酸 | H2C2O4 | 1.27 | -3.9 | -2.3 |
| HC2O4- | 4.266 | 7.00 | 4.1 | |
| リン酸 | H3PO4 | 2.148 | -8.0 | -4.7 |
| H2PO4- | 7.198 | 3.6 | 2.1 | |
| HPO42- | 12.35 | 16.0 | 9.4 | |
| フタル酸 | C8H6O4 | 2.950 | -2.70 | -1.6 |
| C8H5O4- | 5.408 | -2.17 | -1.3 | |
| 硫酸 | HSO4- | 1.987 | -22.4 | -13.2 |
| トリス | C4H12NO3+ | 8.072 | 47.45 | 28 |
 。
いわゆる Good の緩衝液(Good は人名)の1つで、よく目にします。
。
いわゆる Good の緩衝液(Good は人名)の1つで、よく目にします。