
ホットプレート上で、試料溶液 A と B に塩酸と金属アルミニウムを加えて加熱しているところ。 時計皿に付いた水滴は後で溶液に洗い落とす。
金属アルミニウムを加えて銅を析出分離させた後、 ジメチルグリオキシム溶液を加えてニッケル塩を沈殿分離する。 沈殿を塩酸に溶解し、一定量のEDTAを加えてニッケルの錯体を生成させる。 指示薬としてエリオクロムブラックT (EBT)を加え、pHを調整した後、 亜鉛標準溶液で過剰のEDTAを滴定する。
★同様の操作を試料溶液Bについても行う。
(注2)酒石酸を加えるのはキレートを生成させることで水酸化アルミニウムの沈殿を防ぐためである。 中和後に、水酸化アルミニウムの沈殿が出た場合には溶液を酸性にもどし、沈殿を溶解させてから、酒石酸を過剰に加える。
(注3)各机に置かれたホットプレートに水を入れ(水を入れすぎないように注意)、 穏やかに沸騰する程度にして使用する。蒸発を防ぐため、発泡スチロール製のビーズを浮かべるとよい。
(注4)沈殿の組成はNi(C4H7N2O2)2である。 あらかじめ恒量化したガラスフィルターを用いれば重量分析も可能である。 沈殿を110-120 °C の空気浴で約1時間乾燥し、 デシケーター中で放冷後、重量を測る。恒量になるまでこの操作を繰り返す。
(注5)EBT指示薬を加える前に、EDTA溶液を加えて混合する。順序を逆にすると、一端生じたNi-EBTキレートのEDTAとのキレート交換反応が遅いため変色が見づらい。
ニッケルの定量操作のアウトライン、注意点については、以前の合金の分析ノート でも紹介しました。 その後の操作上の変更点は、「水浴上加熱」を「水浴中加熱」にしたこと、塩酸濃度を下げた(8 mol/L を 6 mol/L に)ぐらいでしょうか。 ここではもう少し原理的なことや、 操作の変更点について紹介しておきます。

実験では溶液中の銅イオンを還元して金属銅として除去するのに金属アルミニウムを用いています。
3Cu2+ + 2Al → 3Cu + 2Al3+
アルミニウムのイオン化傾向は大きく(Al3+ + 3e ⇌ Al の標準電位は -1.66 V)、 まず銅が析出し(Cu2+ + 2e ⇌ Cu の標準電位は +0.34 V)、 その後水素発生(2H+ + 2e ⇌ H2 は 0.00 V)、 ニッケルは水素よりイオン化傾向が大きいので(Ni2+ + 2e ⇌ Ni は -0.26 V) 酸性であるならニッケルは後に残る。 何の不思議もなさそうですが、 ここのところはまじめに考えると難しい問題を含んでいます。 イオン化傾向の順序通りに反応が進行するのかどうかは、自明ではありません。 実際、観察してみれば金属銅の析出が完了する前に、 水素の発生が起きているはずです。
以前、アルミニウムの代わりに金属亜鉛を使って、 銅の除去を行ってみたことがあります。 亜鉛のイオン化傾向はアルミニウムより小さいのですが (Zn2+ + 2e ⇌ Zn の標準電位は -0.76 V)、 この時、金属亜鉛で処理した後の溶液からは、 銅はもちろん、ニッケルも失われていました(ニッケルジメチルグリオキシムが出なかった)。 水素イオンが水素発生で失われる前に、金属ニッケルの析出が起きてしまったのです。
イオン化傾向だけで考えれば、銅の分離に使うのに、アルミニウムでも亜鉛でもいいはずですが、 亜鉛だとニッケルも一緒に除かれてしまいます。 水溶液の電気分解で亜鉛メッキができるという話を 知っている人もいると思います。 イオン化傾向だけからいえば、カソード還元で、水素の発生が金属亜鉛の析出より優先的に起きそうなのに、 実際には必ずしもそうなりません。 金属亜鉛の表面からの水素発生が起きにくく、 金属亜鉛の析出の方が優先されるのです。 同様のことはボルタの電池(硫酸中に浸した亜鉛板と銅板で構成)でも見られるところで、 亜鉛板から水素が発生しにくいので、 水素は亜鉛から電子を受け取った銅板からもっぱら出てきます。
電位からだけ見れば起きそうに見えるのに起きない。 これは反応速度という立場で見ると、活性化エネルギーが大きいことに相当します。 よく「温度を上げて活性化エネルギーの山を越える」といった話がありますが、 電気化学では「電圧をかけて活性化エネルギーの山を越える」ということが行われます。 こうした反応を起こすのに必要な電圧を過電圧 overpotential (overvoltage) といいます (普通、大学では教わるはずですが、・・・)。 水素の発生に必要な過電圧はよく研究されていて、水素過電圧と呼ばれ、 亜鉛は水素過電圧の大きい代表格です(だいたい0.5 Vくらい。水銀はさらに大きい。 水素過電圧の小さい代表格はプラチナでほとんど 0)。 標準電位(イオン化傾向)を調べて、反応が起きるかどうかを調べるのは無論重要ですが、 実際に反応させる分には、過電圧の問題を押さえておく必要があるのです。
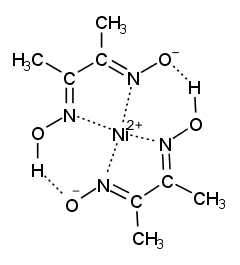
ジメチルグリオキシムは分析化学における有機試薬の草分けのような存在で(L. Tschugaeff (Chugaev), 1905)、 ニッケルと特異的に沈殿を作る試薬として今も現役です。 水にほとんど溶けないので、もっぱらエタノール溶液として使うのですが、 ジメチルグリオキシムの固体が、これまたなかなかエタノールに溶けてくれず、 結構苦労します。 水酸化ナトリウム溶液にして使用するという手もありますが、 できるニッケルジメチルグリオキシムの沈殿が非常に微細なものになるようで採用していません (JIS でももっぱらエタノール溶液を採用していますが、 JIS G1216「鉄及び鋼-ニッケル定量方法」などでは、 水酸化ナトリウムの1 %溶液に溶かしたジメチルグリオキシム溶液も併記しています)。 なおジメチルグリオキシムは鉄(II) と可溶性の赤色錯体を作り、 鉄(II) の定性試験にも用いられます。
ニッケルジメチルグリオキシムは pH が低すぎても高すぎても分解するので、 定量する上ではある程度 pH の調整をしておく必要があります (ジメチルグリオキシムの pKa はpK1、pK2 が近接した値を取り、およそ 11 程度のようです)。 アンモニアを加えていくと、メチルレッドは pH 5 程度で赤から黄色に変色します。 後から加えた酒石酸などもすべて中和し、ここにアンモニア水を加えて pH 8-9 程度にするわけです(銅が残っていると、銅アンミン錯体の青みがかった感じになる)。 またニッケル(II) の溶液とジメチルグリオキシムを混合した直後だと、 結晶が細かくてろ過などで難渋することがあるので、30分ぐらい水浴中で加熱して沈殿を熟成させることにしています (2015年度から水浴中加熱になり、30分の加温熟成を付け加えました。 熟成させると再溶解が困難になるわけですが、所定の手法で問題なく再溶解できています)。 ニッケルジメチルグリオキシムは中性で、 少し水をはじく性質があり、この熟成操作の間、溶液の表面に浮かんだりして、 いろんな顔を見せてくれます。 なおアルミニウムによる銅の除去が不十分で銅が残っていると、 銅のジメチルグリオキシム錯体ができて、 溶液が浅黒い色になりますが、特に問題はありません。

問題になるのは、水酸化アルミニウムが出てくるケースです。 金属アルミニウムで銅を除去する操作をやり過ぎると、 写真のような白く濁ったニッケルジメチルグリオキシムを作る学生さんが現れます。 アンモニアでの中和の段階で濁ってくるので気が付きそうなものですが、 なかなか見えないもののようです。 こうなったら塩酸を加えて再溶解 (水酸化アルミニウムの沈殿が熟成していると時間がかかる)、 酒石酸を追加し、もう一度アンモニア水を加えて中和するところからやり直すことになります それでも水酸化アルミニウムが出てくるようなら、銅の分離からやり直すのがよいでしょう。 なお酒石酸の代わりにクエン酸を使う流儀もあるようですが、 ここでは JIS H1056(旧版)に合わせて酒石酸にしています。
水浴(湯浴)を用いた加熱は料理で言うと”湯煎”に相当しますが、 以前の化学実験では蒸気による加熱、水浴上加熱をもっぱら用いていました。 これは熱源がガスバーナーだったためです。 誰が考案したか知りませんが、 熱伝導のよい銅製のなべに、銅のリングを組み合わせた蓋を置く水浴(「重湯煎器」と呼ぶようです)を用い、 開口部から出てくる蒸気をビーカーやフラスコに当てる形でした。 料理などでも経験するところですが、 60 °C ぐらいまでであれば、 直接熱湯にボールなどを浸けて加熱してもあまり問題ないですが、 それ以上になると蒸気が盛んに出ますし、 また熱くてミトンなどしていても、持っているのが辛抱できなくなってきます。 化学の実験では 80 °C ぐらいは欲しいことが多く、 料理で蒸し器の登場となるように、 自ずとこの形になったようです。
それが火気を嫌う関係でバーナーを使わずに電熱を利用するようになって、 まず有機化学実験で銅製の水浴は姿を消しました。 無機・分析化学の実験でも、 バーナーによる加熱は温度調節が難しく敬遠されがちで、 何より電熱器具が安価に入手できるようになったので (銅製の水浴1個で一人鍋用の電気鍋が2個買える!)、 思い切って 2015 年度から乳酸の分析の課題の導入とも合わせて全面的に電気鍋に移行し、 同時に「水浴上加熱」を「水浴中加熱」に転換しました。 個人的にはなじみのある器具で、 サヨナラするには忍びないものがありますが、 致し方ないと思っている次第です。

|
水浴上加熱の様子。 ガスバーナーで湯を沸かして蒸気で加熱しています。 銅製の鍋の上に、銅製のリングでできた蓋が付いていて(重湯煎器)、 加熱するビーカーやフラスコのサイズに応じて、 リングを外して開口を調節します。 空焚き注意! |

|
一人鍋用の電気鍋を用いた水浴中での加熱。 100 mLのビーカーが4個ぐらい入ります。 溢れないよう、湯の量の調節にご用心。 水の蒸発を防ぐために白い発泡スチロールのビーズを入れています。 乳酸の分析でも使用。 |

実験操作全体を見渡して、あまり目立たないようですが、 この実験で重要な操作が、 ニッケルと亜鉛の分離が実際に行われる、 ニッケルジメチルグリオキシムの沈殿のろ過・洗浄と塩酸による溶解です。
沈殿が微細であるとろ過速度が遅く、 ろ過・洗浄にたいへん時間がかかります。 沈殿の生成、熟成が指定どおりになされておれば問題はあまりないはずですが、 時として非常に手間取る人がいたりします。 そういう時にまず疑われるのは、水酸化アルミニウムができている可能性です。 ニッケルジメチルグリオキシムの沈殿を作る時、 水酸化アルミニウムができて液が濁っているのを見過ごして操作を進めていくと、 ここで水酸化アルミニウムの沈殿がろ紙が目詰まりさせるのです。 ニッケルジメチルグリオキシムの沈殿の様子を見直して水酸化アルミニウムのあることを確認したら、 もう一度銅の分離に立ち返ってやり直すのがたぶん賢明です。 水酸化アルミニウムができていなくとも、 何かの事情で沈殿が微細で時間のかかるケースもありますが、 そういう場合は辛抱強く、ろ過・洗浄操作を行うことになります。
さて上記テキストには、一般にこうした沈殿等の扱いで指定されているように、 「温イオン交換水で十分洗浄する」としてありますが なぜ温水なのかは論点です。 ちょっと考えてみると、溶解度は一般に温度を上げると大きくなりますから、 温水を使わずに冷水で洗浄した方がよさそうです。
温水を使用するのは、台所で食器を洗うのに温水を使用するのと似たところがあります。 大きなポイントは水の粘度が下がることです。 水の粘度は室温付近でおよそ 1 mPa s(1 cP。cP はセンチポアズで CGS 系の単位。日本では法定計量単位として認められています)、 50 °C で 0.5 mPa s、80 °C で 0.3 mPa s と小さくなっていきます。 理屈を言うといろいろ難しい話がありますが、 洗浄で重要な、沈殿やろ紙と水の境界付近は流れが遅く、粘度が流れを決めているとみてよいのです。 粘度の次元を考えてもらうと、 [質量]×[長さ]-1×[時間]-1になりますから、 粘度で速さが支配されている現象では 粘度が半分になることは単位時間が2倍になることに相当します。 つまり倍速モードでビデオをみるようなもので、 スピードアップにつながるのです。
もう一つの大きなポイントは、 一般の化学反応と同じで、沈殿からの種々のイオンなどの脱離速度が上がることです。 イオンの吸着平衡については、発熱、吸熱いろんなケースがありますが、 ここでは水にはほとんど吸着しているイオンがない状態ですので、 脱離だけを考えることになります。 もっとも、肝心の沈殿が溶解してもらっては困るので、 無論、沈殿の溶解が無視できる範囲でということになります。 この点、今回の実験で、洗浄したろ液を室温で放置しておくと、 ニッケルジメチルオキシムの析出が認められることがあります。 たいてい少量で無視できる程度の量なのですが、 使用する洗浄水に少しアンモニアを加え、pH を上げておくとよいのかもしれません。
なおこう見てくると、最初の金属アルミニウムを取り除く段階でのろ過で、 単に「ろ紙をイオン交換水で洗浄する」としてあるのも、 温水が望ましいことになります。 もっともな話で、実は下敷きにした JIS の規格には「温硫酸(1+100)で洗浄」 (硫酸(1+100)は濃硫酸と水を体積比で1:100で混合した硫酸。 また「温硫酸」というのは 40 °C~ 60 °C の硫酸) としてあります。 テキストでは単に「水で洗浄」にしていますが、慎重な人は温水を使っていただいた方がよいのです。
ニッケルはEBT と安定なキレートを生成するので、 EBT 指示薬を用いて EDTA で直接滴定することはできません(ブロッキングあるいは閉塞現象と呼ばれます)。 けれども EDTA を過剰に加えて、ニッケルをEDTA キレートにしてから、 亜鉛溶液で過剰の EDTA を滴定するという、逆滴定であれば EBT 指示薬で滴定が可能となります。
確かにそれで定量できているのだからいいのですが、 ちょっと腑に落ちないものが残っています。 亜鉛で滴定して亜鉛を入れすぎて赤くなってしまった時、 EDTA 溶液を継ぎ足すと青に戻りはするのですが、 赤みが残っているように見えるのです。 これはニッケルの EBT キレートができているためのようです。 とするとニッケルの EDTA キレートが、遊離の EDTA が少ない条件下では、 EBT と配位子交換を起こしていることになります。
亜鉛の EDTA キレートはニッケルの EDTA キレートより不安定です(生成定数の対数 log K は Zn 16.5、Ni 18.6)。 もしかすると平衡でのキレートの安定性の順番は Zn-EBT < Zn-EDTA < Ni-EDTA < Ni-EBT ということなっているのかもしれません。 EDTA を過剰に加えた後、ニッケルは全量 Ni-EDTA キレートになる。 ここに EBT 指示薬を加えても、EDTA が過剰に存在している間は、 Ni-EDTA キレートの解離平衡がキレート側に偏っていて、 Ni-EBT キレートができない。 亜鉛溶液を滴下していって、遊離の EDTA が失われると(滴定終点)、 Ni-EBT キレートの生成がゆっくりではあるが起きるようになる。
一端できた Ni-EBT キレートが、大過剰の EDTA を加えても分解しないことを考えると、 単に置換不活性というだけではなく、 Ni-EDTA キレートの生成平衡も加味した、 こういうシナリオが妥当なのかもしれません。 このあたりはまだ検討が必要です。