|
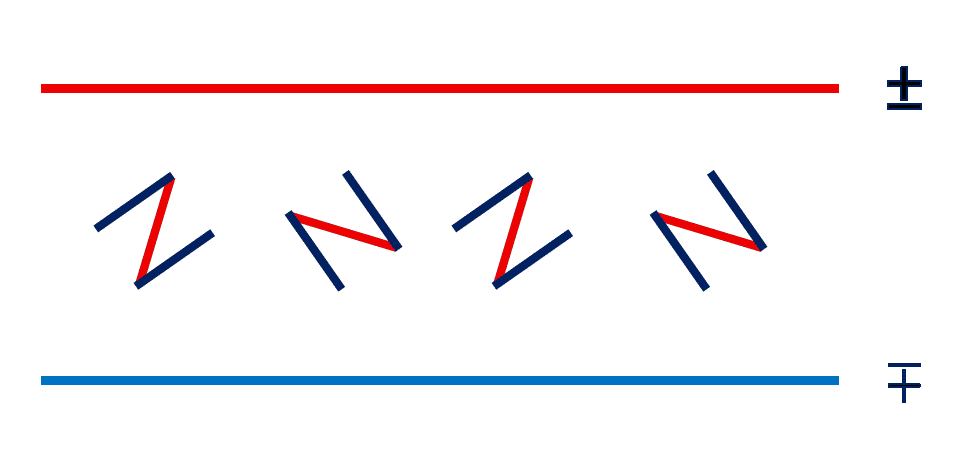
| 図 1.変動する電場に置かれた N 型の分子。 図には 90° ずつ回転した N 型分子を書いていますが(2回回転すると同じ配向)、 どの配向でも、放出する電磁波の振動面は、受信した振動面から 30° 傾きます。 |
糖は食品とも関わって、その応用・研究は長い歴史を持ち、 多くの化学者がその反応や物性と格闘してきました。 ここでは容易に入手可能な数少ない物質の一つでもあるショ糖を題材に、 高校までに学んでいることを中心に、 少し深く糖の化学に親しんでもらうことになります。
光は横波なので、進行方向に対し、振動する方向が2つあります。 この振動する方向(振動面)が偏っている光を偏光と呼びます (振動数が 100 万倍ぐらい異なりますが、テレビやスマホの電波も同じ電磁波で、 同様に振動面の偏りがあり、こちらは偏波と呼ばれます)。 旋光というのはこの振動方向を変化させる現象で、 鏡像対称を持たない分子は旋光作用を示し(光学活性、旋光能)、 生理活性が異なることなどは高校までに学んでいるでしょう。 けれども旋光を示すからと言って、どのように、どの程度、振動面が回転するかについては、 あまりはっきり認識されていないようです。 この課題では、実際に旋光度を測定する装置を組み立て、 それを ”体感” してもらいます。

|
| 図 1.変動する電場に置かれた N 型の分子。 図には 90° ずつ回転した N 型分子を書いていますが(2回回転すると同じ配向)、 どの配向でも、放出する電磁波の振動面は、受信した振動面から 30° 傾きます。 |
光の波長は数百 nm で分子のサイズに比べれば非常に長く、 光が物質中を伝播していくとき、 分子から見ると電場が時間とともに変化するだけです(位相の距離変化は感じ取れません)。 そして分子の中の電子が電場にゆすぶられ、 分子は光の吸収・放出を繰り返すことになります。 この時、分子によっては、この光の吸収・放出の方向が最初の光の振動の方向とは異なり、 光の振動する方向が変化します。 図 1 には、液体中で N 型をした分子が光の中で変動する電場を感じている様子を、 2次元的な絵にしてみました。 この N 型の分子は、斜め方向の赤線で電場の変動を受信し、 それと 30° の角度で交わる2本の平行な藍色の線から光を放射するとします。 N 型の分子はさまざまな配向を取っているわけですが、 どの配向を取るにしろ、受信した変動方向と(紙面上方から眺めて) 30° 右に傾いた方向に振動する光を放射します。 そしてこうした分子からの光の吸収・放射を平均化したものが、電場の振動方向の変化として現れ、 こうした現象を旋光と呼びます。 図 1 では N 型の分子を考えたのですが、これが H 型をしておれば、 ±90° 方向に光の放射がおき、 打ち消しあって振動面の変化は現れません。 あるいは鏡像の И 型の分子であれば、 振動面が逆に左に傾くことになります。 つまり対掌体が、光学異性体でもあるということになるわけです。
|
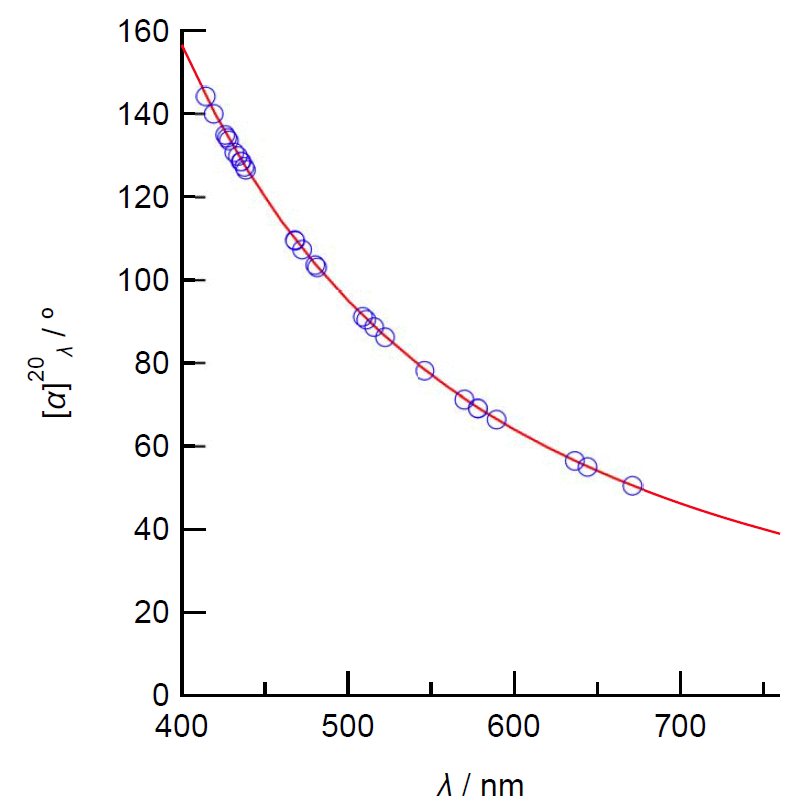
| 図 2.ショ糖の比旋光度 [α] の波長依存性。20 °C。 赤線は NIST の標準試料の証明書の分散式から計算したもの。 青丸は International Critical Tables Vol. 2 (1927) 所載のデータ。 |
さて振動面の傾きの変化 θ は、 旋光に寄与する分子がそれぞれ独立に振舞っているなら、 光が通過する経路(光路)に存在する分子の数に比例するはずで、 単位面積当たりの分子の数は濃度 c と光路の長さ d の積になり、 θ = [α] c d と表されます。 この [α] を比旋光度(旋光能)と呼びます。 比旋光度は波長によって変化し、 たいてい波長が短いほど(赤より青の方が)値が大きくなります。 図 2 にはショ糖の比旋光度の波長依存性を示しました。 ショ糖の比旋光度は、590 nm(D 線。オレンジ色)では 67° ですが、 430 nm(青紫)ではほぼ2倍の 133° になります。 フルクトースは逆方向(左回り)の偏光を示しますが、 同様に 590 nm で -90° ぐらいのものが、 430 nm ではほぼ -180° ぐらいになります。
こうした旋光能の波長依存性は、プリズムで光を七色に分ける(屈折率の波長依存性) 光の分散と同様の現象で、 旋光分散 optical rotatory dispersion(ORD)と呼ばれます。 光の分散は、一般に光の吸収をともない、 光を吸収する波長に近づくにつれ、大きく分散されるようになります。 糖類は基本無色で可視部に吸収を持ちませんが、通常のガラス同様、紫外部に光吸収を持ち、 可視部から低波長側に向かうにつれ旋光度が大きくなります。 なお比旋光度の濃度依存性は一般に小さく、ショ糖の場合、 濃度を 50 mass % にしても [α]D が 66.4° から 65.8° に変化する程度です。
化学物質の比旋光度には、通常、光路長 d = 10 cm、濃度 c = 1 g/cm3 が単位として採用され、比旋光度の単位をあからさまに書くと [° dm-1 g-1 cm3] = [° dag-1 cm2] になりますが (dagはデカグラム = 10 g)、 たいてい単に [°] と略されます。 なお結晶・固体ではケタ違いに旋光能が大きく、もっぱら光路長の単位に 1 mm が採用されるので注意が必要です (固体では濃度は問題にならず ° mm-1 が単位)。
旋光度の測定には、まず偏光子(ポーラライザー)が必要ですが、体当たりで(お安く)やってもらおうというので、 図 3a の簡易な偏光シートを使って行っています。 例によって、一件を出しておいて、各自好きなようにやってもらう方針で、 以前は高校時代に作った経験があったりで、図 3b のような、いろんな傑作(?)が登場しました。 またセロテープなど使って、複屈折などいろいろ試してもらうのも歓迎するところです。 残念ながら最近、そういう学生さんを見かけなくなりましたが・・・
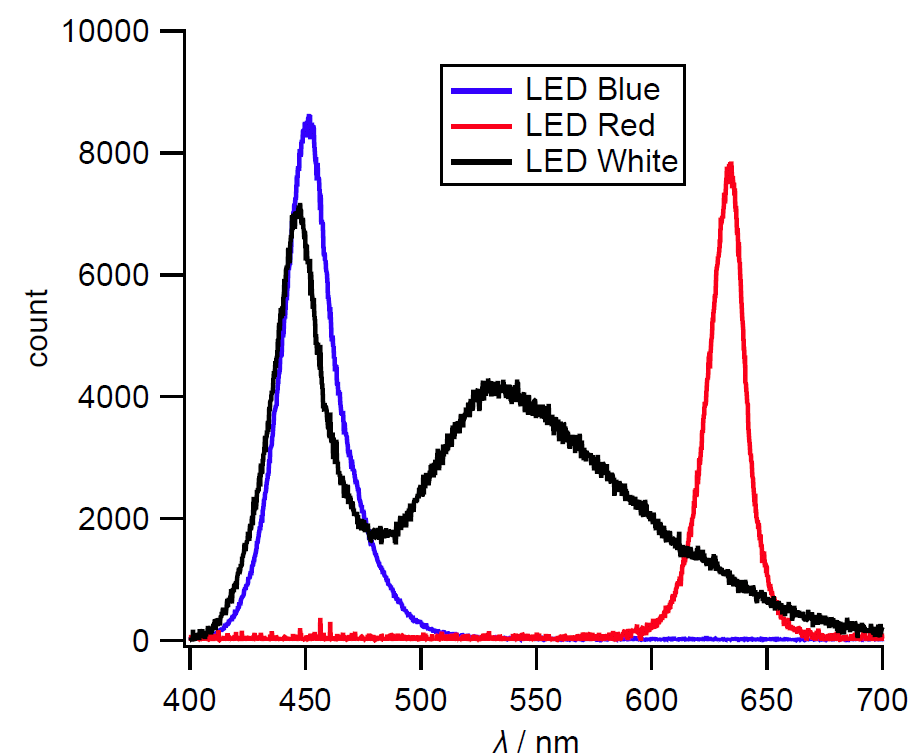
光源には単色光のものがよく、LED(発光ダイオード)が利用できます。 実験ではもっぱら USB キーライト(図 3c)を使ってもらっています。 キーライトはコンパクトで取り回しが簡単なので便利です。 発光スペクトルを図 3d に示しますが、赤は 630 nm ぐらい、青は 450 nm ぐらいに発光のピークがあります。 ショ糖の比旋光度 [α] は 630 nm で 58°、450 nm で 120° で、 2倍の違いがあり、はっきりちがいを見ることができます。 白色だとなぜうまく測れないのかを体感し、 赤と青で旋光度を測って、波長によるちがい(旋光分散)を考察するというココロです。 3回生の実験でも使っている LED の素子と USB 電源も用意してはいますが、 LED の話までしだすと、ちょっと重すぎるようです。 ともかく、ここでは旋光分散が存在し、 旋光度というのが、光源に向かって右回りを正(+)と約束していることを確認してもらえればよいでしょう。 なお以前は白色 LED が高価だったためか、もっぱら赤や青のキーライトが百円ショップを賑わせていたのですが、 最近は白色ばかりで、赤や青は見かけなくなりました。 日常使う分には白だけでいいのでしょうが、実験に使う分にはちょっと残念です。

|

|

|
|
| 図 3a.実験に使用する偏光シート。 この偏光シートを切り取って実験に使用する。 | 図 3b.偏光シートで作った工作例。 | 図 3c.光源に使用するキーライト(いささかピンボケ)。 今では白色以外、入手困難。 | 図 3d.キーライトの発光スペクトル(CHEMUSB 4 による)。 |
さて液体の旋光度の測定を行うには、液体を入れる筒と窓が必要になります。 なかなか適当なものに思い至らず、 いろいろ試行錯誤したのですが、 現在は平底の植物培養試験管(メリクロン培養などに使われる) を使用しています。 図 4a のような構成で、平底の試験管の底面に偏光子を貼りつけ、 底面側から光を照射。 偏光した光を、偏光子を貼りつけた覗き窓で上方から観察して、 振動面の変化を観察しようというわけです。
市販の培養試験管の規格品で内径 15 mm で 外径 18 mm、全長 120 mm というものがあり、 これが口径、長さともに適当です(リップのない直口型がよいです)。 培養試験管の底面の平面性は悪くなく、また複屈折の影響もないようで、 十分、測定用の窓として機能しています。 またペットボトルの口の内径が 20 mm で、 これを受けるようにペットボトルの蓋が作られているので、 その内のりの部分を利用すれば培養試験管の口にはまります (ぐらつくものも多いですが、うまくフィットしてくれるものを選びます)。 そこで図 4b のようにペットボトルの蓋に径 6 mm の穴を開けたものに偏光シートを貼りつけ、 覗き窓にしています。 問題は空気と触れる液面が半月状(メニスカス)になり、 散乱光の影響を強く受けることです。 当初 8 mm ぐらいのガラス管でテストしていた時は、 とても自由表面は使い物にならなかったのですが、 培養試験管の内径は 15 mm あって、 メニスカスの影響はかなり抑えられます。
光路長を 10 cm 確保したとして、溶液の必要量は 20 mL ぐらいで(断面積 1.8 cm2)、 何とか許容範囲です。 ショ糖溶液として 20 mass%(密度 1.08 g/cm3)のものを考えると、 赤のキーライトで比旋光度が 60° だとすると、旋光度は 13° ぐらいです。 旋光角は、図 4c のように試験管の周りに方眼紙を貼りつけて測定可能です。 イオン交換水を満たした状態で覗き窓を回しながら明るさを観察し、 一番暗くなったところで、覗き窓の外周に付けた印に合わせて方眼紙に基準線を引き、 試料溶液の場合にどうなるかを調べればよいのです。 試験管の外周は約 57 mm ですから、旋光角は 2 mm 程度に相当します。 微妙ですが旋光能の判定は可能で、 転化糖になった時に旋光の向きが逆になり「転化」したことも確認できます。 青のキーライトを使うと、判定はより明瞭です。 このあたりの測定については、学生諸君の創意工夫に期待したいところです。 これまでも(あまり成功しませんでしたが)図 4d のように光路の向きを逆にして、 鏡を使って2人組での観察を楽にする試みなどありました。 あるいは覗き窓を回して暗くなる位置の判定を容易にするために、 偏光子を2枚ずらして貼りこんで、視野の左右の明るさの違いで判定しようという、 市販の装置にあるような先端的(?)な工夫もありました。 残念ながら最近は見かけません・・・
なお白色光について調べてもらうと、 先の偏光分散という言葉通り、 覗き窓を回すとともに色の変化が見られます (灰色の状態から右に回していくにつれ、おおむね青 → 赤 → 黄 という変化。 RBG カラーセンサーを使った研究もあります)。 なぜこうした変化になるかも、考えてもらうと面白いでしょう。
この課題で取り組んでもらう図 4 のような ”手作り” の旋光計は原理的で、 ややもすればおろそかにされがちな「右」「左」の定義についても、 かつて視認に頼っていた化学の分野では、 なぜ光源に向かって「右」「左」になっているのかを体感してもらえる点で優れています (テレビやスマホなど通信関係など、 偏光ではなく「偏波」と呼ぶような分野では、電磁波の進行方向に沿って「右」「左」が語られます)。 けれどもいろんな試料について旋光度を調べるという段になると、 測定に手間暇かかる上に、 精度・感度が低く(せいぜい ±5°)多量の試料を必要とし(溶液量も多く濃度も高い)、 実用的とは言えません。
そこで 2017年度から、アタゴ社の RePo-5 屈折旋光計を導入して、 いろんな物質について、より手軽、迅速、精確に旋光度が測れるようにしました。 RePo-5 屈折旋光計は電池で稼働し、重さが 500 g 程度。波長が 589 nm(D 線)固定ですが、 必要な溶液量は 3 mL で(死容積を減らせば 1 mL ぐらいでも可。そうした付属品も売られていますが、スペーサーを自作した方が安上がり)、 測定範囲は ±5°、分解能は ±0.01° で精度は ±0.1° ということになっています (光路長は 2.0 cm。 1 mass% のショ糖溶液で、旋光度が 0.7° くらいに出る)。 また測定に要する時間が 12 秒というのは、大勢のお客さんをさばかないといけない学生実験としてはうれしいところです (3回生の光学分割の実験では大活躍)。 変旋光の測定などにも使えますが、図 5 ではビールを測っているところです。 測ってみると「糖分ゼロ」のビールの旋光度が 0 でなかったり(+0.20°。通常のビールは+0.76°。 成分表示を見ると「糖分」は 0 ですが、 「食物繊維」が通常のビールの「糖分」の 1/3 程度入っています)、 クスノキから取った天然ものと信じていたショウノウが光学不活性だったり (アルコール溶液で測定。パッケージをよく見ると「植物由来」と書いてあるだけで、 おそらくテレビン油由来のピネンからの合成品)、 蜂蜜のはずが旋光度が + だったり(水あめでごまかしている?)、 いろんな発見がありました。 こうした装置が 10 万円程度で入手できるというのは、 学生実験としては大変ありがたいところです (通常の試験研究用装置であれば、この 10 倍ぐらいの価格帯になってしまいます)。
ここでは直線偏光の立場から説明をしていますが、 円偏光による説明がしばしば行われます (円偏光のアイデア自体は、フレネル Frenel の時代 (1821) にさかのぼるようです)。 直線偏光による説明では、光の進行方向に対し、上下、左右の2成分を考えるわけですが、 円偏光による説明では、電場の振動に右回りと左回りの2成分を考えます。 右回りと左回りで、物質の屈折率(光の速度)が異なり、 光の振動の方向が、左右どちらかに偏ると考えるわけです。 直線偏光の立場では、円偏光は上下、左右の2成分の位相がちがう光として説明されることになりますが、 光学の基礎ができていない学生(及び無能な教員)に位相の問題を言い出すと厄介です。 直線偏光は直観的で、結晶の場合などには直線偏光の方が考えやすいですが、 液体のように等方的な媒質の場合には、 円偏光は有効なアプローチと言えるでしょう。
転化糖(invert(ed) sugar)は、「実験の背景」にもあるようにショ糖(スクロース)を加水分解して、 グルコース(ブドウ糖)とフルクトース(果糖)の混合物にしたものです。 蜂蜜はミツバチの持つ酵素(インベルターゼ。転化糖にするところからその名があります)で作られた転化糖とも言え、 また料理に使われる白砂糖は 1 % 程度の転化糖を含んでおり、 和の味わいを支えています。
白砂糖は日本独自のもののようです。 白砂糖は、糖蜜の溶液からショ糖を結晶化させ、 遠心分離機(分蜜機)で得た結晶に、転化糖溶液(ビスコ visco? と呼ばれます)を吹きかけ、乾燥させて作られています。 こうすることで、しんなりして固結しにくく、独特のまろやかさのある砂糖に仕上がるようです。 ただし転化糖の割合は 1/100 程度で、白砂糖をショ糖として使用しても今回の実験では大過ありません(グラニュー糖より安い)。 なお料理に使う白砂糖は普通「上白糖」ですが、「中白糖」というグレードもあるそうです。 またショ糖の結晶を分離してえられた糖蜜を、さらに濃縮してえられた砂糖が三温糖(何度も加熱して得た糖という意味らしい)になります。 ちなみにこの糖蜜を発酵させて得られるのがラム酒。 なお清涼飲料水やコーヒーシロップなどでよく使用される異性化糖(果糖ブドウ糖液糖などとも表示されている)は、 主にデンプンから作られるグルコースをグルコースイソメラーゼ(工業的に使用される酵素で JIS 規格もあります。JIS K7002)で異性化して製造されていて、 (成分は同じですが)転化糖とは別物です。
ショ糖(スクロース)はグルコース(α-グルコピラノース)とフルクトース(β-フルクトフラノース)が、 グリコシド結合した二糖類です。 これを加水分解すると、下式のようにグルコースとフルクトースになり、旋光度が正から負に反転(inversion)します。 なお二糖類の中でショ糖は非常に加水分解されやすく、 酸加水分解の速度定数は、室温付近で麦芽糖(マルトース)の千倍くらいあります。
この加水分解は酸触媒で進行し、 実験では 20 mass% のショ糖溶液に、塩酸を 0.05 mol/L 程度になるように加え、 湯浴中で 30 分加熱する設定にしています。 図 6 のように反応溶液をビーカーに入れ、ラップして、湯浴(電気鍋)で加熱している間に、 旋光度の装置を組立て、旋光度の測定をしてもらう段取りです (2015 年度に電気鍋を導入するまでは、 ホットプレートかバーナーで、直接ビーカーを加熱したり湯を沸かしたり大変でした)。 蒸発を抑えるように発泡スチロールのビーズ(クッションや枕の詰め物。径が大きめの 5 mm ぐらいものが使いやすい) を用意しています。 電気鍋のガラスの蓋をするには、ビーカーの背が少し高すぎます。 電気鍋の蓋を使うなら、50 mL ぐらいのポリカップを利用するのも手です。

|
| 図 7.20 mass% ショ糖溶液 20 mL に 1 mol/L 塩酸を、左から 0.5、1.0、2.0、3.0 mL 加えて、 30 分、湯浴中で加熱した結果。 塩酸濃度 0.05 mol/L 程度以上になると溶液が茶色くなります(カラメル化)。 |
塩酸濃度をどれぐらいにするかは難しいところです。 ショ糖の転化反応(加水分解反応)は、物理化学の学生実験の1次反応速度の課題によく取り上げられています。 物理化学の実験では、典型的には室温付近で、20 mass% のショ糖溶液と 1 mol/L の塩酸を等量混合し、 旋光度(あるいは体積)の時間変化を 1~ 2 時間測定するという形を取ります。 このことが頭にあったものですから、 90 °C ぐらいなら速度定数は数千倍ぐらいになるだろうから(活性化エネルギーを 100 kJ/mol 程度とする)、 塩酸濃度は 1/10 程度にしておけば反応は余裕で完結すると踏んで、 最初は塩酸を 0.1 mol/L ぐらいに設定していました。 けれども転化が完結するのはいいのですが、 今度は図 7 のように、塩酸濃度が高いとカラメル化が進行して溶液が褐色になり、 旋光度も測れないような事態が多発しました。 そこで現行では塩酸濃度を 0.05 mol/L 程度にしていますが、 もっと塩酸濃度を下げ、0.01 mol/L ぐらいでも大丈夫でしょう。 試してみたところでは、塩酸濃度 0.005 mol/L、30 分の湯浴中加熱で、転化はほぼ完全でした (20 分だと未転化のショ糖が 1 割程度残りました)。
最初はほとんど手探りで条件を決めていたのですが、 少し調べてみるとこの手の話は古くから研究されていて、 International Critical Tables 第2巻に種々のデータが掲載されています (速度定数が常用対数を用いた計算値で表記されていて、ln 10 = 2.303 倍しないといけないことに注意)。 pH が 2 程度ならよいわけですから、 シュウ酸の利用も検討してよいでしょう(料理では飴にするのに酢やクエン酸を使いますが、 転化は不完全で、またそれが料理には良いのでしょう)。 なお加水分解酵素のインベルターゼは、ちょっと奮発すれば容易に入手可能です。 実験ではデンプンの加水分解酵素(アミラーゼ(ヂアスターゼ))が用意してありますが、 旋光度や糖の定性試験に影響がでるかもしれませんが、 インベルターゼについても挑戦してみて良いでしょう。
|
|
|
| 鎖状のグルコース | α-グルコピラノース | β-グルコピラノース |
| 図 8.グルコースの鎖状体と主要な異性体。 常温、結晶状態では α-グルコピラノースが安定ですが、 溶液にすると一部 β-グルコピラノースに異性化します (α-体とβ-体の比は 1:2 ぐらい)。 鎖状体はほとんど存在しません。 | ||
|
|
|
| 鎖状のフルクトース | β-フルクトピラノース | β-フルクトフラノース |
| 図 9.フルクトースの鎖状体と主要な異性体。 結晶状態では β-フルクトピラノースが安定ですが、 溶液にすると β-フルクトフラノースなどの異性体が生まれます。 鎖状体はほとんど存在しません。 | ||
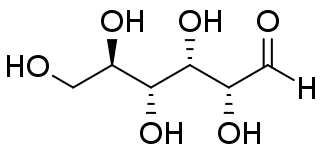
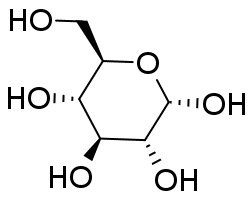
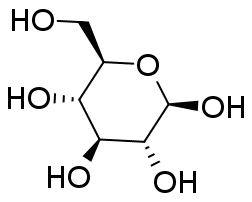
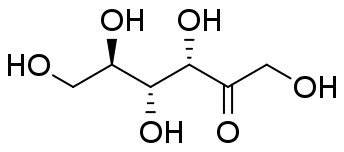
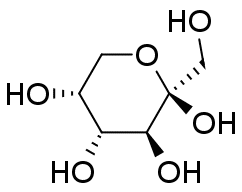
グルコースとフルクトースには種々の異性体があることが知られています。 水溶液中、グルコースについては表の α-ピラノース型と β-ピラノース型という2種のエピマー(アノマー)が主要なもので、 これ以外の異性体はほとんど見られません。 フルクトースについては β-ピラノース型と β-フラノース型が主だった異性体で、 量は少ないですが、α-フラノース型も存在することが知られています。 なお鎖状体は(糖の骨格を把握しやすいですが)ほとんど見られません。
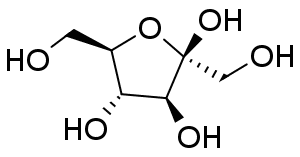
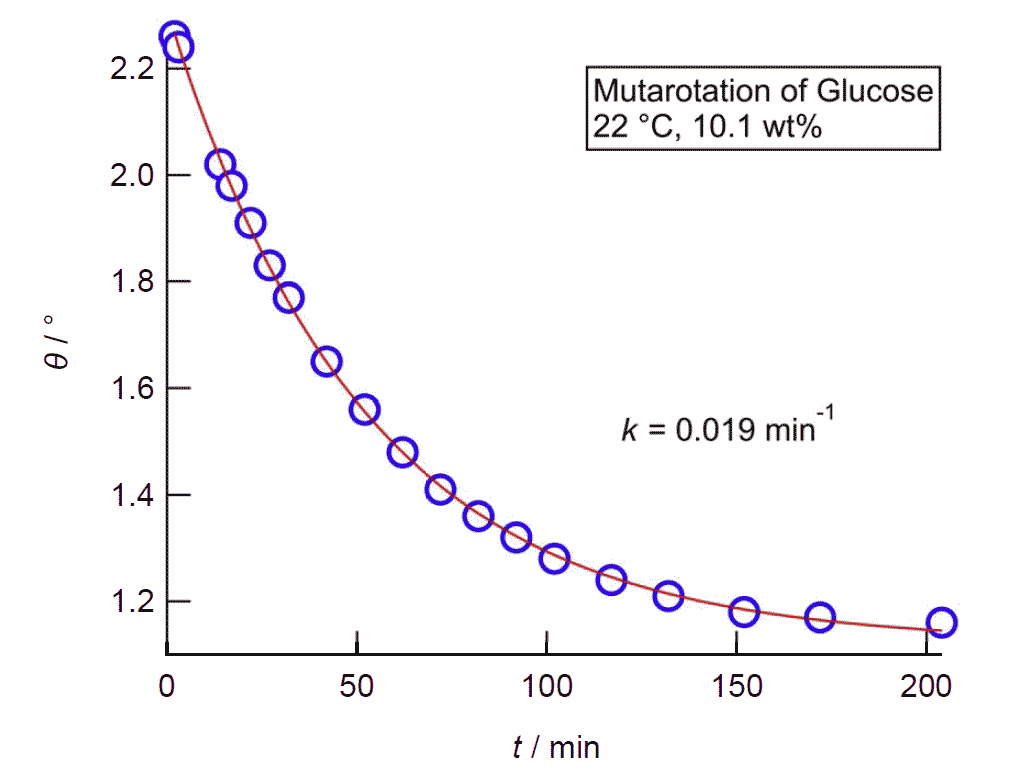
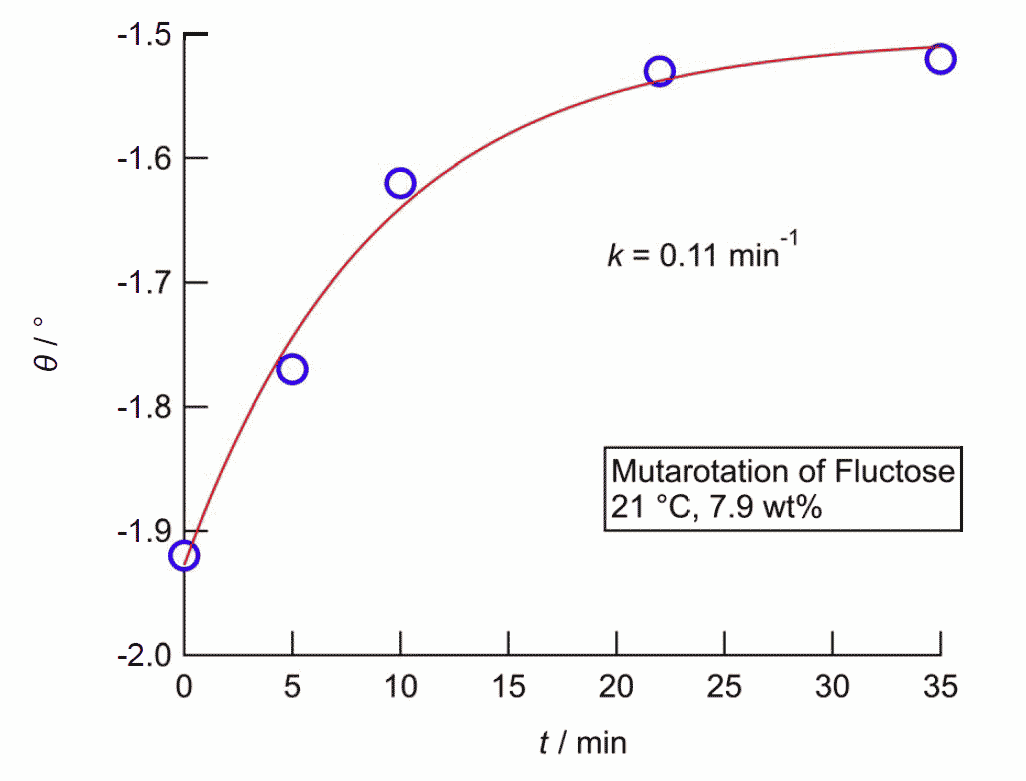
常温結晶中では、グルコースは α-ピラノース型、フルクトースは β-ピラノース型のものが安定です。 これが水に溶解すると異性体との共存状態へと移行し、グルコースやフルクトースの結晶を水に溶かして旋光度を測ると、 旋光度が時々刻々変化していく、変旋光といわれる現象が見られます (変旋光を狭く「アノマー間の異性化による旋光度変化」と定義している向きがありますが、 旋光度の変化にはフルクトースのように分子骨格の変化をともなう場合もあり、適切であるとは言い難いでしょう)。 図 10 に RePo-5 で測定した旋光度の時間変化の例を示します。 グルコースやフルクトースでは、ほぼ1つの緩和が観察されますが、 リボースやガラクトースなどでは多くの異性体が関与する、複雑な緩和が見られます。 グルコースなどの変旋光の速度は pH の影響を受け、 特に塩基性で速く進み、 薬局方ではフルクトースやグルコースの定量のための旋光度測定の際、 アンモニア水を添加するように規定されています。 なおグルコースに関わる物質代謝では α 型と β 型の反応性の差異が生じるわけですが、 この異性化を触媒する酵素(ムタロターゼ mutarotase)があります。
|
|
| 図 10a.室温におけるグルコース結晶溶解後の旋光度の時間変化(22 °C、10.1 mass%)。 RePo-5 屈折旋光計(光路長 2.0 cm)による。 | 図 10b.室温におけるフルクトース結晶溶解後の旋光度の時間変化(21 °C、7.9 mass%)。 RePo-5 屈折旋光計(光路長 2.0 cm)による。 |
|
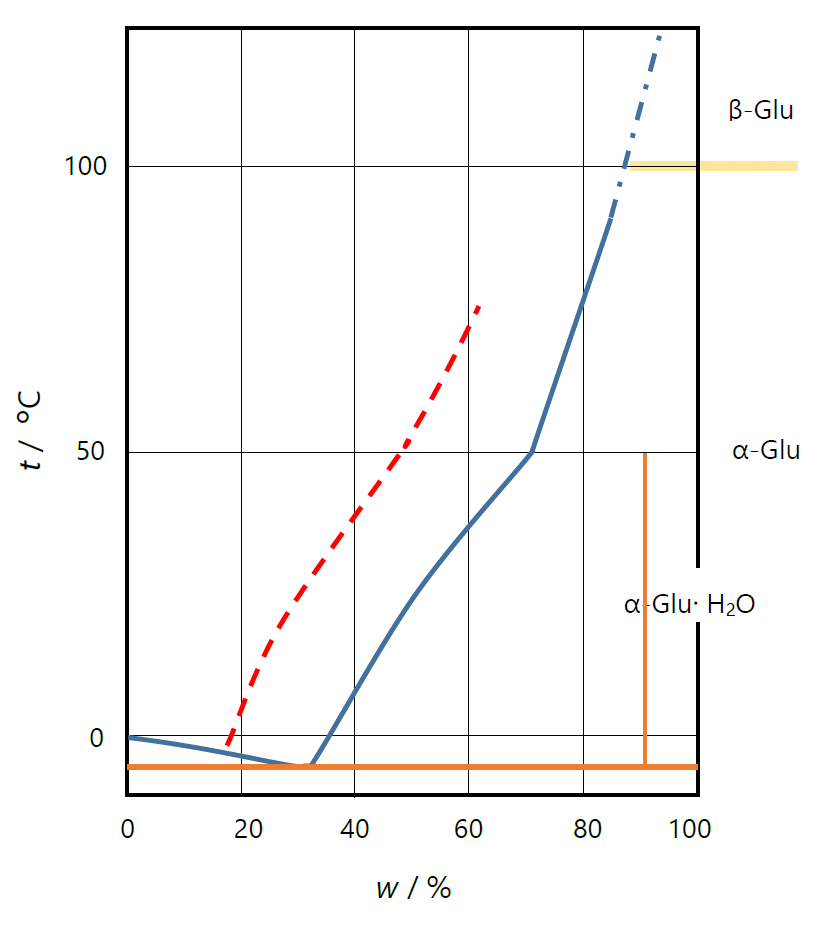
図 11.グルコースの溶解度曲線 (横軸 w はグルコースの質量百分率)。 50 °C 以下では一水塩、それ以上では無水物が安定です。 およそ 100 °C 以上では β-グルコースの結晶が安定になります。 図中の赤い破線は、溶液中に α-グルコースのみが溶解している場合の溶解度。 | ||
変旋光で見られる糖の異性化は、旋光能に止まらず、 さまざまな現象に影響をもたらします。 溶解度はその顕著な例です。
グルコースの溶解度は古くからよく調べられています。 水溶液と平衡にあるグルコースの結晶は 50 °C 以下では、一水塩 C6H12O6·H2O、 それ以上では無水物が安定で、いずれも α-グルコースからなります。 図 11 にグルコースの溶解度曲線を示しますが、 α-グルコースが溶解して、一部が β-グルコースに異性化するにつれ、溶解度は増していき、 25 °C では、当初は 30 mass% 溶けるのが、数時間おくと 50 mass% ぐらいまで溶けるようになります。 異性化(変旋光)の緩和時間は 25 °C では 40 分ぐらいですが、 10 °C では 3 時間以上になり、より大きな問題となってきます (逆に 60 °C ぐらいにすると数分で、さしたる問題にならない)。 ここでは溶解度を取り上げましたが、 味覚も変化します。 β-グルコースは、α-グルコースより3割ほど甘味が低く、 溶かして 1 時間ほどおいた溶液では、甘味が減ります。 同様にフルクトースは低温でフルクトピラノース型の比率が増して、 果物は冷やした方が甘く感じられるというのは有名です。
変旋光については19 世紀から20 世紀初頭にかけて活発に研究され、最初は倍旋光 birotation と呼ばれていました。 これは発見したデュブランフォー Dubrunfaut, A.-P. が、 ブドウ糖の結晶を溶かした溶液の旋光度がほぼ半分になることから名付けたそうです(時に 1846 年。図 10a 参照)。 その後、糖によっては半分にならないケースなどが次々見いだされ、 1899 年になって変旋光 mutarotation (← ラテン語 mutare (変化する))と呼ばれるようになったとのこと。 ちなみに変旋光についての大幸先生の研究がありますが、論文の表題は "Über die Birotation der d-Glukose"(d-グルコースの倍旋光について)になっています (Z. Phys. Chem. 35U, 664 (1900)。 東京化學會誌にも概要が掲載されています。 Z. Phys. Chem. の論文はいささか冗長、東京化學會誌は縦書き古風)。
食品、健康に関わって、糖の化学は古くから関心を集め、 多くの研究が積み重ねられてきました。 この課題では糖の化学的な定性試験法を取り上げます。 糖の化学的な定性試験には、大きく、高校まででも学ぶ糖の酸化還元に関わるものと、 糖が分解して生じるフルフラールなどに起因する呈色反応があります。 これ以外にも、フェニルヒドラジンとのオサゾンの生成など、 歴史的にも重要な反応がありますが、ここでは代表的なものに絞って用意しています。 無論、要望があれば(なぜか試薬の在庫に 2,4-ジニトロフェニルヒドラジンがあったりします) いろんな反応に挑戦してもらって構いません。
フェーリング溶液などの試液何 mL に、試料溶液をどれくらい加えればよいかは難しい問題です。 ここでは液量をできるだけ絞り、明瞭に結果が出るようにと、 内径が 10 mm の容量 5 mL 程度の小試験管を使い、 試液は 1 mL、 糖濃度 1 mass% ぐらいの溶液を数滴(~ 0.2 mL)加える設定にしています。 この設定はアントロン反応などでも同じにしているのですが、 加える糖溶液を控えめにした方が結果は鮮やかなようです (「数滴」は「1 ~ 2 滴」がよいかも)。
また濃厚な糖溶液を旋光計に詰めたりする作業などもある中で実験するので、 試料の汚染には要注意です。 この実験では、ディスポのスポイトを多めに提供し、 学生諸君にスポイトの使い回しなどをしないように注意します。 それでも陰性のはずが陽性に出ることがあります。 定性試験の実験に入る前に、全体として、 「清掃タイム」を設けたりするのもいいのかもしれません。
糖はフェーリング溶液と反応して酸化銅(I) Cu2O の沈殿を生成する還元糖と、 生成しない非還元糖に分類することができます。 ショ糖は典型的な非還元糖、 グルコースやフルクトースも典型的な還元糖になります。 ここではすでに高校までに学んでいる、 フェーリング反応と銀鏡反応を取り上げます。 なお近年、トレハロースも製菓用に安く入手できるようになったので、 挑戦してもらえるように用意はしてあるのですが、 非還元糖で変化が期待できないためか、誰からも相手にしてもらえないようです・・・
フェーリング反応や銀鏡反応では、湯浴中、加熱するのですが、 図 12 のように試験管立てごと、湯浴(電気鍋)に浸けておくのが手軽です。 そしてさらにお手軽に、銀鏡反応では温度をせいぜい 60 °C 程度にするのが普通ですが、 両反応で加熱温度を同一にして、フェーリング反応に合わせてあります。
還元糖の定性試験法は、特に血糖・尿糖の検査に関わって幅広く検討され、 テキストの解説にも挙げたベネディクト反応や バーフォード反応のように銅(II) の還元に注目するもの以外にも、 尿糖についてはニランダー(ニーランデル) Nylanders 法がよく知られています。 ニランダー法ではビスマス(III) が金属ビスマスに還元され黒くなることを利用します。 ニランダー試薬に使用される次硝酸ビスマス(塩基性硝酸ビスマス)は下痢止めの薬で、 昔わが家の薬棚にあり、個人的には懐かしい反応です。
フェーリング反応の結果は、教科書で習う通り、 ショ糖とデンプンは陰性で、 転化糖とグルコースは陽性となります。 陽性の場合、青紫色のフェーリング溶液に赤い酸化銅(I) の沈殿ができます。 糖の量が少ないと見落とすこともあるので注意します。 一方加える量が多すぎると、図 14 のようにフェーリング溶液の色も変わってしまうので、 あまり美しくありません。
フェーリング反応が、 アルデヒド基 -CHO をカルボキシ基 -COOH に酸化する反応だとされていることがありますが、 還元糖のフェーリング反応は単純ではなく、その量論も条件により変動します。 実際に試してもらってよいのですが、 糖の種類による反応性を比較すると、アルデヒド基をもたないフルクトースの方がグルコースより速やかに反応し、 グルコースのエピマーであるマンノースの反応はグルコースよりずいぶん遅くなります。 反応はグルコソン(グルコースのオサゾンを加水分解したもの)を経て起き、 C-C 結合の開裂をともなうような反応も起きて、さまざまな種類のカルボン酸が生じるようです。 単純にアセトアルデヒドのフェーリング反応と、 グルコースなどのフェーリング反応を同一視することはできません。
フェーリング反応の量論についていうと、大まかに言って、1 mol のグルコースは、 5.6 mol の 2 価の銅 Cu2+ と反応して、 2.8 mol 酸化銅(I) Cu2O が生じるようです。 クイズにもありますが、 アルデヒドがカルボン酸になるだけであれば、 1 mol のグルコースと 2 mol の Cu2+ で反応は終結するはずですが、 3 倍近い Cu2+ が反応するわけです。 この5.6 mol というのは条件によって(数 % ではありますが)変化します。 糖の定量に利用する分には、反応条件による量論比の変動を決める必要があり、 よく使われる(た)ベルトラン Bertrand 法 (1906) では、 試料溶液(含まれる糖が 100 mg 以下)、フェーリング A 液、フェーリング B 液をそれぞれ 20 mL ずつ取って混合し、 3 分間煮沸するといった手順をマニュアル化し、 糖量と生成する酸化銅(I) 中の銅量の対応表(使用する糖によって値が異なります)を用いて、 糖の定量を行います。
なおこの実験のスケールでは、 フェーリング溶液中の銅(II) は、およそ 0.14 mmol 存在し、 これと 2 mg 程度の糖(1 mass% の溶液が、数滴、0.1 ~ 0.2 mL 程度)が反応する設定になっています。 糖の分子量を 180 とすると、およそ糖は 0.01 mmol で、 上記の量論を考慮すると、銅(II) はおよそ 2.5 倍入っていることになります。 ですから「数滴」が十滴近くになったり、 試料濃度が 2 mass% 近くになったりすると、 図 13 のようにフェーリング溶液の青色は消えてしまいます。 この時、何ができているかは興味深いところですが、 還元糖の確認という観点からは推奨できません。
フェーリング溶液は、ざっくり言えば銅(II) の酒石酸錯体のアルカリ性溶液ということになりますが、 その具体的な処方については、 薬局方などには詳しい規定があり、 硫酸銅5水塩 34.66 g を水に溶かして 500 mL にした A 液と 酒石酸ナトリウムカリウム(ロッシュル塩)173 g と水酸化ナトリウム 50 g を水に溶かして 500 mLにした B 液を混合することになっています。 今回の実験でもこれに倣って調製していますが、なぜこうした 34.66 といった切りのよくない数字の出てくる処方になっているかは不明です。 フェーリングの原報 (1849)を見ると、 硫酸銅の濃度はこの半分くらいですし、全体にもっとアバウトです (ちなみにフェーリングは、 転化糖と生成する酸化銅(I) の量論比として、1 : 2.6 程度の値を出しています。 なおフェーリングの論文では今日と原子量がちがっていて、 糖の分子式が C12H12O12 になっていたりします)。 また先のベルトラン法で使用されるフェーリング溶液は、 局方のものと異なっています。 多分、どこかの時点で公定法が定められ、 今さら変えられない状況になっているんでしょうね。
銀鏡反応はフェーリング反応とともに、 還元糖の検出反応として高校までで習う反応の双璧です。 けれどもその実験条件は単純ではありません。 教科書的には、還元糖は銀イオンを還元して金属銀を生じ、 ショ糖のような非還元糖は反応しないということになるのですが、 試薬の調製法、反応条件などによって、 結果は変化します。 特にトレンス Tollens 試薬と硝酸銀・アンモニア試薬のちがいは重要です。 さらに金属銀が「鏡」になるかどうか(化学メッキ)という要素も加わって、 いよいよ厄介です。 こうした事情に、ぼくはほとんど無知で、 当初、大変混乱しました。
混同して語られることが多いのですが、 「トレンス試薬」と「硝酸銀・アンモニア試薬」は異なります。 トレンス試薬は、硝酸銀・アンモニア試薬(硝酸銀溶液にアンモニア水を溶液が透明になるまで加えて調製) に、水酸化ナトリウム溶液を加えたものになっていて、 より塩基性の強い条件での銀(I) の還元反応を見ることになります。
入門化学実験の初期にはトレンス試薬を用い、 フェーリング反応と同条件で加熱する設定にしていました。 するとグルコースや転化糖で銀鏡(あるいは銀の沈殿)ができるのは当然ですが、 予期に反し、ショ糖でも銀鏡が生成する、 それも一番きれいにできるのです。 そこで 2016 年度からトレンス試薬を硝酸銀・アンモニア試薬に変えて、 図 14a に見るように (ショ糖については黒ずみはしますが)、高校時代に学んだ通りの結果を得られるようになりました。
有機化学実験の中では、銀鏡反応はトレンス反応 Tollens' test と呼ばれ、 アルデヒドの定性試験とされていて、トレンス試薬が使用されています。 この話を(以前のぼくのように)そのまま、還元糖の定性試験に持ち込むと、 先にも述べたように大きな混乱を引き起こします。 銀鏡反応の反応機構は一筋縄ではいきません。 たとえば図 14b、図 14c に見るように、 グルコースよりも転化糖、フルクトースの方が反応性が高いのです (先にも触れましたが、同様の傾向はフェーリング反応でも見られます)。
フルクトースが異性化してアルデヒドになり、 フェーリング反応や銀鏡反応を示すといった説明を目にすることがありますが、 異性化がスムーズに進行するなら、グルコースやフルクトースはすぐに異性化して、 グルコースとフルクトースがほぼ等量の平衡混合物になってしまうでしょう (データブックの生成自由エネルギーを参照すると、 平衡でのグルコースとフルクトースの存在比は 6:5 ぐらいです)。 あるいは高校の教科書や参考書などでは、 ギ酸が銀鏡反応を示す理由についてアルデヒド基(ホルミル基)と関係づけてとくとくと説くものの、 酒石酸がなぜ銀鏡反応を示すかについては(酒石酸は硝酸銀・アンモニア試薬でも銀鏡反応を示します)口をつぐんでいます。 銀鏡反応は実用的にも重要で、すでに反応機構などの解明が進んでいるでしょうが、 ぼくはまだ腑に落ちる解にたどり着けていません。 ご存じの方あればご教示いただければ幸いです。 とりあえず銀鏡反応・トレンス反応は、 必ずしもアルデヒドに特異的な反応ではないと心得ておくのがよいようです。
トレンスの原論文を見てみると、 そもそもが還元糖ではなく、アルデヒド一般の定性試験としてトレンス試薬は設計されたようです。 そしてアルデヒドの定性試験を妨害する物質の例として、 何とショ糖が加熱時に銀鏡反応を示すことが記されています。 百年以上前、元祖トレンス自身が、非還元糖であるショ糖が銀鏡反応を示すことを指摘しているのに、 ぼくは大変驚きました。 そこでチェックし直してみると、硝酸銀・アンモニア試薬では、 ショ糖は銀鏡反応を示さない(黒ずみはしますが)ことを確認。 2016 年度からは、トレンス試薬ではなく硝酸銀・アンモニア試薬を使用するようにテキストを変更して、 非還元糖では銀鏡反応は起きないという結果を得るようになっています。 ちなみにオリジナルの処方は、 硝酸銀・アンモニア試薬に、水酸化ナトリウム溶液を加えていて、 高 pH で還元を行わせる意図が明瞭です。 現在行われる、水酸化ナトリウムで中和してからアンモニアを加えるという処方は、 アンモニアの量を少なくして雷銀の生成リスクを下げる上で有効でしょうが、 トレンス試薬と硝酸銀・アンモニア試薬の違いを見えにくくしているようです。
銀鏡反応は、還元糖の定性試験という観点からは、 銀(I) が還元され金属銀が生成するまでが関心のあるところですが、 実用的あるいは見てワクワクする分には、 析出した金属銀が鏡面を形成するというプロセスに関心が向きます。 銀鏡反応は電気分解を利用しないメッキ、いわゆる化学メッキの典型で、 古来、鏡作りに用いられてきました。 また前述のように、単純に還元糖の定性試験というには留保が付くにも関わらず、 高校レベルの化学の教材に生き残っているのは、 それが持つ初学者へのインパクトの大きさを物語っているでしょう。
この鏡面ですが、ガラスが平坦な面になっていて、 ガラスに銀が析出、密着することで鏡面が形成されます。 還元剤の濃度が高かったりすると、鏡ができずに金属銀の沈殿(銀泥)ができる場合もありますが、 温度を下げたり濃度を下げたりして、ゆっくり金属銀が析出するようにすると、 鏡の生成が優先されるようです。 金属銀が絶縁体のガラスに好んで付着するというのは、 いささか不思議な話です。 またガラスではなく、図 15a のようにペットボトルに銀鏡ができることもあります。
鏡ができることを説明するポイントは、 たぶん銀ではなく、還元剤の方に注目することでしょう。 ガラスの表面に還元剤が吸着し、 金属銀の生成がガラスの表面付近で始まる。 そして一度金属銀ができると、局所電池が機能して銀の析出が急速に進み、 ガラス表面が金属銀で覆われるというシナリオがもっともらしいように思われます。 きれいな銀鏡を作るために、あらかじめ塩化スズ(II) の溶液でガラス面をリンスしておく手法がよく知られていますが、 糖類などよりスズ(II) Sn2+ の方が、 ガラス面に吸着されやすいでしょうから理にかなっています。 けれどもガラス表面でどのように金属銀が成長しガラスに密着するのかは、 物質の拡散をともなう複雑なプロセスで、 きれいな鏡を作る種々の「秘伝」が伝えられているというのも、 むべなるかなというところです。
なお通常、試験管の外から観察するので見えませんが、 内部の液と接する側の面は、粉を吹いたような状態になり、鏡面になりません(図 15b)。 低温にしてゆっくり成長させると鏡面になるという話を聞いたことがありますが、 ぼくは成功したことがありません。 なにかうまいやり方があれば面白いと思うのですが・・・
高校では習わない糖の定性試験に、 フェノール類と硫酸や塩酸を反応させる、 種々の呈色反応があります。 ヘキソースの場合、強酸とともに加熱すると、 下式のような分解経路が想定され、 フルフラール誘導体がフェノールと縮合して、 さまざまな色調の色素ができるようです。 この反応式にでてくるヒドロキシメチルフルフラールやレブリン酸は、 工業的にデンプンなどヘキソースからなる原料から製造されています。 同様にリボースなどペントースの場合には、フルフラールが生じて同様の発色が見られます。 この反応は高濃度の硫酸、塩酸を取り扱うことになるので、 安全に要注意です(メガネ着用確認!)。
レブリン酸 C5H8O3 は古く 1840 年に糖の酸分解生成物として得られたようです。 近年、バイオマス由来の有機原料として注目されています。
フェノール類としては、フェノール PhOH は無論、 今回の実験で取り上げる α-ナフトール、アントロン、レソルシノール(旧世代はレゾルシン(ドイツ語 Resorcin)と呼びます)、 さらにはオルシノール(5-メチルレソルシノール)やクレゾールなども用いられたりします。 アントロンはフェノール類と少し外れるようにも見えるかもしれませんが、 図 17 のように、9-アントラノールと互変異性の関係にあります。 それぞれのフェノール類で、さまざまな色合いの呈色反応が見られるのですが、 その色合い・安定性などから、 最近はアントロン反応がよく採用されているようです。
アントロン反応でまず注意したいのは、 アントロン試薬のアントロン濃度は万分の 1 のオーダーで、 ほとんど濃硫酸だということです。 ですからアントロン試薬に試料溶液を滴下するというのは、 中学高校でやってはいけないと教わる、濃硫酸に水を加える行為なのです。 そしてこの「やってはいけない」操作の結果生じる大きな発熱が、 アントロン反応をスムーズに進めてくれることになります。 ここは実際に試験管に指を触れて確認して欲しいところですが、 変色に気を取られて、そこまで気が回らないことが多いようです。 同様に廃液処理の際も要注意です。 十分希釈してから、廃液容器に捨てるようにします (以前、希釈せずに捨てたグループがあり、廃液容器に使っているペットボトルに穴が開いたことがあります)。
アントロン反応は鋭敏で、 少量の糖でも十分、緑の呈色が確認できます。 加える糖の量をフェーリング反応などと合わせて、 「数滴」にしてあるためか呈色が濃すぎて、きれいな緑色にはなってくれません(図 18a-b)。 加える試料溶液の量の指定には、もっと気遣いが必要なようです。 あるいは色が濃すぎた場合のために、希釈操作を入れておくのもよいのかもしれません。
個人的にはアントロン反応の緑より、 モーリッシュ反応のノーブルな紫が好みです(図 18c)。 伝統的(?)にモーリッシュ反応については、 テキストにあるように、濃硫酸を流下させ、 界面付近での呈色を見ることになっています。 この「流下」が結構曲者で、 細い試験管を使うとうまく2層になってくれないことがあり、 太めの試験管を使ってもらうのがよいでしょう。 この硫酸を流下させて界面付近の呈色を見るというのは、 昔は硝酸イオンの定性分析(褐輪反応。硫酸鉄(II) を加えて呈色を見ます)でおなじみでした。 けれども今ではそういった話題を振ると、 学生さんから老人をあれむような目で見られる時代になってしまいました・・・

|

|

|
| 図 18a.アントロン反応。アントロン試薬に試料溶液を滴下したところ。 左からショ糖、転化糖、グルコース、デンプン。 発熱注意。 | 図 18b.アントロン反応。図 18a から振り混ぜた後の様子。 デンプン以外は試料が多すぎ。 | 図 18c.モーリッシュ反応。 左はイオン交換水、右はショ糖溶液にモーリッシュ試薬を加え、 硫酸を流下。 |
糖の強酸による分解には、糖の種類によって反応性に大きな差があり、 一般にアルドースよりケトース、 ヘキソースよりペントースの方が反応性が高く、 この反応性の差を利用した、ケトースやペントースの定性試験が行われます。 この実験で取り上げるセリワノフ反応は、 そうしたケトースの定性試験の代表的なものです。 このセリワノフ反応ですが、 ここではショ糖と転化糖の呈色の差を見る形にしています。 転化糖ではすぐに呈色が始まり、 ショ糖は一度加水分解されて転化糖になって反応するので、 遅れて呈色が見られるというシナリオです(図 19a)。 けれども、ケトースの定性試験であるなら、 転化糖とグルコースの比較を行うべきでしょう。
このあたり、実は入門化学実験発足当初、 糖類の呈色反応は省かれていて、 2012 年度からアントロン反応などの課題を追加していったという経緯があります (セリワノフ反応は 2013 年度から)。 セリワノフ反応を導入した時、図 19b-c のように、3 種類の試料についてセリワノフ反応を行い、 グルコースについて陰性になることを確認することを考えていたのですが、 あまりにも定性試験の分量が多くなるので、陰性の試験という、 もう一つパッとしない実験を省いたのです。 しかしやはり、セリワノフ反応はケトースの定性試験であるというのを重く見て、 グルコースの試験を入れた方がよいのかもしれません。 なおセリワノフ反応のような場合には、 図 19d のように上から覗き込むのが、 呈色を判定する上で有効です。 こうした判定法は、薬学方面などではネスラー管(比色管)といった形で規格化されています。
アントロン試薬の調製法にはいろいろ流儀がありますが、 ここでは局方の処方に従っています(「アントロン 35 mg を硫酸に溶かして 100 mL にする」ので、 質量分率では 0.02 %)。 またモーリッシュ試薬もいろんな流儀があるようですが、 ここでは局方の記載(トレハロースの確認試験。メタノールにしたのはぼくの趣味)を参考に決めています。