リン酸は脱水縮合を行って、種々のポリ酸を生成します。 こうしたリンの縮合酸について、化学の講義では生物化学で ATP(アデノシン三リン酸)などに関わって教わるものの、 リン酸の縮合酸自体については、水処理や洗剤、食品添加物など身近に登場する物質であるにもかかわらず、 意外になおざりな扱いに止まっています。 ここでは縮合酸について、その特徴を金属イオンとのキレート生成と、 ヘテロポリ酸の生成とリンの検出への応用という点から扱います。
リン酸 H3PO4 の縮合酸には、さまざまなものが知られていますが、 ピロリン酸(二リン酸) H4P2O7 は最も基本的なものといえるでしょう。 ピロリン酸 pyrophosphoric acid は、焦性リン酸とも呼ばれ、 昔 (1828)、リン酸ナトリウムを赤熱して得られたところから、この名があるようです。 ここで行うリン酸水素二ナトリウム Na2HPO4 の脱水縮合の場合、 室温から加熱していくと、およそ 200 °C から脱水縮合が起き、 ピロリン酸ナトリウム Na4P2O7 が生成してきます。 リン酸水素二ナトリウム Na2HPO4 は pH 7 の緩衝液の調製に使用している無水塩を流用しています。 実験では 4 mL 程度のガラスのサンプル管(マルエムの No. 1)にリン酸水素二ナトリウムを 0.3 g ぐらい入れ、 ホットプレート上で加熱脱水を行ってもらいます (完全に加熱脱水が進めば、サンプル管に腹8分目の水に溶かせば、ほぼ 0.4 mol/L のピロリン酸ナトリウム溶液になります)。
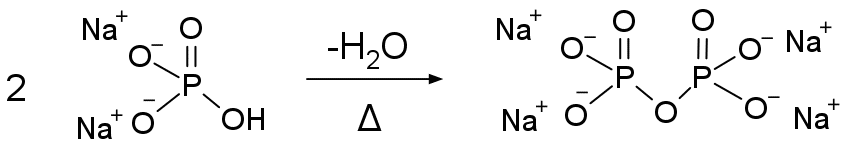
完全に脱水縮合が進行するにはかなり長時間を要し、 500 °C ぐらいで数時間加熱する必要があるようです。 ここでは収率は度外視して、銅(II) とのキレート生成の有無だけを問題にしているので、 300 °C 付近で数分の加熱でよいことにしています。 加熱に当たっては、図 1a のようにアルミの板(厚さ 12 mm。”保温板”)に開けた穴に、 サンプル管を入れてもらいます。 加熱するにつれ水が揮発し、サンプル管上部に少し水滴が付くのが分かるでしょう。 単にホットプレートの上に置いただけでは、今回の場合のように 300 °C くらいになると放熱の効果が大きく、 サンプル管内の温度は設定温度より 50 °C ぐらい低くなってしまいます。 このため図 1b のように、加熱脱水が不十分になり、ピロリン酸銅(II)(あるいはリン酸銅(II))の沈殿が溶解せずに、 残ってしまう結果となります(温度は熱電対でモニターしました)。
ちなみにリン酸 H3PO4 は結晶として得られますが(融点 42.4 °C)、 融解して液体となると縮合酸の生成が起き、 平衡状態ではピロリン酸と水を 約 6 mol% 含むものとなります。 この平衡状態への移行は数週間かかるような緩慢なもので、安定にリン酸の融点が測れるようです。 こうした縮合が起きるので、市販試薬のリン酸は通常 85 mass% 程度の濃度に調製されています(JIS K9005)。
縮合リン酸をリン酸と比べた時の際立った特徴は、 金属イオンとキレートを作ることでしょう。 特にマグネシウムやカルシウムとキレートを作るのは、 硬水を軟化したりする上で重要で、 水処理や食品、洗剤等の分野では金属封鎖剤 sequestrant と呼ばれます。 ここではピロリン酸銅メッキに想を得て、 硫酸銅を利用した、ピロリン酸生成の確認をしてもらうことにしています。 銅(II) のリン酸塩もピロリン酸塩も不溶性ですが、 過剰のピロリン酸ナトリウムを加えると、キレートを作って溶解するようになります。 銅塩の沈殿を溶解させるには、結構ピロリン酸濃度を高める必要があるようで、 加熱脱水が不十分だと溶け残りが出たりします(図 1b)。 実際、工業的に使用される銅のピロリン酸メッキ浴では、ピロリン酸濃度は 1 mol/L 程度(銅の濃度はこの 1/8 程度)で、 今回の実験(図 1)の数倍になっているようです (溶解度積 [Cu2+]2[P2O74-] からはピロリン酸銅(II) はピロリン酸濃度の平方根、 銅(II)-ピロリン酸では 1:2 のキレート [Cu(P2O7)2]6- が安定なようで、 ピロリン酸濃度の 2 乗に比例して安定化する勘定になります)。
|
図 2. モリブドリン酸イオン PMo12O403- の構造 (Rb3[PMo12O40] の結晶中のモリブドリン酸)。 図中、赤色は酸素 O、黄色はリン P、赤紫はモリブデン Mo です。 中心にある PO4 の正四面体方向に伸びる O 原子に、 MoO6 の正八面体ユニットがそれぞれ 3 個ずつ結合する形になっています。 |
リン酸は自身もピロリン酸など種々の縮合酸を作りますが 他の元素の酸素酸とも種々の縮合酸を作り(ヘテロポリ酸と呼ばれます)、 ここではモリブデン酸との縮合酸であるモリブドリン酸(リンモリブデン酸とも)を取り上げます。 モリブドリン酸としてはリン P とモリブデン Mo の組成比が 1:12 の H3[PMo12O40] が安定でよく知られており、 図 2 に示すような、 酸化モリブデン(VI) MoO3 の作る籠(かご)の中にリン酸イオン PO43- が包み込まれた構造を取ります。 このような 1:12 の組成比のヘテロポリ酸として、 リン酸ではなくケイ酸 H4SiO4 を籠の中に取り込んだモリブドケイ酸 H4[SiMo12O40] や、 モリブデンと同族のタングステン W の作るタングストリン酸 H3[PW12O40] などが知られており、 こうしたヘテロポリ酸を研究した J. F. Keggin にちなんで、 図 2 のようなヘテロポリ酸の構造はケギン Keggin 構造と呼ばれます。 これ以外にもリンとモリブデンが 2:18 のモリブドリン酸 H6[P2Mo18O62] (2個のケギン構造が縮合した ドーソン Dawson 構造)など、さまざまなヘテロポリ酸が知られています。

|

|
| 図 3a. リン酸水素二ナトリウム溶液にモリブデン酸アンモニウム溶液と硫酸を加えると、 モリブドリン酸 H3[PMo12O40] が生成して黄色くなります。 | 図 3b. しばらく加熱していると、モリブドリン酸アンモニウム (NH4)3[PMo12O40] の沈殿が生成してきます。 |
モリブドリン酸 H3[PMo12O40] は、 酸性条件でモリブデン酸とリン酸を混合して加熱するだけで容易に生成します(図 3a)。 カリウム塩やアンモニウム塩はたいてい水によく溶けますが、 大きく嵩張るアニオンとの塩には溶けにくいもの、ほとんど溶けないものが見受けられます (ヘキサニトロコバルト(III)酸 H3[Co(NO2)6] の塩など)。 モリブドリン酸のアンモニウム塩もその例で、 実験ではモリブデン酸のアンモニウム塩を使用しているので、 黄色いモリブドリン酸が生成した後、 加熱を続けると不溶性のモリブドリン酸アンモニウム (NH4)3[PMo12O40] の沈殿ができてきます(図 3b)。 モリブドリン酸アンモニウムは、リン酸の分離・定量に古くから利用されています。 石橋先生にも、詳細にわたるモリブドリン酸アンモニウムを利用する、リン酸の定量に関する研究があります。 30 年以上前になりますが、 3回生の学生実験の分析化学のセクションの改変に取り組んだ折、 これを参考に酸塩基滴定によるリン酸の定量の課題に挑戦したことがありました (学生諸君は奮闘してくれたのですが、結果は散々・・・)。

|

|
| 図 4a. モリブドリン酸溶液にアスコルビン酸溶液を滴下し、少し加熱すると青黒くなります(左)。 そこに 1-ブタノールを加えて振り混ぜると、 青黒い成分はブタノール層に移行します(右)。 | 図 4b. 醤油にリン酸が含まれているかどうかを調べます。 希釈が不十分で、リン酸濃度が高すぎたようです。 |
モリブドリン酸の特徴的な性質に、 容易に還元されて、モリブデンブルー(モリブデン青)と称される青色物質を生成することが挙げられます。 モリブデンブルーは強く光を吸収し、 わずかな量でも明瞭に検出することができます (モリブドリン酸の黄色でも検出はできますが、10 倍以上感度は劣るようです)。 そこでリン酸をモリブドリン酸にして還元、モリブデンブルーの形で検出・定量する手法が、 水中のリン酸の分析に広く使用されています (JIS でも定番の手法として JIS K0101「工業用水試験方法」などに採用されています)。 またモリブデンブルー(モリブドリン酸も)はアルコールなど極性の有機溶媒によく溶け、 MIBK(メチルイソブチルケトン)やブタノールなどで抽出して、 検出感度を高めることも行われます。
実験では実際にモリブデンブルーが生成することを確認するとともに、 適宜、各自が持ってきたサンプルについて、リン酸の有無を確認してもらうようにしています。 食品や清涼飲料水にはたいていリン酸が含まれています。 以前は醤油やソースを調べてみたり(図 4b)、コーラを比較したり、 植物の活力剤を調べてみたり、 飲み会のつまみのタコワサを持ってきたりと賑やかだったのですが・・・
このように還元されて青色の物質になるというのは、 5 価と 6 価のモリブデンが共存し、分子内で電子が非局在化することによるものと考えられます (混合原子価状態)。 こうした現象はモリブデンと同族のタングステンのヘテロポリ酸でも見られます (タングステンブルー。同様の現象は固体でも古くから知られていて、 タングステン青銅と呼ばれます)。 同様の青(藍)色が溶媒和電子でも見られるのは、おもしろいところです。
字義どおりに考えれば、より身近で普通に見られるヘテロポリ酸は、 土壌を構成するケイ酸 H4SiO4 とアルミン酸 H3AlO3 の縮合酸でしょう。 カオリナイト Al2Si2O5(OH)4 などは層状構造を持ち、 保水性があって、土壌の重要な構成成分になっています。 あるいはゼオライトは、鉱物(沸石)として広く産出するとともに、洗剤の添加剤(助剤、ビルダー)として身近なもので、 工業的には種々の触媒等に用いられています。 けれども一般に共有結合性結晶として存在し、また何よりあまりに身近で重要なものなので、 アルミノケイ酸塩といった独立の扱いをされることが多く、 改めてヘテロポリ酸と呼ばれることはまずありません。
|
|
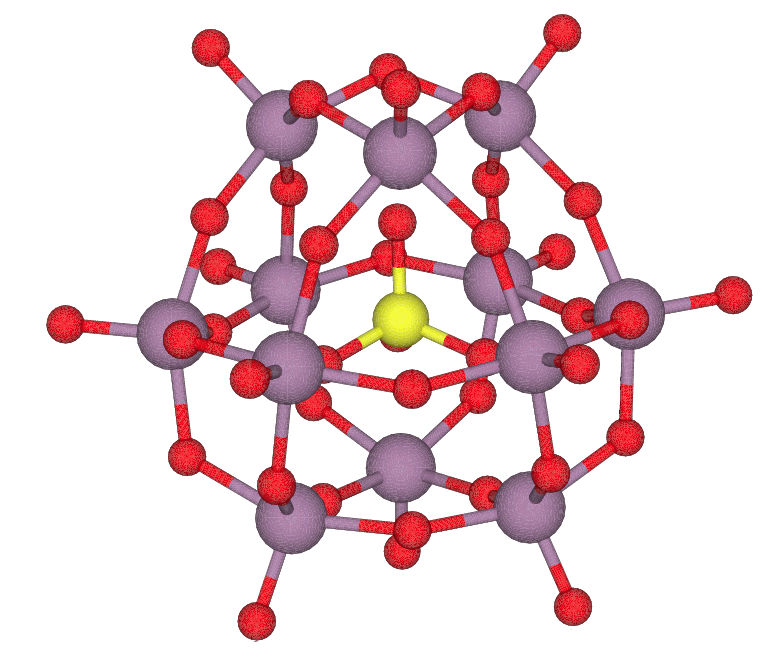
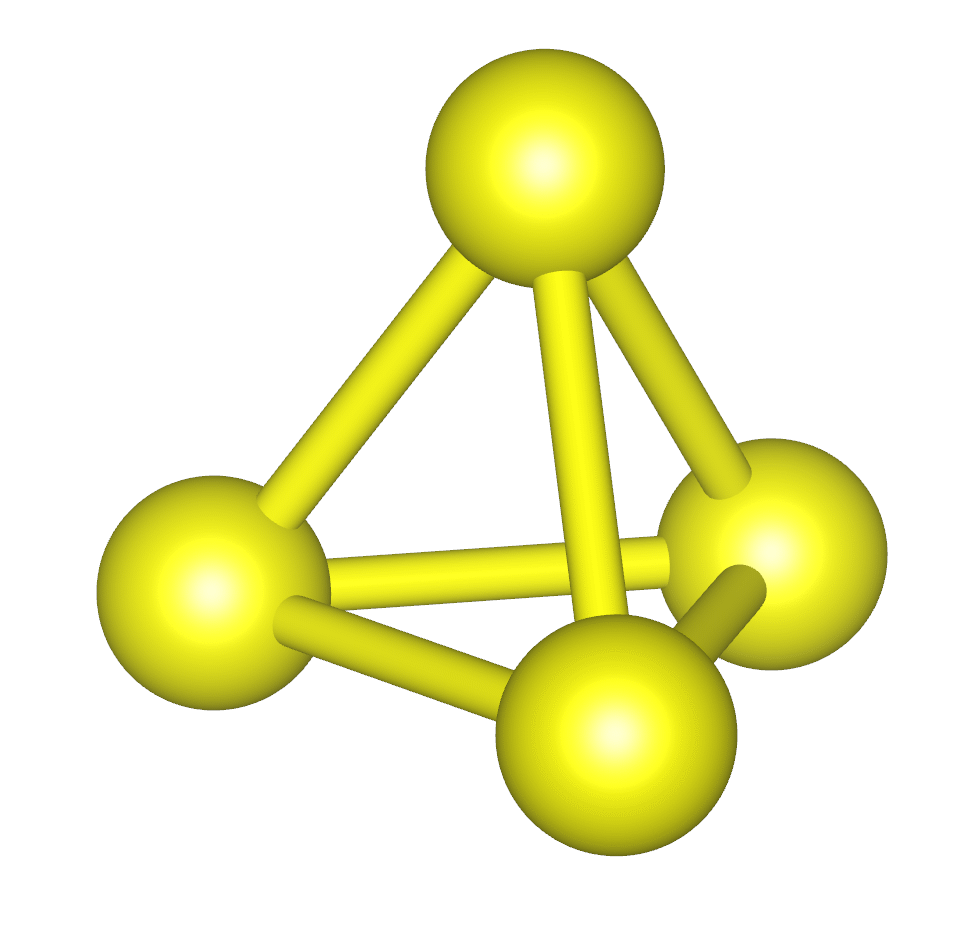
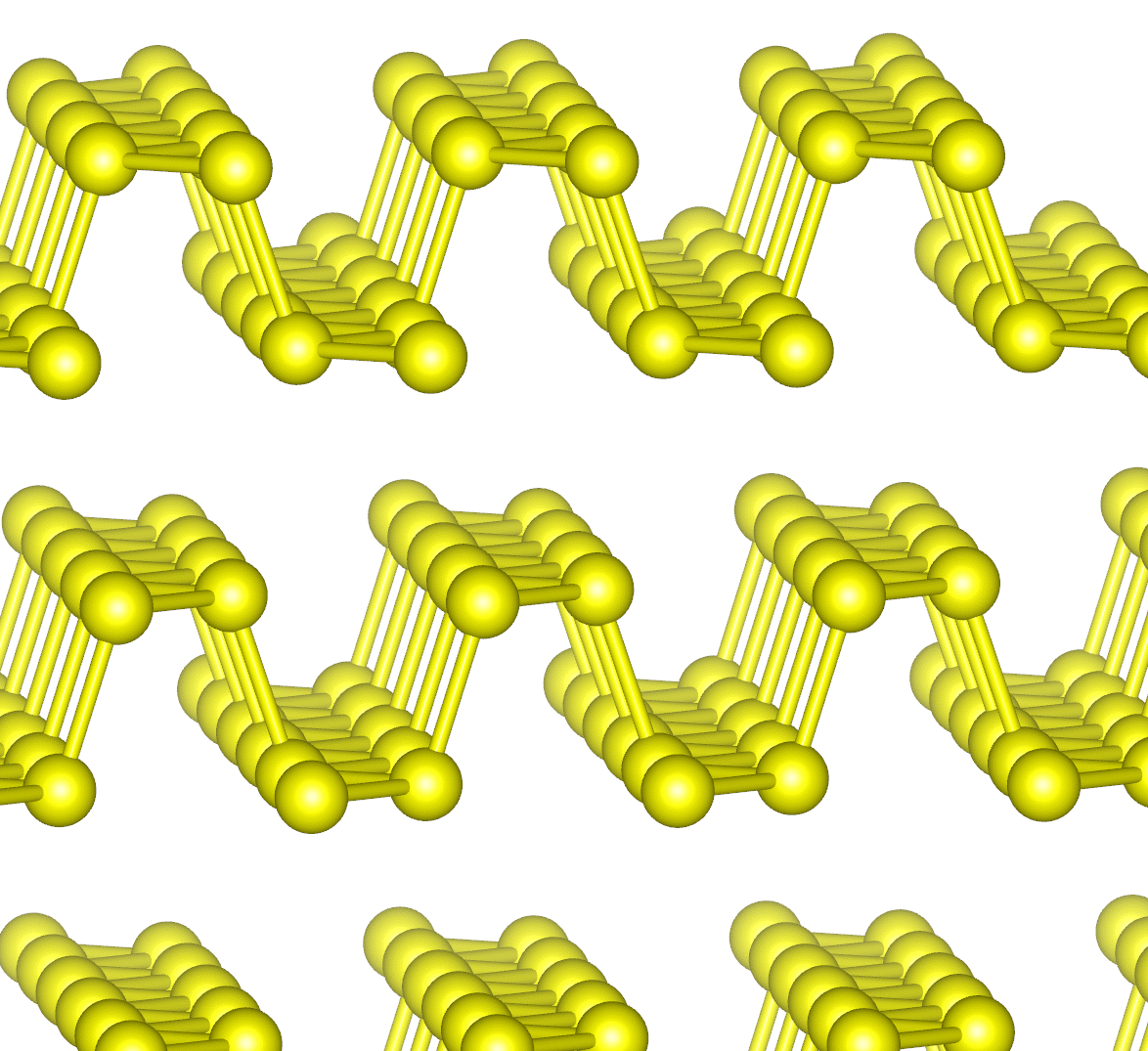
図 5a. 白リンの構成単位である P4 分子。 P-P の結合距離は 0.22 nm。 常温の結晶中では P4 分子の配向は固定されず、 ほぼ自由に回転していると考えられます。 | 図 5b. 紫リン(ヒットルフ Hittorf のリン)の結晶構造。 リンの筒状の構造が並んでできたシート2枚が対になり、層状構造を形成します。 赤リンではこの筒状構造などが複雑に絡まりあって存在しているようです。 |
リンには種々の同素体が存在しますが、 一般によく知られているのは、白リン(通常、一部赤リンが生じたりして黄色がかっているので、黄リンとも呼ばれます)と赤リンです。
通常、白リンは薄黄~橙色のロウのような固体で(密度 1.82 g cm-3)、 空気中で自然発火し、空気との接触を断つため、水中に保管されます。 水には溶けませんが、二硫化炭素 CS2 には非常によく溶けます (室温で二硫化炭素 1 g あたり 10 g ぐらいの白リンが溶けるようです)。 融点が 44.1 °C と温水中でも融け、少し分解もともないながら 280 °C で沸騰します。 白リンは、リンの同素体の中で、25 °C、1 bar で最安定というわけではありませんが(黒リンが最安定)、 容易に高純度のものがえられるので、 リン元素の標準状態として採用されています。
白リンはその発火しやすい特性もありますが、人体に有害であることに留意が必要です。 皮膚に付いた場合、火傷になることは無論、体組織を壊死させる作用があります (反応の結果生じる有機リン化合物が原因)。 直接呑み込んだ場合、0.01 g 程度でも中毒症状が出るようです(致死量は 0.1 g 程度)。 かつて日本では「猫いらず」などに用いられる白リンによる中毒死が大きな問題となっていました。 また「黄リンマッチ」が盛んに使用された 19 世紀から 20 世紀初頭にかけ、 白リンによるマッチ工場の労働者の健康被害(顎の骨が壊死する。「燐顎」 phossy jaw)は大きな社会問題となり、 黄リンマッチの製造・販売を禁止する国際協定が生まれました(ベルン協定 1906)。 これは労働安全衛生に関する最初期の国際的な協定です。 日本では「黄燐燐寸製造禁止法」が1921 年に制定されています (この法律は戦後、労働基準法に引き継がれ、最初の労働基準法(1947 年)には黄リンマッチ製造禁止の条文(48 条)がありました。 現在の労働安全衛生法の 55条に黄リンマッチについての言及があるのは、 こうした歴史的経緯があるようです)。 白リンは反応性が高く空気中で分解しやすいので、 むやみと恐れる必要はありませんが、 白リンが手に付いたりした場合には、すぐに丁寧に洗うようにします。 火傷になったり深刻な場合は、硝酸銀溶液(~ 0.1 mol/L 程度)や硫酸銅溶液を塗るのがよいようです。 白リンは銀(I) や銅(II) を還元して、金属あるいはリン化物を与えます (反応の内実は複雑ですが、白リンを無害化できます)。
白リンは工業的には、リン酸カルシウム Ca3(PO4)2 とシリカ SiO2を、 電気炉中で炭素(コークス)と 1500 °C ぐらいまで加熱して還元、 生成してくるリンの蒸気を冷却、分離して得られています (シリカを加えないとリン化カルシウム Ca3P2 が生成)。 赤リンはその白リンを、空気を断って 250 °C 程度に長時間加熱することで得られます。 赤リンは白リンに比べて安定で(エンタルピー変化は P 1 原子当たり -15 kJ/mol 程度) 密度が高く(密度 2.1 ~ 2.2 g cm-3)、反応性が低く、自然発火などしません。 むしろ難燃性材料として広く使用されています。 赤リンは無定形(アモルファス)固体で、製造の際の条件によってその物性はかなり変動するようです (鉛などを融剤(フラックス flux)に用いて赤リンを結晶化させた紫リン(ヒットルフ Hittorf のリン) も古くから知られていますが、密度も 2.36 g cm-3 とかなり大きく、いわゆる赤リンとは別物と考えた方がよさそうです)。 室温では赤リンは白リンより安定ではあるのですが、 赤リンを加熱して 400 °C 程度を超えるようになると昇華が起きて、 気相でリンは P4 分子として存在し、 リンの蒸気は凝縮すると白リンを与えます。
|
図 B. 黒リン(直方晶系)の結晶構造。 P 原子は凸凹型の薄いシートを形成し、それが積み重なった構造になっています。 |
実験では、赤リンを加熱して白リンを得、 白リンの燃焼を体感してもらいます。 実験には、物理化学研究室に死蔵されていた赤リン(50 年もののビンテージ品?)を使用しています。 古い試薬で、ガラス瓶に入ったものが2本あるのですが、 そのうち1本は、赤リンが少し粘い無色の液体に沈んでいました。 調べてみると液体は強酸性で、リン酸ができています。 ゆっくり空気酸化を受け、生成した五酸化リンが湿気を吸ってリン酸ができていたようです。 水洗、乾燥して使ってもらっていたのですが、今もゆっくり酸化が進んでいるようで、 図 6a のように数年経つとべとついてきます。 どうも赤リン化が十分ではない試薬のようで、 もう1本の方は少し湿っていますがべとついたりはしません。
試験管に赤リンを入れ、脱脂綿で軽く蓋をしてバーナーで加熱すると、 赤リンが昇華して白リンの P4 分子が生成し、 試験管の器壁に白リンの液体が凝縮します。 この時、白リンの酸化、燃焼が起き、 橙色のリンの種々の酸化物ができて試験管に付きますが、 白リンの液滴が付着していることは確認できます(図 6b)。 またしばらくすると、外気の流入を防ぐために栓をしている脱脂綿が焦げてきます(図 6c)。 バーナーの火から外して少し冷ましても、 焼け焦げが広がっていくので、白リンが燃えているのが分かります。 実験室の明かりの下では、この白リン燃焼の炎は明瞭に見えませんが、 暗室に持ち込むと、ボーッと光っているのが分かります(図 6d)。 これが元祖、リン光 phosphorescence です。 最近の化学の教科書でリン光というのは、 系間交叉(項間交叉 intersystem crossing (ISC))やらスピン多重項やら小難しい議論で説明されていることが多いようですが、 元来は白リンの燃焼に代表される、ボーッと光を発する現象一般を指した言葉です。 それが現象から切り離され、狭い学問的関心に閉じ込められているように見えるのは残念です。
白リンの身近な最も顕著な性質というと、自然発火性でしょう。 白リンは空気中でゆっくり燃焼してリン光を発し、その際オゾンなどが生成します。 この白リンの燃焼は古くから注目され、 酸素濃度を上げても下げても起きなくなる(光らなくなる)ことはよく知られてはいたのですが、 そのメカニズムを解明したのは、初期の連鎖反応に関する研究の大きな成果でした。
白リンの塊りは室温でリン光を発しゆっくり燃焼しますが、 微細な結晶になると反応は激しく、 燃え火を立てて燃焼するようになります。 実験では二硫化炭素 CS2 に溶けた白リンが、 二硫化炭素が蒸発するとともに微細な結晶として析出、 空気と激しく反応して燃焼するさまを見てもらいます。 この実験は昔の無機化学実験の定番で、 ぼくはやったことがありませんが、 筆を白リンの溶液に浸して紙に文字(「火」など)を書き、 しばらくすると炙り出しよろしく、焦げて文字が現れ、最後に燃え出すという演出などあったそうです。
この実験で注意すべきは二硫化炭素 CS2 の扱いです。 蒸発しやすい上に(bp 46 °C)非常に発火しやすく(発火点 < 100 °C)、 軽くバーナーで炙ったガラス棒を近づけても発火します。 蒸気密度が高いので机の上を這うように拡散し、 ビーカーに入れた二硫化炭素に、離れたところに置いたバーナーから火が走って引火したこともあるそうです。 また神経に作用し、たくさん蒸気を吸入したり手にこぼしたりすると、 手が痺れたりします (先輩には「気持ちがよくなる」という猛者もいましたが、 目まいや痙攣、幻覚などの症状も出るようです)。
この白リンの燃焼の実験にあたっては、容易ならざるものと向き合っているという心構えを持ってもらうように、 ステンレス容器にそれぞれ二硫化炭素とアセトンを入れたものを用意し、 軽く炙った針金を近づけて発火の実演をやるようにしています。 アセトンは発火しませんが、二硫化炭素はすぐに発火します。 蓋をして鎮火した後、すぐに蓋を開けると、二硫化炭素はまた発火します。 十分冷えると発火は納まりますが、 後には亜硫酸ガスの刺激臭が残ります。
実験ではまず、赤リンが昇華・凝縮して白リンが生成した試験管をよく冷まし、 水と二硫化炭素を注ぎ込んで白リン溶液を作ります。 白リンの融点は 44 °C ですが、過冷却しやすく、 室温近くまで冷えてもたいてい液滴のままです。 試験管が十分冷えてから、水と二硫化炭素を入れて欲しいのですが、 ここを手早く進め、試験管上部がまだ熱いまま、 二硫化炭素を加えるケースがままあります。 氷冷することを指示した方がよいのかもしれません。
二硫化炭素は密度が大きく(密度 1.26 g cm-3)、 白リン溶液としては2層に分かれた溶液の下層を取ることになりますが、 リンの低級酸化物の黄褐色の粉にまとわれて、 きれいに白リン溶液だけをスポイトで取ることは難しいです。 少々水が混じってもよいので、溶液の下部からスポイトで液を取り、 それをキッチンペーパーの上に滴下してもらいます。 すると図 7a のように、二硫化炭素が揮発するとともに、 析出する微細な白リンの燃焼が起き、キッチンぺーパーが焦げます。 白リンの量が多いと図 7b のように燃え上ることもあります。 実験はドラフト中か、 下にロックウールの板(建材用のものを切って使用しています)を敷いて、 局所排気装置の下で行います。

| |
| 図 7a. 二硫化炭素に試験管に付着した白リンを溶かし、 溶液をスポイトでキッチンペーパーに滴下ししばらく置くと、 白煙とともに焦げができます。 | 図 7b. 白リン濃度が高いと、二硫化炭素が揮発した後、発火します。 下に敷いてある黄色い板は建材用のロックウールで、 ロックウールの少し黒ずんでいるところは先輩たちが焦がした跡。 |

| 図 C. 廃液入れの中に、白リンの燃焼にともなう霧がよく発生します。 |
イオウとリンについて、有機の先輩から「イオウは臭い、リンはえぐい」という話をよく聞かされました。 有機リン化合物を扱っての実感がこもっていて、納得させられるものがあります。 こういった物質の体臭(?)とでもいうものを、学生諸君にも味わってもらおうと、 ホスフィン PH3 の課題を入れています。 またテルミット反応は化学反応の可能性を印象付ける上で学生諸君に経験しておいてもらいたいもので、 何とか実験課題に盛り込みたいと考えていたのですが、 2014 年度、リンの化学を取り上げる機会に、それまで市販品を使用していたリン化カルシウム Ca3P2 の合成の形で組み込みました。
元来テルミットというのは、 ゴールドシュミット H. Goldscmidt が発明した、 金属アルミニウム粉末で種々の金属酸化物(特に酸化鉄 Fe2O3)を還元して金属を得る冶金法のことで、 レールの溶接などに使われています (「テルミット Thermit」というのは商標のようです)。 これを広く金属マグネシウム Mg とシリカ SiO2 の反応のように、 金属粉末の関与する、発熱量が大きく高温になる反応一般に拡張して、 テルミット反応と呼んでいます。
| 物質 | -ΔfH° / kJ mol-1 |
| Al2O3 | 1676.8 |
| Fe2O3 | 822.7 |
| Cr2O3 | 1141.3 |
| Ca3(PO4)2 | 4123.6 |
| Ca3P2 | 506.6 |
表 1 にテルミット反応に関わる物質の標準生成エンタルピー ΔfH° をまとめてみました。 よく使用される酸化鉄(III) Fe2O3 の場合、 2Al + Fe2O3 → Al2O3 + 2Fe の標準エンタルピー変化は -854.1 kJ/mol であり、反応進行度当たりの酸化アルミニウムと鉄の熱容量は室温付近でおよそ 130 J K-1 mol-1 程度ですから、単純に考えると 6000 K(~太陽表面の温度)以上温度が上がることになります。 実際には融解熱、熱容量の温度依存性などあって 3000 K 程度の温度上昇に止まるようですが、 鉄(m.p. 1538 °C)はもとよりアルミナ Al2O3(m.p. 2050 °C)も融けてしまいます。 実験室でやる分にも、十分注意しないと事故につながります。
ここで取り組んでもらうテルミット反応 16Al + Ca3(PO4)2 → 8Al2O3 + Ca3P2 の標準エンタルピー変化は -2563.4 kJ/mol。 一方、反応で生成する酸化アルミニウムとリン化カルシウムの反応進行度当たりの熱容量は室温付近でおよそ 700 J K-1 mol-1 程度でしょうから、単純に考えた温度上昇は 4000 K で、酸化鉄(III)に比べると反応は穏やかであると予想できます。 実際、酸化鉄/アルミニウムのテルミット反応は、 マグネシウムリボンなどで点火することで急激に進行しますが、 このリン化カルシウム/アルミニウムのテルミット反応は、室温で点火しても反応が持続せず、 外部からの加熱が必要になります。 これは酸化クロム(III)/アルミニウムのテルミット反応(ΔrH° = -535.5/ kJ mol, Cp ∼ 130 J K-1 mol-1) と同様です。
実験ではまず分量のリン酸カルシウムとアルミニウム粉を混ぜます。 よくリン酸カルシウムの粉がダマになっていて、 アルミニウム粉をまぶしただけになっていることがあります。 ケーキ作りに使う粉ふるいを使うことも考えたのですが、 量も少なく、辛抱強く混ぜてもらえば、そこまでするほどのことはないようです。 反応容器は最初空き缶を切ったりして作ったのですが、 反応熱で穴が開くことが多く、現在は百円ショップで売っている、 厚手のステンレス製の計量スプーンを使っています。
バーナーで加熱すると、 少しアルミニウムの燃焼が起きた後、 急激にテルミット反応が起きます。 酸化鉄/アルミニウムほどではないですが、 なかなかに劇的でアルミナ等も融解します。

| |
| 図 8a. リン化カルシウム/アルミニウムのテルミット反応。 何かえらく盛り上がっています。 | 図 8b. 反応容器が空き缶だと、しばしば反応熱で穴が開きます。 |
ホスフィン PH3(phosphine。IUPAC の系統名はホスファン phosphane で、最近見かけるようになりました。 ちなみにアンモニア NH3 の系統名はアザン azane)の実験室的な合成法には、 白(黄)リンをアルカリに溶かす手法がよく知られていますが、 ここではリン化カルシウム Ca3P2 の加水分解反応を行います。 発生させたホスフィンをどのように確認するかですが、 ここでは素朴に、その臭い(匂い?)と燃焼によることにしています。

|
| 図 10. テルミット反応の生成物を水に投じると、 ゆっくりリン化水素の泡が出てきます。 |
ホスフィン PH3 は、よく「腐った魚のような」と形容される独特な臭いを持っていて (学生さんのレポートには「夏の男子の臭い」という評もありました)、 有機リン化合物にはホスフィンとよく似た臭気を持つものが多いようです。 微量でもこの臭いは強烈で、衣服や体に染みつくと容易に抜けません。 同族の窒素化合物のアンモニアも独特な臭気を持ちますが(”アンモニア臭”)、 それとはまた一味ふた味違っています。 これはなかなか言葉で伝えるのは難しく、実際に経験してもらうのが一番でしょう。 図 10 のように、ビーカーの水にテルミット反応の生成物の一件を入れると、 ゆっくりリン化水素の発生が起き、えも言えぬ臭いを体験できます。
ホスフィンの燃焼は古くから注目を集め 19 世紀初頭からさまざまに検討され、 純粋なホスフィン PH3 は空気中、室温では自然発火せず、 自然発火するのは副生成物であるジホスフィン P2H4 のためであることがわかっています。 今回の実験でテルミット法で合成するリン化カルシウム Ca3P2 から生成するホスフィンはかなり純粋なもののようで、まず自然発火しません。 ただし発火点は低く、容易に発火します (発火点は ICSC では 38 °C)。
テルミットの生成物と水の反応は遅いので、 ホスフィンが容易に発火することを確認するには、 少し塩酸を加え、温水で加温するのがよいようです(図 11a)。 火のついた線香を近づけると、発火して、リン酸の白煙を生じます。 この点、市販のリン化カルシウムには、 一リン化一カルシウム CaP(構造に忠実には Ca2P2)などが含有されていて、 ジホスフィンを多量に副生し自然発火するようです。
| 図 11a. リン化水素の発生を促すために、 塩酸を少し加え、温水に浸して実験しています。 火のついた線香を近づけると、ポット火が付き、白煙が生じます。 | 図 11b. 市販のリン化カルシウムを水中に投じると、 発生したホスフィンが自然発火して賑やかなことになりました。 |
|
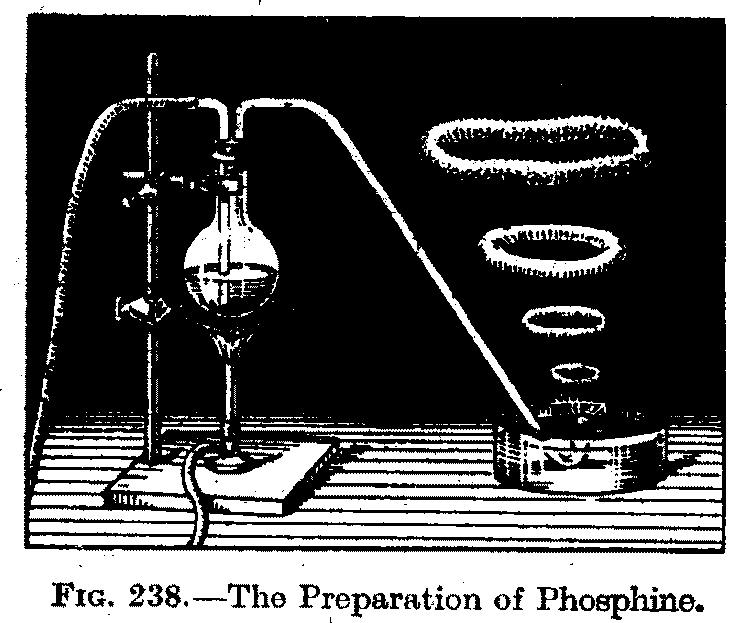
図 D. 昔の教科書に掲載されているホスフィン合成実験の図。 J. W. Mellor, "Modern inorganic chemistry," P. 716, 8th ed, Longmans 1933. |
P4 + 3KOH + 3H2O → 3KPH2O2 + PH3
発生してくるホスフィンの泡を水中からブクブク出すと、 ホスフィンが自然発火してリン酸の煙ができ、ちょうど昔のタバコ好きが子供たち相手にやって見せていたように、 図 D のような白煙の渦が生まれます (昔の無機化学の教科書には、たいていこうした図が掲載されています。 少し手の込んだ構成の実験の図も紹介されていたりして、 かなり人気の実験だったようです。 個人的には懐かしい、下山順一郎他、「製藥化學」(1917)や 森元七、「新無機化学綱要」などにも同様の実験の図があります)。 白リンとアルカリとの反応では、水素やジホスフィンが副生し、 ホスフィン PH3 の純度はせいぜい 60 % 程度のようです。 けれども自然発火と白煙の渦の生成は、それだけで魅力的です。 ぼくは中学校のころ次亜リン酸石灰(Ca(PH2O2)2。以前は強壮剤として処方されたそうです)を乾留してホスフィンを得、 同様の実験をしたことがありますが、今もその感動は忘れません。