|
|
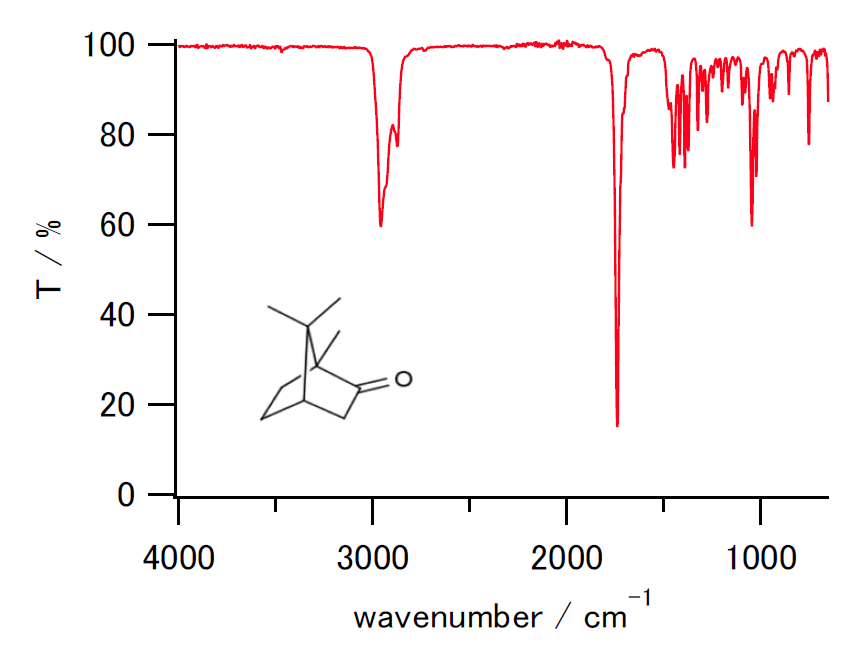
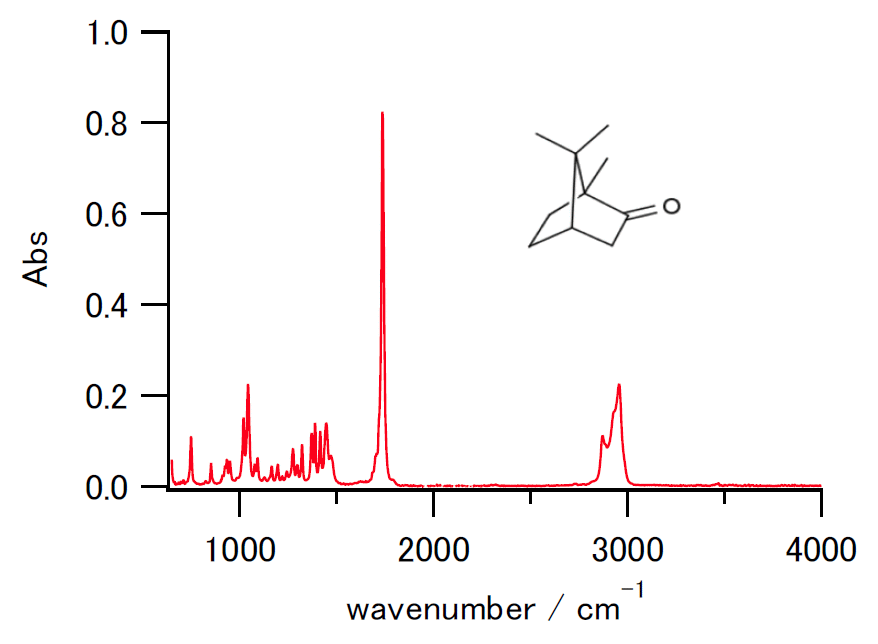
| 今も有機化学でよく行われる透過率表示(左)と、今回の吸光度による表示。 ショウノウのATR法による測定結果。 | |
分子は、電子・振動・回転運動の励起・脱励起に伴い 準位間のエネルギー差に応じて様々な波長の光(電磁波)を吸収・放出する。 赤外(Infrared: IR)光は波長がおおよそ10-4 ~ 10-6 mの光で、 そのエネルギーは分子の振動準位間のエネルギー差と同程度である。 したがって、分子がどの波長の赤外光を、どの程度吸収したかを調べることで、 分子の振動状態に関する情報を得ることができる。 また、赤外光を吸収する際に分子の回転運動も励起・脱励起される場合、 その分子の回転状態に関する情報も同時に得られる。 さらには分子内の特定の官能基(カルボニル基 >C=O、水酸基-OHなど)が特徴的な赤外吸収を示すことから、 赤外吸収分光は化学試料分析法としても有用である。 本実験では、実際に分子の赤外吸収スペクトルを測定し、得られた結果を解析することで、 「赤外吸収の原理」および「赤外分光により何が分かるのか」を理解することを目指す。
本実験は以下の1~3に沿って進める。 赤外スペクトルの測定は、二人一組で行い、得られた結果を共用して解析を行う。 事前に、解説A ~ Hおよび 解説a~cを読んで、 各実験内容の“準備課題”に取り組んでおくことが望ましい。 実験の時間内に各実験内容の“解析・検討課題”に取り組み、配布するシートにまとめ提出すること。
テキストの pdf 版はこちら。
有機化学実験で、 固体・液体の赤外吸収スペクトルの測定を行いましたが、 ここでは気体の赤外吸収スペクトルを中心に、 その原理的なところを探ってみようということになります。 呼気、塩化水素については分子の振動・回転の特徴、 メタノールについては気体と凝集系でのスペクトルの特徴に注目する形になります。 実験の結果・考察はグループごとに、 用意してあるレポートシートに記入、 提出してもらう運びです (書式だったレポートの提出は、塩化水素についてお願いしています)。
赤外吸収スペクトルの測定には、もっぱら有機化学実験でも使用した Agilent の Cary 630を使用します。 Cary 630のスペクトルの分解能は最高およそ2 cm-1で、 測定範囲は650 cm-1(波長15.4 µm)から4000 cm-1(波長2.5 µm)くらいまでです。 ですから二酸化炭素の回転線(間隔 1.5 ~ 2 cm-1ぐらい)などを見るのは困難で、 二酸化炭素の変角振動(666 cm-1)はぎりぎり測れるぐらいということになります。 有機化学実験では分解能を4 cm-1に設定していましたが、 この物理化学実験では分解能を最高の 2 cm-1にして、 積算回数も増やして測定を行います。
なお今回の実験では分子種・振動状態の濃度比を考察する関係から透過率 T 表示ではなく、吸光度 A 表示をとり、 また横軸はエネルギーに対応するという観点から右に行くほど波数が大きくなるようにとります。 したがって有機実験で見ていたのとはかなり外見が異なります。 左右が入れ替わり(指紋領域が左側に来る)、さらに谷が山になります。 また吸光度 A 表示(A = -log10 (T / %) + 2)をとると、強い吸収がより強調される結果、 弱い吸収を見落としがちになるので注意してください。

|

|
| 今も有機化学でよく行われる透過率表示(左)と、今回の吸光度による表示。 ショウノウのATR法による測定結果。 | |
ご参考までに、たまたま昔の資料を整理したら出てきた1988 年ごろの 赤外線スペクトルのチャートを紹介しておきましょう。 このチャートは巻物になっていて、 ペン型レコーダー(今もどこかにあるでしょうか)から、 吐き出されてきたものです (分散型の分光装置で、波数を時間掃引する格好になる)。 4000 ~ 2000 cm-1 の領域の縮尺が 1/4 になっています。 昔はこうした巻物から、物差し片手にピーク位置など読み取ったのです。
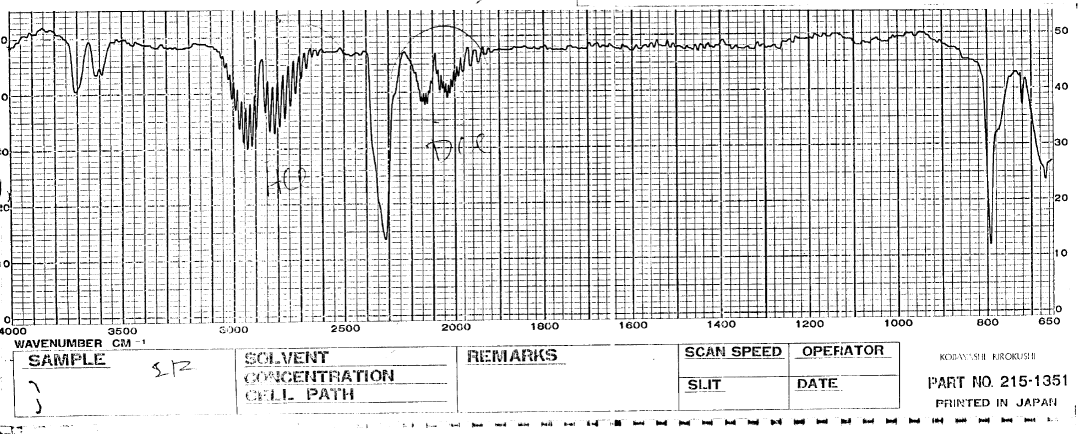
このチャートで 790 cm-1 あたりに吸収が出ているのは、 四塩化炭素 CCl4 によるものです。 今ではちょっと想像できないかもしれませんが、 以前は赤外の窓(NaCl の窓を使っていました)を拭くのに四塩化炭素をふんだんに使っていました。 四塩化炭素 CCl4 は赤外吸収がほとんど現れないので、 赤外の実験では賞用されていたのです。
赤外スペクトルの分野では、しばしばエネルギーを波数 \(\tilde{\nu}\) (波長\(\lambda\) の逆数で、単位長さあたり波がいくつ入っているかを示す) で表示することが行われます。 これは光量子当たりのエネルギー \(E\) と振動数 \(\nu\) の間の関係
\[ E = h \nu = h c \tilde{\nu} \]
に基づいて、\(hc = 1 ~\mrm{[E] [L]}\)となるような単位系を導入したことに相当します (\(h\) はプランク定数、\(c\) は真空中の光速)。 ここで \(\mrm{[E]}\) はエネルギーの単位、\(\mrm{[L]}\)は長さの単位です。 こうすると次の関係が成り立ちます:
\begin{equation} E/\mrm{[E]} = \tilde{\nu} /\mrm{[L]}^{-1} \label{eq:enu_rel} \end{equation}
あからさまにエネルギーと長さの単位 \(\mrm{[E]}\) と \(\mrm{[L]}\) を書かないと約束すると、 エネルギーが波数になり、 波数でエネルギーを表現してもよくなります:
\[ E = \tilde{\nu} \]
この表現は \(hc = 1 ~\mrm{[E] [L]}\) となる単位系を前提としており、 通常 \(\mrm{[L]} = \mrm{cm} \)ととられるので、波数の単位はcm-1、 またエネルギーの単位としては
\[ \mrm{[E]} = hc/\mrm{cm} = 1.9864~ \times~ 10^{-23}~ \mrm{J} \]
が用いられることになります。 ですから回転定数が波数表示で \(B = \hbar/4 \pi c I\) になっているのは、 エネルギーと長さの単位を明示すると(式 \eqref{eq:enu_rel} から \(E = \tilde{\nu} \mrm{[E] [L]}\))
\[ B = \frac{\hbar}{4 \pi c I} \mrm{[E] [L]} = \frac{\hbar}{4 \pi c I} h c = \frac{\hbar^2} {2 I} \]
ということです(\(\hbar = h/2\pi\))。 同様にグラフで縦軸にエネルギーを取った時、 しばしば波数表示で\( E / \mrm{cm}^{-1} \) という表記がなされますが、 折り目正しくは\( E / (hc~\mrm{cm}^{-1}) \) とすべきところです。
また温度 \(T\) をエネルギーの単位として表示するのは、 ボルツマン定数 \(k_{\mrm{B}}\) を用いて
\[ E = k_{\mrm{B}} T \]
の関係に基づいて、 \(k_{\mrm{B}} = 1 ~\mrm{[E]}_T \mrm{[T]}^{-1}\) となる単位系を導入したことに相当します (\(\mrm{[E]}_T\) は温度表示でのエネルギー単位、\(\mrm{[T]}\) は温度の単位)。 温度の単位は通常、ケルビン K で、熱エネルギーの単位としては
\[ \mrm{[E]}_T = k_{\mrm{B}}~ \mrm{ K} = 1.3806 \times 10^{-23} ~ \mrm{J} \]
が用いられるわけです。 したがってエネルギー表示を波数と温度で行った時には次の関係が成り立ちます:
\[ E = \tilde{\nu} \mrm{[E]~ [L]} = T \mrm{[E]}_T \mrm{[T]}^{-1} \] \[ \tilde{\nu} / \mrm{cm}^{-1} = (\mrm{[E]}_T /\mrm{[E]} ) (T / \mrm{K}) = 0.69504 ~(T / \mrm{K}) \]
つまり 1 cm-1 は、(1/0.69504) K = 1.4388 K です。 こうした関係が「エネルギー単位換算表」としてデータブックなどに載っています。 計算などの際にはうまく利用しましょう。
赤外分光に関する課題のテキストは、 歴代の熱心な担当者によって非常に充実したものになっています。 1997年~2007年度にはラマン分光の課題も組み込まれ、 2週間の課題で時間数が多いこともあって、 現在よりはるかに高度な内容が盛り込まれていました (赤外ラマンの交互禁制則はもとより、ラマンの偏光解消度まで入っていた)。 講義で触れられない話題が中心的に取り上げられた結果、 「自学自習」ではとても賄いきれず、全体として実験より講義としての側面が強くなっていたと言えるかもしれません。
こういった状況への反省から 2009年度から、後期の物理・物性化学実験を大きく変えました (「D実験」から「B3実験」として後期のB実験の一部として、化学系全員が履修するにふさわしい実験とする)。 赤外の課題は1週間の課題となり、内容もコンパクトになりました。 塩化水素の測定法も、気体の塩化水素を発生させ専用の気体セルで測るというものから、 アクリル管で作った簡易セルに濃塩酸を滴下して測るという、 簡単迅速なものになりました (シリコン窓を使用するという渡邊さんのアイデアはさすがプロ。 学生実験のように年に数週間しか使用しない現場では、 NaCl や ZnSe の窓はメンテを考えるとあまりに高コスト)。
またここ2年ばかりは、ぼくが直接担当したこともあって、 「机上のデータ」から「実験データ」に即した構成になるように努めたつもりです。 まだまだ”講義”の色彩が強いかもしれませんが・・・