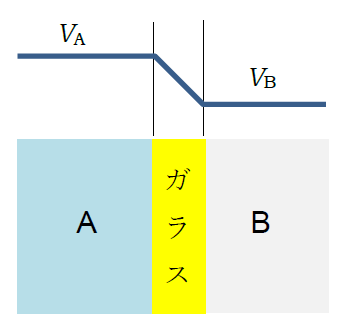
A と B の pH の差に応じた電位が生じる
溶液の酸性度(塩基性度)は化学反応に大きな影響を与え、 生体系などでは、水素イオンと親和性をもつ物質のさまざまな解離平衡が相まって、 水素イオン濃度は精密に制御されている。 pHはこの水素イオン濃度を表す数値あるいは水素イオン指数のことで、 人間の血液のpHはほぼ7.4前後で一定の値をとり、その変動は重大な健康障害を引き起こす。 このように重要な指標であるpHであるが、正確な水素イオンの活量を求めるのは困難で、 通常測定されるのはpH標準液*1を用いガラス電極の電位を用いて操作的に決められたものである (日本では日本産業規格のJIS Z 8802-2011「pH測定法」により定義されている)。 こうして実測されるpHは、測定範囲がpH 3-10、濃度が 0.1 mol/L 以下で、 溶液に緩衝性がある場合には熱力学的定義による水素イオン活量と高い精度で一致させることができる。
ここではまず電気化学的な測定の基礎を確認するために、簡単な濃淡電池の電位の測定実験を行った後、 pHに関わって典型的な弱酸である酢酸、そして典型的な弱塩基としてトリス(ヒドロキシメチル)アミノメタン(以後トリスと略記する) *2を取り上げ、 溶液中の酸塩基平衡についていくつかの実験を通して理解を深める。 実験は2人1組で行う。
この実験ではpH ±0.01 程度の精度の測定を行う。 実験が目指す精度に合わせて、用いる測容器を選択することに注意する(100.01 ≈ 1.023であることに注意)。
*2 塩酸で中和すると塩酸塩を生じる。 トリス-塩酸緩衝液は中性付近で使用可能であり、金属イオンを含まないため生物化学では多用される緩衝液である(資料編V-18参照)。
この実験課題も2人一組で行います。
この課題は、 そもそもの pH 測定の原理に関わる濃淡電池の実験に取り組んだ後、 pH 計を用いて弱酸・弱塩基の濃度にともなう pH 変化 (オストワルド Ostwald の希釈律。元来は電気伝導度に注目したもの)、 弱酸・弱塩基の強塩基・強酸による滴定にともなう pH 変化 (ヘンダーソン-ハッセルバルヒ Henderson-Hasselbalch の式) の検討、 そして緩衝液の調製と性質の確認といういささか盛りだくさんの構成になっています。 弱酸としては酢酸、弱塩基としてはトリスを用います (酢酸を扱う「酢酸組」とトリスを扱う「トリス組」に分けて実験は実施します)。 簡易な pH 計を用いたおよそ ±0.1 程度の pH の実験は、 「実験の基礎」の溶液のpHと緩衝溶液の性質で扱いましたが、 ここではさらに精度の高い ±0.01 程度の pH の実験を行います。

ガラス電極を用いる pH の測定は、右図のようにガラスを介して pH の異なる溶液 A と B をおくと、 pH の差に応じた電位差が発生することを利用しています。 この電位差はガラスの組成等をうまく選ぶことで pH 0 から 13 程度まで、 幅広い領域にわたって pH に比例し、 およそネルンストの式から期待されるように、 室温付近では pH の差 1 あたり 60 mV ぐらいの変化が現れることが知られています (R は気体定数、T は熱力学温度、F はファラデー定数)。
VA - VB = a (pHA - pHB)
a ≈ RT/F ≈ 60 mV
ですから ±0.01 程度の精度で pH を求めようと思うと、 0.1 mV ぐらいの精度で電位をはかる必要があります。 なお電位差は精密にネルンストの式に従うわけではなく、 比例係数 a は用いるガラスの種類あるいはガラス表面の状況等によって、 数%程度変動します (このあたりはそもそもの電位差の起源とも関わって、いろいろ議論のあるところ)。
さてこれで pH が電位の測定から得られるよいとして、 実際の電位差の測定はこれでは終わりません。 たとえば電気回路の電圧を測るように、 図の溶液の A と B に、直接テスターのプローブを浸して、 電圧を測れば電位差が測れるでしょうか? 実際やってみると、テスターの示す電圧の値は少しずつ変動し、 溶液をかき混ぜるだけで大きく変化します。 そうなる原因は、テスターのプローブ(通常銅にメッキしてあります)の表面で、 さまざまな反応が起き、表面の状態が安定しないためです (仮にテスターの内部抵抗が 1 GΩ 程度だとすると、 100 mV だと 10-10 A 程度の電流が流れるわけですが、 ファラデー定数が 105 C/mol ぐらいなので、 3 時間でやっと 10-11 mol 程度の物質の酸化還元が起きることに注意します。 ほんのわずかの不純物が電位に効いてきます)。

このため電位の測定には安定した表面を持つ電極が必要になります。 (濃淡電池の電位測定の課題では銀線を使います)。 こうした安定な電極を参照電極(比較電極)と呼び、最近はもっぱら銀-塩化銀電極 (もっとも簡単には、銀線の表面に塩化銀を析出させたものを、濃い塩化カリウム溶液に浸したもの) が用いられています。 右図に全体のイメージ図を示します。 ガラスの内部に安定な電極を入れてガラス電極を構成し、 参照電極とともに、試料溶液に浸します。 ここで問題になるのは、参照電極と試料溶液の接触する部分、 液絡部 liquid junction です。 この部分の電気伝導を維持し電位差が発生しないよう、 今も多くの努力が払われています (電気化学で「塩橋」というのを聞いたことがいる人がいるかもしれません)。
原理的には先の図でいいのですが、今日 pH の測定に通常用いられる電極は、 ガラス電極、参照電極そして温度計を1本に組み込んだ、 いわゆる 3 in 1 型の複合電極です。 現在学生実験ではオープンジャンクション型と呼ばれる、 高分子電解質を用いた参照電極を組み込んだものを採用しています(Mettler の InLab Expert)。 応答が遅いのですが、メンテナンスがほぼ不要で、年に1週間程度しか出番のない学生実験で使用するには適切であると判断しています。

|

|

|
| pH 電極。 | pH 電極。保護キャップのところがネジになっていて、 ゆるめると保護キャップが外れる。 | 電極の先端部。 2つの小さい穴が参照電極との液絡部になっているらしい。 |
ガラス電極の内部の溶液の pH が一定とすると、 参照電極との間の電位差 V は、試料溶液の pH に対して次のような線形の関係にあります。
V = a pH + b
ところでこの係数 a と b は、数日ぐらいで微妙に変化してしまいます。 そこで測定の前に、pH のよく分かっている標準溶液で電位をはかり、 a と b を較正します(アンプをいじったことのある人なら、ゲインとオフセットの調整に相当すると思ってもらえばいいです)。 この標準溶液としては、もっぱら pH 4、pH 7、pH 9 の標準溶液が使用されます。 標準溶液の pH は温度によっても変化するのですが、 最近のちょっとグレードの高い pH 計では、それぞれの標準溶液の温度依存性のデータが装置内部にメモリーされており、 使用者が標準溶液の pH 値の表を見ながら較正するなどということはありません (資料編にデータを載せてあります。 「実験の基礎」で使用した簡易型の pH 計はマニュアル調整でしたね)。
較正はもっぱら酸側で測定するなら pH 4 と pH 7 で、 塩基性側で測定するなら pH 7 と pH 9 で行えばよいのですが、 幅広く酸塩基にまたがって行う時には、pH 4、pH 7、pH 9 の3点での較正を行うのもアリです。
この較正操作をいい加減にやると、 後の pH の値がずれてくるので、較正には慎重を期して欲しいところです。 特に使用する電極 Inlab Expert は少し応答に時間がかかる(1分ぐらいは見た方がよい)ので、 一端較正が終了した後、 標準溶液の pH を測りなおして、 所定の値と ±0.02 で一致していることを確認してもらうのがよいでしょう。
なお較正の際に水気を拭き取ろうと、 キムワイプなどで電極を強くこすったりするのはよくありません。 強くこするとガラス電極の表面層に傷をつける心配があります。 なお少々イオン交換水が入ってもそこは緩衝液、pH の標準溶液の pH 値には問題ありません (標準溶液同士を混ぜるのはダメ。水道水も不可)。
実験テキストにもあるように、この実験では pH ±0.01 程度の精度の測定を行います。 ですから酸や塩基の濃度の変化量が、水素イオン濃度の変化量と同程度であれば、 調製する溶液の濃度の精度も 1 %(Δ log c ≈ 0.43 Δ c/c)程度あればよいわけです。 ですから、ビーカーや pH 電極が少々水に濡れておろうが、 あまり気にする必要はありません。
この点、酢酸や水酸化ナトリウムは、数%のオーダーで水を吸ったりしていることがあるので、 試薬の純度を 100 % として重さをはかるだけでは精度が不十分で、 市販の標定済み塩酸を利用して、滴定で濃度を決める操作を入れています。 1/100 オーダーの精度でよいので、 少し気軽に溶液の調製はしてもらえばよいでしょう。 また溶液の調製には、積極的に溶液の秤量を取り入れることにしています。 0.01 g まではかれる天秤には、ホールピペット並みの精度が期待できることに注意します。