
|
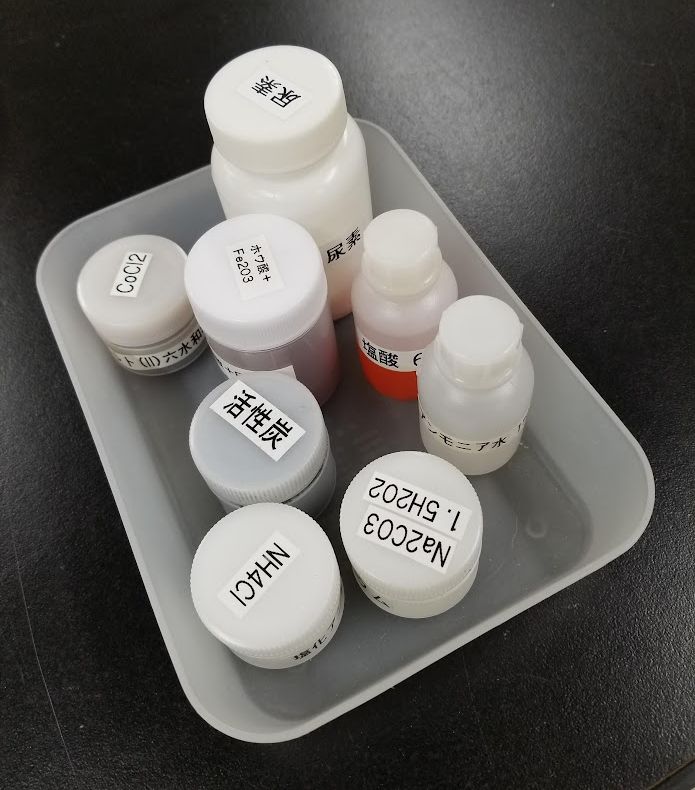
| 図 1. 実験に使用する試薬のセット。 各机に 1 セットずつ配置します。 「ろ過と結晶分取」の必要試薬も入っています。 入れているトレーは百円ショップで購入した、半透明の PP 製のもの。 |
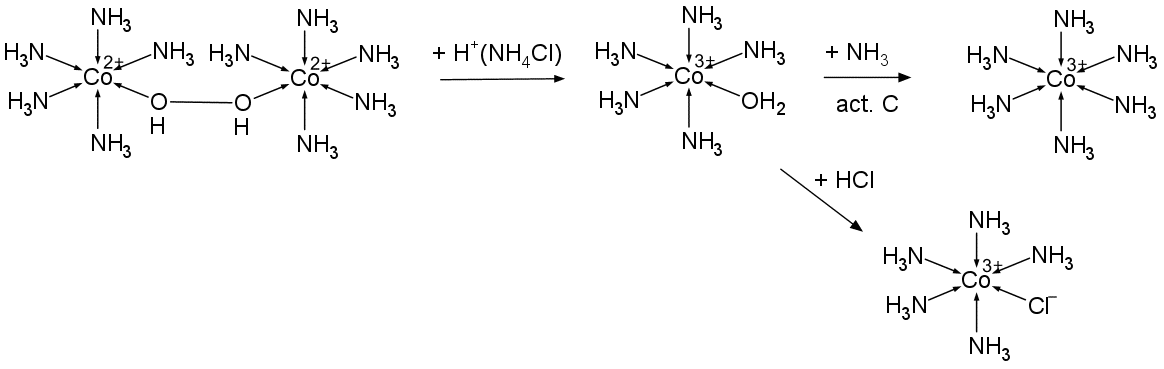
実験では代表的なコバルト錯体である、 ヘキサアンミンコバルト(III) [Co(NH3)6]Cl3(ルテオ luteo 塩(ラテン語で"黄塩"))と ペンタアンミンクロロコバルト(III)([Co(NH3)5Cl]Cl2(プルプレオ purpreo 塩(ラテン語で"紫塩"))の合成を行います。 アンモニア水中で塩化コバルト(II) CoCl2 を過酸化水素で酸化して合成するわけですが、 その際に活性炭を加えておくとルテオ塩が生成し、 何も加えていなければアコ錯体であるロゼオ塩(ラテン語で"バラ塩")[Co(NH3)5H2O]Cl3 が生成、そしてそれをプルプレオ塩にするという段取りです。
コバルトの 2 価と 3 価では、配位子との結合の強さに大きな差があり、 2 価は速やかに配位子の交換が起きる一方(置換活性 substitution labile)、 3 価では容易に配位子の交換が起きません(置換不活性 substitution inert )。 ですから 2 価の状態で配位させ、酸化して 3 価にすれば、 配位した状況を固定させることができるわけです。 この実験では塩化コバルト(II) CoCl2 を、 濃厚なアンモニア水にコバルト(II) のアンミン錯体として溶解させ、 これを過酸化水素で酸化してコバルト(III) のアンミン錯体にしています。
塩化コバルト(II) CoCl2·6H2O と塩化アンモニウム NH4Cl の結晶の水を加えてかき混ぜ、アンモニア水を加えて振り混ぜると、 濃赤色の溶液になります。 この状態のコバルト(II) は空気酸化を受けやすく、 試験管の器壁は黄褐色になります(図 2a)。 このまま空気を吹き込んでコバルト(II) の酸化を行う手法もありますが時間がかかるので(数時間かかります)、 ここでは過酸化水素を使用する手法に従っています。
よく行われるのは 20 ~ 30 mass% ぐらいの過酸化水素水を加える手法ですが、 ここでは取り扱いの容易さ(そして何より価格)から、過炭酸ナトリウムを使用します。 過炭酸ナトリウムは酸素系漂白剤として使用され安価に入手でき(2011 年当時 3 kg 2500 円ぐらい。 今はさらに安くなって 1700 円ぐらい。十年以上使っていますがまだ使い切っていません。安定で有効酸素濃度 11 % をキープ)、 3回生の実験でも鉄シュウ酸錯体の合成や コバルト錯体の合成に利用しています。
実験の手順では、塩化コバルト 4.2 mmol、塩化アンモニウム 19 mmol、アンモニア 30 mmol 入った 約 4 mL の溶液を2つに分け、 それぞれに過炭酸ナトリウムを 0.2 g 加えることになります。 使用している過炭酸ナトリウムの有効酸素濃度は 11 mass% なので、その 0.2 g は過酸化水素 1.4 mmol ぐらいに相当し、 コバルト(II) 2.1 mmol の酸化に必要な量(1.1 mmol)の3割ぐらい過剰ということになります (「有効酸素濃度」は過酸化水素 1 mol から 0.5 mol の酸素が発生 2H2O2 → O2 + 2H2O するものとして算定します)。
なお固形の過酸化水素の付加体で利用できるものには、「過酸化尿素」((NH2)2CO·(3/2)H2O2)もありますが (歯のホワイトニングに人気なようです)、 随分お値段が張ります。
さて実験では過炭酸ナトリウムを加えて黄褐色になった溶液(図 2b)をしばらく湯浴中で加熱してもらいます(図 3a)。 すると活性炭が入っていないと赤紫色に、活性炭が入っていると(活性炭の色に隠れていますが)橙色になります(図 3b)。 このコバルトの酸化反応については、2個のコバルト原子を -OH-OH- で架橋した中間体ができ、 この中間体の中で Co(II) と OH の間で電子移動が起きて Co(III) 錯体になると考えてもらうのがいいでしょう。 つまり酸化の結果できるのは [Co(NH3)5(H2O)]3+ というわけです (このアコ錯体の塩はロゼオ roseo 塩(ラテン語で"バラ塩")と呼ばれます)。 アコ錯体の配位子の水はそのままではアンモニアとの交換がなかなか起きません。 それが活性炭が存在するとアンモニアと置き換わって、 [Co(NH3)6]3+ が生成します
「活性炭」といってもいろいろ種類があって選択に困りますが、 ここでは研究室のストックにあった(数?)十年前の活性炭粉末(おが屑から作った薬品賦活法のもの)を使っています。 活性炭を用いた初期の文献には、 活性炭のパッケージの中央部から取ったものは、上部から取ったものよりはるかに効果が大きいといった記述も見られます。 けれどヤシがら活性炭などでも「スパチュラに1すくい」程度で問題なく反応は進み、 今日「活性炭」と銘打ってある活性炭なら、取りあえず問題ないようです。 なぜ活性炭が存在すると置換がスムーズに進むのかは、えらい先生に聞いてください・・・
|
こうやって合成したロゼオ roseo 塩 [Co(NH3)5(H2O)]3+ とルテオ luteo 塩 [Co(NH3)6]3+ ですが、 ルテオ塩の方(A)はそのまま氷冷して塩酸塩 [Co(NH3)6]Cl3 として析出させます。 活性炭が入っている上に色が濃くて分かりづらいですが、少し試験管を振ってみてもらうと、 橙色の結晶ができていることが確認できると思います。 これをミニろ過装置で分取すると、 図 4a のような、黒ずんだ田んぼの土のようなものがえられます。 これを 3 mL 程度の希塩酸(3 mL の水に 6 N 塩酸を 2~3 滴たらす程度)に加熱しながら溶かし、 熱時ろ過して活性炭を除きます(図 4b。 希塩酸にしたのは、予備実験の時に塩基性塩と思しきものができていたためで(未反応のコバルト(II) か?)、 ただの水でも良いかもしれません)。 そして得られたルテオ塩の溶液に 6 N 塩酸を加えてルテオ塩を析出、分取するわけです(図 4c-e)。
このルテオ塩の分取に際しての注意点は、 溶液の塩化物イオン Cl- 濃度を高く保たないと、 ルテオ塩の溶解度が大きくなることです (最初、活性炭の存在下、コバルト(II) を酸化する段階では塩化アンモニウムを加えていて、 塩化物イオン濃度は 5 mol/L ぐらいになっています)。 溶解度積を考えてもらうと [[Co(NH3)6]3+][Cl-]3 で塩化物イオン濃度の 3 乗に比例し、塩化物イオン濃度が 1/5 程度になると溶解度が 100 倍にもなる勘定です。 ですから分取した結晶を、漫然とイオン交換水で洗浄したりすると、 ルテオ塩が水に溶けて、みるみる収量が減っていきます。 あるいは逆に、塩化物イオン濃度を上げれば析出してくるわけで、 このことを用いて、活性炭を除いた溶液からルテオ塩を析出させ(図 4c)分取しています。 同様の技法は3回生の実験のトリス(エチレンジアミン)コバルト(III) [Co(en)3]+3 錯体の分取でも使用しています。

|

|

|

|

|
| 図 4a. ミニろ過装置で分取した粗製のルテオ塩。 活性炭が入っているので黒ずみ、田んぼの土のように見えます。 | 図 4b. 3 mL 程度の熱希塩酸に溶かし、熱時ろ過して活性炭を除いたところ。 橙色の溶液になりました。 | 図 4c. 6 N 塩酸を加えると、ルテオ塩 [Co(NH3)6]Cl3 の結晶が析出してきます。 | 図 4d. ミニろ過装置で分取したルテオ塩。 上方に見えるのはエッペンで作ったろ過器。 | 図 4e. 分取したルテオ塩をろ紙上に広げて乾燥させます。 右手に見える棒は、ステンレスの針金(径 0.9 mm。番手 #20)を切って作ったもの。 |
さてルテオ塩を得る操作の間に、 ロゼオ roseo 塩 [Co(NH3)5(H2O)]3+ を、 プルプレオ塩 [Co(NH3)5Cl]2+ にするために、 塩酸を加えて湯浴中で加熱しておきます。 塩化物イオンの濃度は 5 mol/L 程度に維持されていて、 配位子の交換が起き、溶解度の低いプルプレオ塩の塩化物 [Co(NH3)5Cl]Cl2 が析出分離してきます(図 5a。 プルプレオ塩の溶解度はルテオ塩の 1/10 程度のようです)。 この時、溶液側の色が青くなることがありますが(図 5b)、赤紫色のプルプレオ塩が析出しておれば、 あまり心配しなくて構いません (これは酸化が不十分で、未反応のコバルト(II) のクロロ錯体ができているためであると思われます)。 なおこの [Co(NH3)5(H2O)]3+ と [Co(NH3)5Cl]2+ の配位子の交換反応は古くから研究され、 室温付近での速度定数は 10-6 s-1 mol-1 L 程度と(室温、塩化物イオン濃度 1 mol/L で半減期が週単位)、 非常に遅い反応です(”置換不活性”)。
以前は(2016 年度まで)市販の 36 mass% 程度(12 N = 12 mol/L)の濃塩酸を用いていたのですが、 現在は安全性を考慮して半分に希釈した 6 N の塩酸を使用しています。 反応が進まなかったり、所要時間が長くなったりするかと心配したのですが、実際にやってみるとその必要はなく、 加える容量・時間などそのままにして実施しています。

|

|

|

|

|
| 図 5a. 得られたロゼオ塩の溶液(図 2b)に塩酸を加え、加熱を終えたところ。 赤紫のプルプレオ塩が沈殿しています。 | 図 5b. 溶液の色が赤紫というより、青くなることもありますが、 プルプレオ塩はできているので、心配することはありません。 | 図 5c. ミニろ過装置でプルプレオ塩 [Co(NH3)5Cl]Cl2 の結晶を分取します。 | 図 5d. 分取したプルプレオ塩。 | 図 5e. 分取したプルプレオ塩を、ろ紙上で広げて乾燥させます。 |

|
図 6. プルプレオ塩 [Co(NH3)5Cl]Cl2(左)と ルテオ塩 [Co(NH3)6]Cl3(右)の 0.2 mass% 溶液。 光学セル(アクリル製)の側面から撮ってみました。 |
最近の無機化学の教科書では、正八面体型の遷移金属錯体で d 軌道の縮退が解け、 2つのエネルギー準位に分裂するという話を教わることでしょう。 ここらで止めておけば、分光化学系列や高スピン錯体や低スピン錯体といった話題で、 その必要性がまあ分かった気になるでしょう。 けれどもスピンや軌道角運動量が登場して項記号などが出てくると(ラッセル-ソンダース Russell - Saunders 結合)、 「理屈はそうかもしれないが、重箱の隅をつついて、それで何なのだ」と思われるかもしれません。 実のところ、そういった話はここで測ってもらう、 遷移金属錯体の可視吸収スペクトルに関わって展開されたといってよいのです。
|
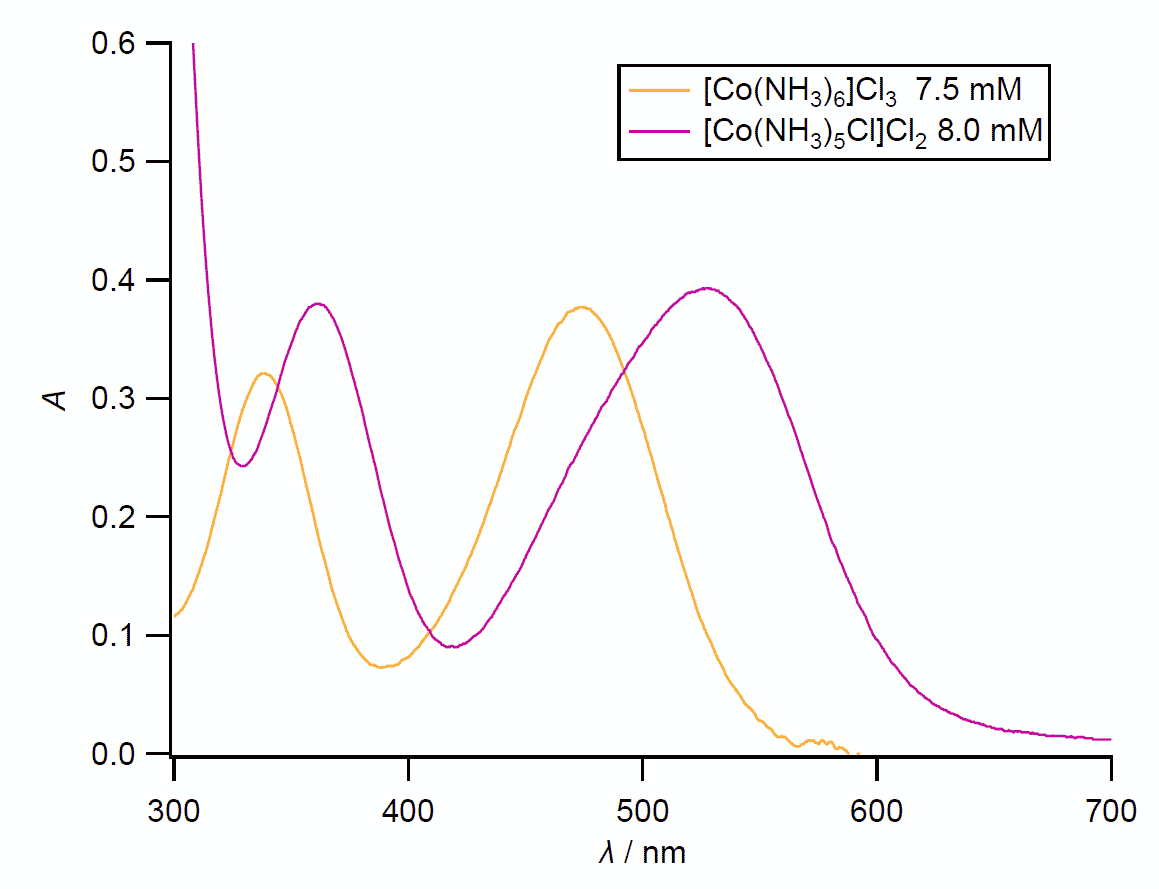
| 図 7. ルテオ塩 [Co(NH3)6]Cl3 とプルプレオ塩 [Co(NH3)5Cl]Cl2 の吸収スペクトル (再掲)。 光路長 1 cm。 |
遷移金属錯体、特にコバルト(III) 錯体は、赤、橙、青、緑さまざまな色合いを示し、 その美しさに魅了されてか、さまざまに研究されてきました。 今回調べてもらうルテオ塩 [Co(NH3)6]Cl3 とプルプレオ塩 [Co(NH3)5Cl]Cl2 の可視吸収スペクトル(図 7)などは、 その典型的なものともいえるでしょう。
遷移金属錯体の可視吸収スペクトルの特徴の一つは、 染色の実験で扱った色素などに比べて、吸光度が小さいことです(無論、 フェロインなど例外は多々あります)。 同じモル濃度で比較すると、吸光度は百分の1といったところで、 染料であれば色が濃くてほとんど黒く見えます(染色の実験で扱った、 クリスタルバイオレットなどの染料原液(0.5 mass%)を思い出してもらうとよいでしょう)。 この吸光度が小さい(吸光係数が小さい)ことが、 金属錯体の結晶の鮮やかな彩(いろどり)を演出する大きな要素です。 もし染料並みに光を吸収すれば、黒光りする結晶ばかりになってしまいます。 「d-d 遷移は禁制だ」(ラポルテ Laporte 禁制)とかいう話は、 こういうところに持ち出される理屈になります。
また配位子が1つアンモニア NH3 から塩化物イオン Cl- に変化したからと言って、 吸収スペクトルが劇的に変化するわけではなく、 形状はほぼ保ったまま長波長側にシフトするのも、 当たり前のようですが、興味深い点です(プルプレオ塩 [Co(NH3)5Cl]Cl2 の 530 nm 付近のピークは低波長側 500 nm 付近に少し ”肩” がありますが、 ここでは置いておきます)。 さまざまな金属錯体について、こうしたピークのシフトから配位子を整理した槌田の研究は有名です (分光化学系列 spectrochemical series)。
そしてもう一つ見ておいて欲しいのは、 コバルト(III) の錯体の場合、吸収のピークが2つ観察されることです。 教科書には正八面体錯体では d 軌道が 2 種類のエネルギー準位に分裂するとあります。 それなら吸収のピークは 1 つでいいはずではないでしょうか? なぜ 2 つあるのでしょう(先述の槌田の論文からは、 このあたりのかつての混沌とした状況が垣間見えます)。 これに答えるには(単純な分子軌道法的発想では無視されている)励起状態での電子間の相互作用のありようを考慮する必要があり、 こうした問題に系統的に答えようとしたのが、 スピンや軌道角運動量などについての議論だと思ってもいいでしょう。 (「On the Absorption Spectra of Complex Ions」と題する田辺-菅野の研究は有名です。 ぼくが若い頃は「配位子場理論とその応用」がよく読まれていましたが、 今はどうでしょうか)。

|
図 8. クロム(III) のシュウ酸錯体 K3[Cr(C2O4)3]·3H2O の溶液の色。左から 1.0, 0.67, 0.33 mass%。 薄くなるにつれ赤みが減っていくように感じられます。 |
まあ理屈はともかく、 宝石のように、金属錯体の色をただ眺めるだけでもいいでしょう。 実験室の試薬棚にはクロム、ニッケル、鉄、マンガンの錯塩などいろいろありますから、適宜、調べてもらえることを期待しています。 残念ながら有志がとんと現れないのですが・・・ 図 8 に示すのは、クロム(III) のシュウ酸錯体 [Cr(C2O4)]-3 の溶液を希釈していった時の色の変化です。 色が薄くなっていくのは当たり前ですが、赤みが減っていくように見えるのは興味深いところです。 また試験管に入った溶液をいろんな方向から眺めていると、 赤みが減ったり増えたりしてしてクロム(← ギリシャ語 χρώμα 「色」)の名に恥じない姿を見せてくれます。 吸光係数を見る分には吸収スペクトルは変化しないわけですが、 光の強度は吸光度に指数関数的に依存し、 そのことがこうした挙動を演出しているようです。 ちなみに塩化クロム(III)二水塩の結晶は [CrCl2(H2O)4]Cl·2H2O というクロム(III) のジクロロ錯体でできていて、水に溶かすと最初は緑色ですが、時間がたつにつれ加水分解が進み、 翌日になるとヘキサアコ錯体 [Cr(H2O)6]3+ の紫色になります。

|

|
|
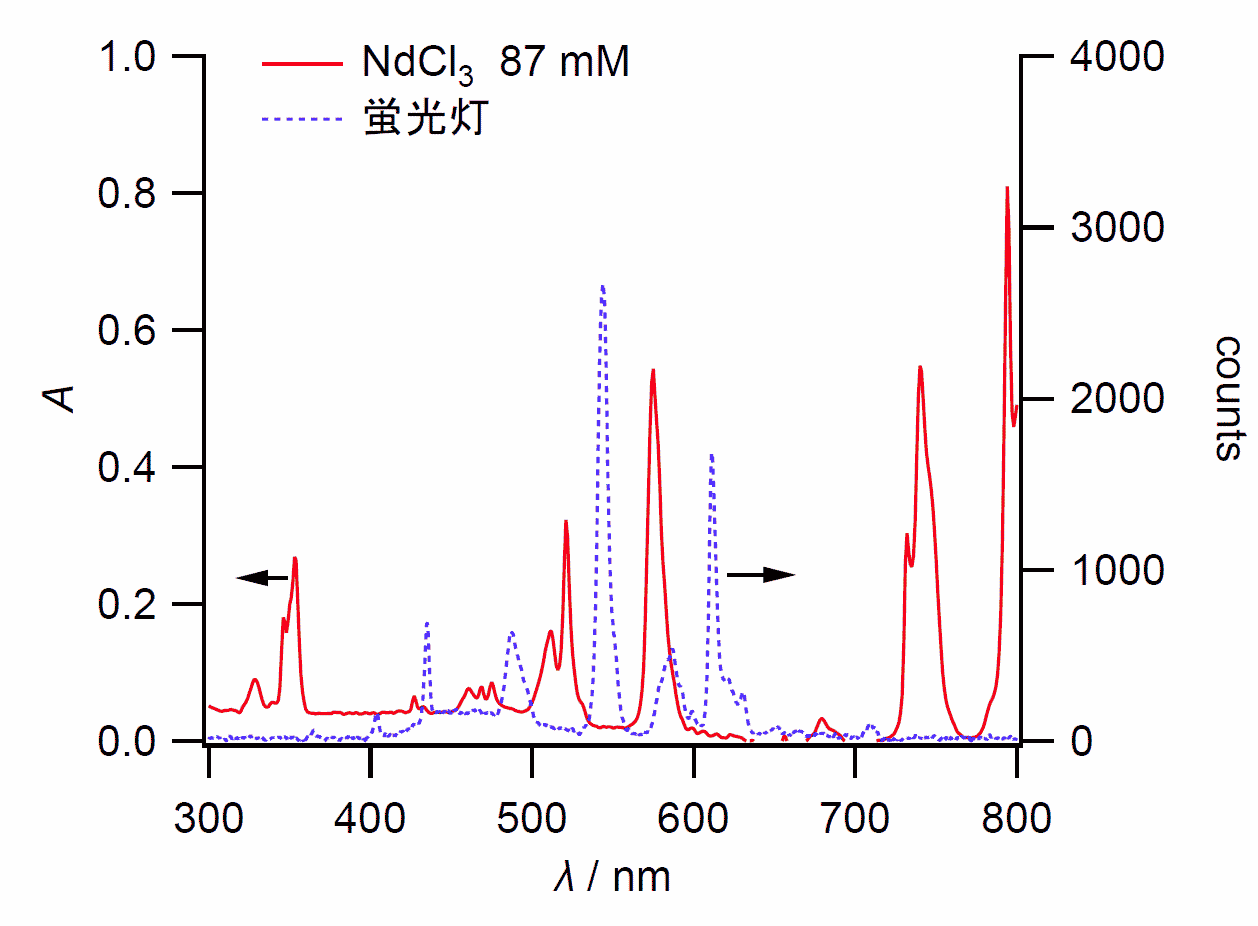
| 図 Aa. 塩化ネオジムの溶液を白色 LED 光で見た時 | 図 Ab. 塩化ネオジムの溶液を蛍光灯で見た時 | 図 B. 塩化ネオジムの溶液の吸収スペクトル(赤線) と蛍光灯の強度スペクトル(青い点線) |
とまあ、学生さんにはこうした結晶場めいたをするのですが、 個人的にはあまり好きな理屈ではありません。 というのは、ぼくが肝要の所と思う「なぜ正八面体構造なのか」について、 そもそも所与のものとして、はぐらかされてしまうからです。 この点、d2sp3 混成のような混成軌道の立場からする説明の方が、 ぼくにはすんなり来ます (ポーリング「一般化学」で育った(第3版ではなく旧版)という過去があるせいかもしれませんが・・・)。 メタンが正四面体構造なのを sp3 混成軌道で説明して得々としている人たちが、 遷移金属錯体の話になった途端、 手のひらを返したように結晶場(と少しの配位子場)の理論で済ましているようなのは残念です。 昔のぼくはそういう人たちを、錯塩の色に溺れた「色きちがい」などと悪口を言ったりしたものでしたが、 今は少しは賢くなったようです。